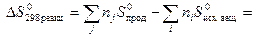- Изменение энтропии для химических процессов
- Вычисление энтальпии реакции
- Определение температуры наступления равновесия реакции
- Определение направления химической реакции
- Расчет энергии Гиббса реакции образования беспорядочного клубка лизин
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Энтропия. Энергия Гиббса
- Понятие энтропии
- Абсолютная энтропия веществ и изменение энтропии в процессах
- Стандартная энтропия
- Стандартная энтропия образования
- Энергия Гиббса
- Стандартная энергия Гиббса образования
- Энтальпийный, энтропийный фактор и направление процесса
- Примеры решения задач
- Задачи для самостоятельного решения
- Пример расчета изменения энтропии химической реакции.
- 📹 Видео
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Изменение энтропии для химических процессов
Задача 55.
Вычислите изменение энтропии для химических процессов, протекающих по уравнениям:
a) 2NO(г) + O2(г) = 2NO2(г);
б) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Решение:
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
a) 2NO(г) + O2(г) = 2NO2(г)
Для этой реакции составaим уравнение расчета изменения энтропии в стандартных условиях:
По табличным данным установим значения энтропий (S°) участников процесса (Дж/моль·К):
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
ΔS° = (2 · 240,2) – [(2 · 210,6) + 205,0] = -145,8 Дж/(моль·К).
Заметим при этом, что отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
б) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Для этой реакции составим уравнение расчета изменения энтропии в стандартных условиях:
ΔS° = [2 · S0SO2(г) + 2 · S0H2O(ж)] – [2 · S0H2S(г) + 3S°O2(г)].
По табличным данным установим значения энтропий (S0) участников процесса (Дж/моль·К):
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
ΔS° = [(2 · 248,1) + (2 . 70,1)] – [(2 · 205,7) + (3 · 205,0)] = -390,0 Дж/(моль·К).
Таким образом, отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
Вычисление энтальпии реакции
Задача 56.
Экспериментально установлено, что при взаимодействии 2,3 г натрия с водой выделяется 14,0 кДж теплоты. Вычислите энтальпию реакции.
Решение:
m(NaOH) = 2,3 г;
М(NaOH) = 46 г/моль;
Q = 14,0 кДж.
Уравнение реакции:
2,3 г 14,0 кДж
2Na + 2H2O = 2NaOH + H2; ΔH = ?
2* 43 г
Вычисляем энтальпию реакции из пропорции, получим:
2,3 г — 14,0 кДж
46 г —- х кДж
х = (46 . 14)/2,3 = 280 кДж.
ΔH = 280 кДж.
Можно проверить, используя табличные данные и следствие из закона Гесса, получим:
∆H°(Н2О) = -285,8 кДж;
∆H°(NaOH) = -425,6 кДж.
∆H° = [2∆H°(NaOH) — 2∆H°(Н2О)] = 2(-425,6) — 2(-285,8) = 280 кДж.
Задача 57.
1. Определить энтальпию образования CaHPO4(к), если термохимическое уравнение реакции имеет вид:
2Ca(OH)2(к) + P2O5(к) = 2CaHPO4(к) + H2O(г); ∆H = –1587 кДж.
Решение:
∆H°Cа(OН)2(к) = -985,1 кДж/моль;
∆H°Р2О5(к) = -1507,2 кДж/моль;
∆H°Н2О(г) = -241,81 кДж/моль;
∆H°CаНРО4(к) = ?
Согласно 2-му следствию из закона Гесса, изменение энтальпии химического процесса (ΔН°) определяется как разность сумм энттльпий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтальпии реакции получим:
Ответ: ∆H°CаНРО4(к) = -23713 кДж/моль.
Р.S. Слишком большое расхождение с табличными данными (-1808,6 кДж/моль) указывает на то, что ∆H° = –1587 кДж, указанное значение в условии задачи, иное (-381,6 кДж/моль).
Определение температуры наступления равновесия реакции
Задача 58.
При какой температуре наступит равновесие системы: CO(г) + 2H2(г) = CH3OH(ж)?
Решение:
∆H°CO(г) = -110,52 кДж/моль;
∆H°CH3OH(ж) = -238,9 кДж/моль;
S°(СО) = 197,55 Дж/моль . К;
S°(Н2) = 130,52 Дж/моль . К;
S°(СН3ОН) = 126,78 Дж/моль . К.
1. Находим ∆H°х.р. для данной системы.
Согласно 2-му следствию из закона Гесса, изменение энтропии химического процесса (ΔН°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
2. Находим ∆S°х.р. для данной системы
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆S°х.р. = S°CH3OH — S°CO – S°H2;
∆S°х.р. = 129,78 – 197,55 – 130,52 =
= -331,81 Дж/(моль . К) = -0,33181 кДж/(моль . К).
3. Находим температуру равновесия системы
Для расчета температуры равновесия системы используем формулу: ∆G° = ∆H° — T∆S°.
В состоянии равновесия системы ∆G° = 0.
В этом случае — 0 = ∆H° — T∆S°.
Т = ∆H/∆S° = -128,38 кДж/моль/-0,33181 кДж/(моль . К) =
= 386,9 К.
Ответ: равновесие системы наступит при 386,9 К.
Определение направления химической реакции
Задача 59.
Дано уравнение: Fe2O3 + 2Al = Al2O3 + 2Fe. Вычислить тепловой эффект реакции, изменение стандартной энергии Гиббса при температуре 25 °С. В каком направлении будет протекать данная реакция?
Решение:
∆H°Fe2O3(к) = -822 кДж/моль;
∆H°Аl2O3(к) = -1675,7 кДж/моль;
S°Fe2O3(к) = 87 Дж/(моль . K);
S°Al2O3(к) = 50,9 Дж/(моль . K);
S°Fe(к) = 164,4 Дж/(моль . K);
S°Al(к) = 27,15 Дж/(моль . K).
1. Расчет энтальпии реакции получим:
∆Н(х.р.) = ∑∆Н(обр.прод.) — ∑∆Н(обр.исх.);
∆Н(х.р.) = [∆Н°Al2O3(к)] – [∆Н°Fe2O3(к)];
∆Н(х.р.) = (-1675,7) — [-822] = –853,7 кДж.
2. Расчет энтропии реакции получим:
∆S°(х.р.)= ∑S°(обр.прод.) — ∑S°(обр.исх.);
∆S°(х.р.) = [S°Al2O3(к) + S°Fe(к)] — [S°Fe2O3(к) + S°Al(к)];
∆S°(х.р.) = (50,9 + 164,4) – (87 + 27,15) = 101,15 Дж/(моль·К) = 0,10115 Дж/(моль·К).
Переведем температуру из шкалы Цельсия в шкалу Кельвина: Т = 273 + 25 = 298 К. Для расчета ∆G°(298) воспользуемся уравнением:
∆G°(298) = ∆H° – T∆S°;
∆G°(298) = –853,7 – 298·(0,10115) = -883,8427 кДж.
Ответ: ∆Н(х.р.) = –853,7 кДж; ∆G°(298) = -883,8427 кДж.
Расчет энергии Гиббса реакции образования беспорядочного клубка лизин
Задача 60.
В отсутствии денатурирующих агентов константа равновесия Кр реакции образования беспорядочного клубка лизина при 298 К и рН = 7 равна 7,8. Рассчитать ∆G° 298 и оценить биологический аспект полученной величины.
Решение:
Рассчитаем ∆G°298 из формулы ∆G° = –RTlnK, получим:
∆rG°298 = –RTlnK = -[8,314 Дж/(моль . К) . 298 K . ln7,8] = -(8,314 . 298 . ln7,8) = -(8,314 . 298 . 2,054) = -5089 Дж/моль.
Так как ∆G° имеет отрицательное значение, (∆G°
Если ∆G° равно нулю (∆G° = 0), то реакция находится в равновесном состоянии.
Если ∆G° положительно (∆G° > 0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Please wait.
Видео:Энтропия. 10 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Что такое Энтропия?Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7066236e7a966b38 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Энтропия. Энергия Гиббса
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Видео:Свободная энергия Гиббса. 10 класс.Скачать

Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Видео:Закон Гесса. Энтальпия. ТермохимияСкачать

Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25 о С). Энтропия в этом случае обозначается S о 298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (S о ) увеличивается при повышении температуры.
Видео:Обратимые и необратимые процессы. Энтропия. Второй закон термодинамики. 10 класс.Скачать

Стандартная энтропия образования
Стандартная энтропия образования ΔS о f,298 (или ΔS о обр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Видео:Энергия ГиббсаСкачать

Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG
Видео:ВСЯ теория и ВСЕ качественные задачи по МКТ и Термодинамике для ЕГЭ 2024 по физикеСкачать

Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δG о f,298 (или δG о обр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δG о f,298 = 0.
Видео:Энтальпия реакции. Решение задачи.Скачать

Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔG о Т = ΔН о Т — ΔТS о Т. При низких температурах ТΔS о Т мало. Поэтому знак ΔG о Т определяется в основном значением ΔН о Т (энтальпийный фактор). При высоких температурах ТΔS о Т – большая величина, знак Δ G о Т определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔН о Т) и энтропийного (ТΔS о Т) факторов существует четыре варианта процессов.
- Если ΔН о Т о Т > 0, то ΔG о Т
- Если ΔН о Т > 0, ΔS о Т о Т > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔН о Т о Т о Т о /ΔS о (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔН о Т > 0, ΔS о Т > 0, то ΔG о Т ΔН о / ΔS о (процесс идет при высокой температуре за счет энтропийного фактора).
Видео:Обратимые и необратимые процессы. Энтропия. Второй закон термодинамики. Практическая часть.10 класс.Скачать

Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
Объяснить знак и величину ΔS о .
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| S о 298, Дж/(моль·К) | 192,66 | 205,04 | 210,64 | 69,95 |
В данной реакции ΔV o х.р.,298
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| S о 298, Дж/(моль·К) | 191,50 | 130,52 | 205,04 | 151,04 |
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония S о 298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ S о 298 всегда больше нуля, в то время как величины ΔS 0 f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
равно δG о 298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔS о о 298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔS о
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔG о f,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| S о 298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔG о х.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
Поскольку ΔS о х.р.,298 > 0, то при температуре Т>ΔН о /ΔS о величина ΔG о х.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔG о f,298 и S о 298, определите ΔH о 298 реакции:
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔG о f,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| S о 298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔG о 298 = ΔН о 298 – ТΔS о 298. Подставляя в это уравнение величины ΔН о 298 и ТΔS о 298, получаем:
ΔН о 298 = –182,25× 10 3 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔS о 298 выражена в Дж/(моль× К), то при проведении расчетов ΔG 0 298 необходимо также выразить в Дж или величину ΔS 0 298 представить в кДж/(мольK).
Видео:Энергетика химических реакцийСкачать

Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔS о f,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
Видео:Тепловой эффект реакции. ЗадачиСкачать

Пример расчета изменения энтропии химической реакции.
Используя абсолютные значения энтропии, вычислите изменение энтропии реакции образования этанола из простых веществ.
| Вещество | C2H5OH(ж) | C(графит) | H2(г) | O2 (г) |
| S 0 , Дж/моль×K | 158,99 | 5,69 | 130,58 | 205,02 |
Решение. Запишем уравнение реакции образования этанола:
Для расчета изменения энтропии используют формулу:
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
Используя справочные данные о стандартных теплотах образования, стандартных энтропиях и стандартных энергиях образования Гиббса, рассчитайте для реакции своего варианта при 298 K тепловой эффект реакции ( 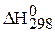
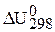
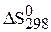
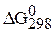
1. Рассмотрите значение 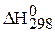
2. Рассмотрите смещение химического равновесия при увеличении температуры и давления.
3. Укажите, каким образом будет изменяться константа равновесия при увеличении температуры.
Полученные значения 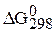
Т а б л и ц а 1.3
Варианты индивидуальных заданий
| № варианта | Уравнение реакции | 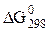 , кДж/моль , кДж/моль |
| H2(г) +CO2(г)=H2O(ж)+ CO(г) | 20,00 | |
| H2(г) +CO2(г)=H2O(г)+ CO(г) | 28,64 | |
| 2H2(г) +CO(г)=CH3OH(г) | -26,20 | |
| 3H2(г) +CO(г)=CH4(г)+H2O(г) | -142,37 | |
| 2H2(г) +2CO(г)= CH4(г)+CO2(г) | -171,01 | |
| 2H2O(г) +3CO(г) =CH3OH< г)+ 2CO2(г) | -83,48 |
| 4CO(г)+ 2SO2(г)= S2(г)+ 4CO2(г) | -350,16 |
| CO2(г)+2H2S(г)=2H2O(г)+CS2(г) | 70,74 |
| 2SO2(г)+4H2S(г)=6S(РОМБ)+ 4H2O(г) | -178,90 |
| 4HCl(г)+O2(г)=2H2O(г)+2Cl2(г) | -76,08 |
| 4NH3(г)+5O2(г)= 6H2O(г)+4NO(г) | -984,84 |
| 2NO2(г)+O3(г)= O2(г)+N2O5(г) | -148,01 |
| NH4NO3(т)=N2O(г)+ 2H2O(г) | -169,38 |
| 2AgNO3(т)=2Ag(т)+2NO2(г)+O2(г) | 125,68 |
| 2H2S(г)+CH4(г)=CS2(ж)+4H2(г) | 182,97 |
| C2H2(г)+2H2(г)=C2H6(г) | -241,62 |
| C2H4(г)+H2O(г)=C2H5OH(г) | -13,96 |
| 3C2H2(г) =C6H6(ж) | -501,43 |
| C2H4(г)+3O2(г)=2CO2(г)+2H2O(ж) | -1332,47 |
| 2CH3OH(г)+2O2(г)= 2CO2(г)+4H2O(ж) | -1412,00 |
| CH3COOH(ж)+ 2O2(г)=2CO2(г)+ 2H2O(ж) | -874,46 |
| CH3-C-CH3(ж)+4O2(г)=3CO2(г)+ 3H2O(ж) ½½ O | -1740,62 |
| 2C2H6(г)+7O2(г)=4CO2(г)+ 6H2O(ж) | -2936,96 |
| C2H5OH(ж)+3O2(г)= 2CO2(г)+ 3H2O(ж) | -1327,15 |
| C6H12O6(т)=2C2H5OH(ж)+ 2CO2(г) | 213,68 |
| C6H12O6(т)+6O2=6CO2(г)+ 6H2O(ж) | -2881,24 |
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Известно, что многие химические реакции не доходят до конца, т. е. исходные вещества не расходуются полностью на образование продуктов реакции. В этом случае система находится в состоянии динамического равновесия, с течением времени при определенных условиях скорость прямой реакции становится равной скорости обратной реакции. При неизменности внешних условий система находится в состоянии равновесия сколь угодно долго, при этом с термодинамической точки зрения соотношение концентраций исходных веществ и продуктов реакции поддерживается постоянным и отвечает минимальному значению свободной энергии Гиббса. Постоянство состава системы может служить признаком, достаточным для констатирования наступления равновесия, лишь для реакций, протекающих сравнительно быстро. Для реакций, протекающих с незначительной скоростью, состав смеси может оставаться постоянным продолжительное время и состояние равновесия оказывается кажущимся. Для установления равновесия необходимо воспользоваться вторым признаком равновесия — признаком его подвижности. Если система, находящаяся в состоянии равновесия, будет выведена из этого состояния под действием внешних факторов (температура, давление), то после прекращения этих воздействий она самопроизвольно должна вернуться в прежнее состояние. Однако, если этого не происходит, то система не достигла еще состояния равновесия. Поэтому состояние химического равновесия характеризуется двумя признаками: постоянством состава при данных внешних условиях и подвижностью. Состав равновесной смеси характеризуется тем, что в ней концентрации исходных веществ и продуктов реакции находятся в определенном соотношении, которое определяется константой равновесия.
Для реакции аА + вВ = еЕ + fF при равновесии скорость прямой реакции равна скорости обратной реакции и константа равновесия (Кс) может быть представлена соотношением:
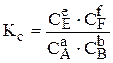 | (2.1) |
где С — равновесные мольные концентрации веществ; а, в, с, f — стехиометрические коэффициенты.
Константу равновесия можно выразить через равновесные парциальные давления компонентов системы:
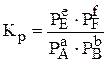 | (2.2) |
Связь между Кр и Кс описывается уравнением Кр = Кс(RT)Dn.
Учение о химическом равновесии позволяет рассчитывать выход продуктов реакции и раскрывает возможности управления химическими процессами. Следует помнить, что равновесие системы может смещаться при изменении концентрации реагирующих веществ, давления и температуры, константа же равновесия зависит только от температуры. Данная зависимость описывается уравнением изобары (2.3) или изохормы (2.4) Вант-Гоффа:
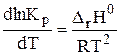 | (2.3) |
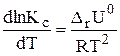 | (2.4) |
где DrН0 — изменение энтальпии, DrU0 — изменение внутренней энергии системы.
Для химических реакций DrН0 и DrU0 соответствуют тепловому эффекту реакций соответственно при р = const и v = const. Знак теплового эффекта определяет зависимость константы равновесия от температуры. Если DrН0 > 0, то реакция эндотермическая, знак производной dlnKp/dT будет положительный, следовательно, с увеличением температуры константа равновесия эндотермической реакции возрастает. При этом равновесие может смещаться в сторону образования продуктов реакции.
Если принять, что тепловой эффект химической реакции не зависит от температуры,то уравнение Вант-Гоффа можно представить в интегральной форме (уравнения 2.5 и 2.6):
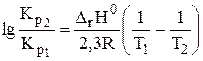 | (2.5) |
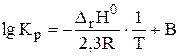 | (2.6) |
где В — постоянная интегрирования.
На основании уравнения (2.6) можно определить тепловой эффект реакции графическим методом, зная константы равновесия при 4 — 5 температурах (рис. 1).
| tg (p — a) 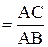 tg a = -tg (p — a) = — tg a = -tg (p — a) = — 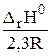 D rH0 = 2,3R tg (p — a) =- 2,3R tg a D rH0 = 2,3R tg (p — a) =- 2,3R tg a |
Рис. 1. Зависимость lg Kp от обратной температуры.
Для определения направления протекания химической реакции при заданных значениях температуры и давления используют уравнение изотермы химической реакции (2.7):
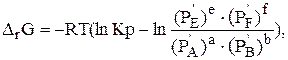 | (2.7) |
где DrG — изменение изобарно-изотермического потенциала системы при реакции, 
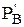
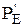
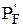
Если DrG реакции 0, то это не свидетельствует о том, что реакция не пойдет. Можно подобрать такое соотношение исходных парциальных давлений и концентраций, при которых DrG станет меньше нуля и реакция будет протекать самопроизвольно.
📹 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Внутренняя энергия и энтальпия. 10 класс.Скачать

Свободная энергия Гиббса и самопроизвольные реакции (видео 8) | Энергия| БиологияСкачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать