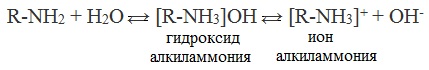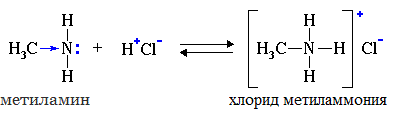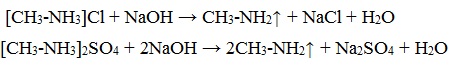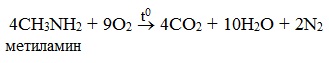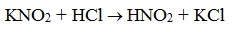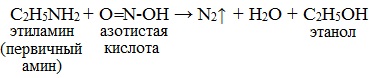Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
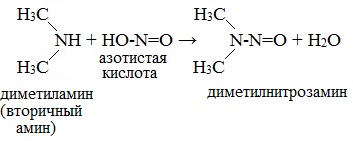
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Взаимодействие мрамора с соляной кислотойСкачать  Опыты по химии. АминыБромирование анилина Аминогруппа влияет на свойства бензольного кольца. Она делает его более реакционноактивным. К насыщенному водному раствору анилина прильем бромную воду. Раствор мутнеет. Выпадает белый осадок 2,4,6-триброманилина. С6Н5NH2 + 3 Br2 = C6H2Br3 + 3HBr Оборудование: пробирки, штатив для пробирок. Техника безопасности. Соблюдать правила работы с ядовитыми веществами и бромом. Постановка опыта и текст – к.п.н. Павел Беспалов. Взаимодействие анилина с соляной кислотой Анилин – слабое основание. С сильными кислотами анилин способен образовывать соли. Приготовим смесь анилина с водой. Прибавим к смеси соляную кислоту. Происходит растворение анилина. В растворе образуется солянокислый анилин или хлорид фениламмония С6Н5NH2 + HCI = [C6H5NH3] CI Оборудование: пробирки, штатив для пробирок. Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами. Постановка опыта и текст – к.п.н. Павел Беспалов. Изучение среды раствора анилина Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов. Возьмем пробу раствора анилина. Добавим в пробирку лакмус. Окраска индикатора не изменяется, это значит, что раствора анилина имеет нейтральную реакцию среды. Оборудование: пробирка, штатив для пробирок. Оборудование: пробирка, штатив для пробирок. Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами. Постановка опыта и текст – к.п.н. Павел Беспалов. Изучение физических свойств анилина Анилин – бесцветная маслянистая жидкость. При хранении анилин постепенно окисляется и приобретает вначале желтую, затем бурую окраску. Изучим растворимость анилина в воде. Прибавим анилин к воде и перемешаем раствор. Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется всего 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов. Оборудование: пробирки, штатив для пробирок. Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Постановка опыта и текст – к.п.н. Павел Беспалов. Качественное определение азота в органических соединениях Очень чувствительным методом определения азота в органических соединениях является сплавление вещества с металлическим натрием. Небольшую порцию анализируемого вещества сплавляем с кусочком металлического натрия. Важно, чтобы весь натрий прореагировал или окислился. Когда весь натрий прореагировал, охлаждаем пробирку, заливаем ее водой и кипятим. К полученному раствору добавляем крупинку сульфата железа (II) и вновь нагреваем. Затем добавляем соляную кислоту. Появление синего окрашивания свидетельствует о наличии азота в исследуемом органическом соединении. При сплавлении натрия с азотсодержащим веществом образуется цианид натрия. С солью двухвалентного железа цианид натрия образует гексацианоферрат (II) натрия. Так как сульфат железа (II) всегда содержит примесь железа (III), то с железом (III) гексацианоферрат натрия образует берлинскую лазурь. Появляется голубое окрашивание. Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, стакан, фильтровальная бумага, скальпель, пинцет. Техника безопасности. Соблюдать правила работы со щелочными металлами. Постановка опыта и текст – к.п.н. Павел Беспалов. Окисление анилина раствором дихромата калия Окисление анилина дихроматом калия позволяет получить важный промышленный краситель – черный анилин. К насыщенному раствору дихромата калия прибавим раствор серной кислоты и эмульсию анилина. Жидкость окрашивается в зеленый цвет, который постепенно переходит в черный. Образуется черный анилин — нерастворимый в воде краситель. Оборудование: пробирки, штатив для пробирок. Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами. Постановка опыта и текст – к.п.н. Павел Беспалов. Окисление анилина раствором хлорной извести Определить наличие анилина в растворе можно с помощью раствора хлорной извести. К сильно разбавленному раствору анилина добавим отфильтрованный раствор хлорной извести. Раствор становится синим. Реакция с хлорной известью – качественная реакция на анилин, она основана на легкой окисляемости анилина. Реакция очень чувствительна и позволяет определить даже следы анилина. Оборудование: пробирки, штатив для пробирок. Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Постановка опыта и текст – к.п.н. Павел Беспалов. Получение гидроксида диметиламмония и изучение его свойств Амины с водой образуют достаточно сильные основания. Приготовим раствор диметиламина в воде. Газ диметиламин хорошо растворяется в воде. При этом образуется гидроксид диметиламмония (гидрат диметиламина) (СН3)2NH + H2O = [(СН3)2NH2]ОН Пробу гидроксида диметиламмония (гидрата диметиламина) испытаем раствором фенолфталеина. Фенолфталеин приобретает малиновую окраску: среда раствора – щелочная. К следующей порции раствора прибавим раствор хлорида железа (III) – выпадает бурый осадок гидроксида железа. 3[(СН3)2NH2]ОН + FeCI3 = Fe(OH)3 ↓+ 3[(СН3)2NH2]CI Вносим палочку, смоченную концентрированной соляной кислотой, в выделяющийся газ диметиламин, образуется густой белый дым. Дым – кристаллы гидрохлорида диметиламина. (СН3)2NH + HCI = [(СН3)2NH2] CI Оборудование: пробирки, штатив для пробирок, горелка. Техника безопасности. Соблюдать правила работы со щелочами, кислотами. Правила работы нагревательными приборами. Постановка опыта и текст – к.п.н. Павел Беспалов. Получение диметиламина и его горение Получим диметиламин действием гидроксида натрия на хлорид диметиламина. Смешаем в пробирке хлорид диметиламина со щелочью и прибавим воды. При легком нагревании выделяется газ диметиламин. [(СН3)2NH2] CI + NaOH = (СН3)2NH + NaCI + H2O При поджигании диметиламин сгорает с образованием углекислого газа, водяных паров и азота. 4(СН3)2NH +15 O2 = 8CO2 + 14H2O + 2N2 Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, газоотводная трубка. Техника безопасности. Соблюдать правила работы со щелочами и нагревательными приборами. Постановка опыта и текст – к.п.н. Павел Беспалов. Видео:Взаимодействие металлов с соляной кислотойСкачать  Уравнение реакции диметиламина с соляной кислотойАмины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. I. Свойства аминов как оснований Химические свойства алифатических аминов определяются главным образом наличием у атома азота неподеленной пары электронов.За счет неподеленной пары электронов атома азота амины способны присоединять протон, проявляя при этом основные свойства. Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму. Амины – органические основания. Водные растворы алифатических аминов (алкиламинов) имеют щелочной характер, т.к. при взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония: Механизм реакции Общее уравнение реакции Амины изменяют окраску индикаторов. Видеоопыт «Получение гидроксида диметиламмония и изучение его свойств» 2. Взаимодействие с кислотами (реакция нейтрализации) Алкиламины как основания образуют соли с минеральными кислотами, которые являются аналогами солей аммония: С органическими кислотами возможны аналогичные реакции: Соли аминов – твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи, как более сильные основания, вытесняют амины из их солей: Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. II. Окисление аминов Алифатические амины окисляются под действием сильных окислителей. В отличие от аммиака, низшие газообразные амины способны воспламеняться от открытого пламени. Реакция горения (полное окисление) Продуктами горения аминов, как и других азотсодержащих органических соединений, являются углекислый газ, вода и свободный азот: Видеоопыт «Получение диметиламина и его горение» III. Взаимодействие с азотистой кислотой (отличие первичных аминов от вторичных и третичных) Качественная реакция на амины! Азотистая кислота HNO2 — неустойчивое соединение, поэтому ее получают непосредственно в процессе реакции действием сильной минеральной кислоты (НСl, H2SO4) на соль азотистой кислоты (нитрит): Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов. Важное практическое значение имеет реакция азотистой кислоты с первичными ароматическими аминами. При действии азотистой кислоты на первичные амины выделяется свободный азот и образуются спирты: Вторичные амины с азотистой кислотой дают N-нитрозамины – маслянистые жидкости с характерным запахом: Третичные алифатические амины с азотистой кислотой не реагируют. 🔍 ВидеоКИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать  Обнаружение иона железа трёхвалентного в раствореСкачать  Взаимодействие цинка с соляной кислотой I ЕГЭ по химииСкачать  Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать  Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать  Взаимодействие металлов с кислотами. 8 класс.Скачать  Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать  СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать  Расчеты по уравнениям химических реакций. Выход. Примеси. (№28)Скачать  Аммиак с соляной кислотойСкачать  Взаимодействие соды с соляной кислотойСкачать  ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать  Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать  ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  |

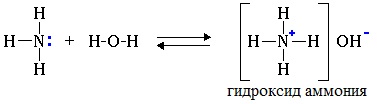
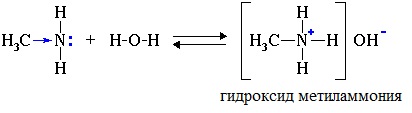
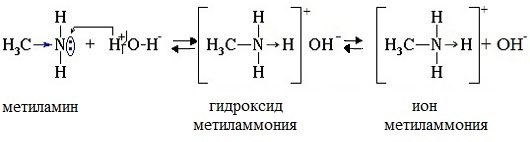
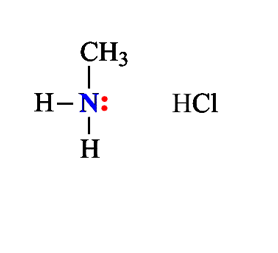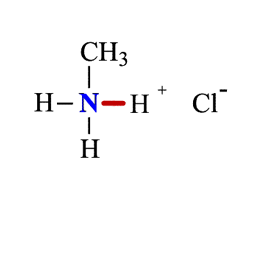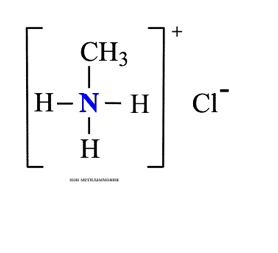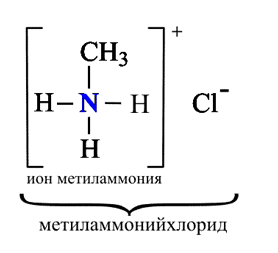 1. Взаимодействие с водой
1. Взаимодействие с водой