- Серная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Практическая работа № 6 Получение оксида углерода (IV) и получение его свойств. Распознавание карбонатов. химия 9 класс
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- H2SO4+C-SO2+CO2+H2O электронный баланс подпишите окислитель восстановитель
- 🔥 Видео
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
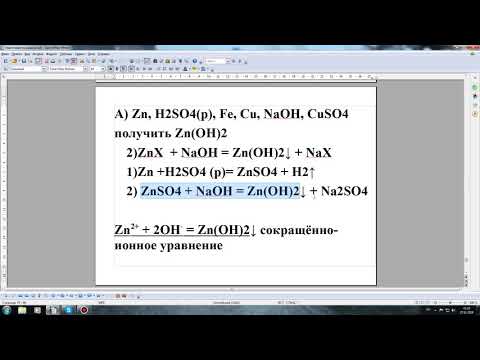
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
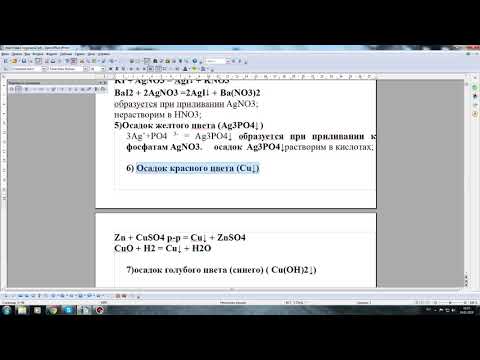
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Видео:CH3OH + KMnO4 + H2SO4 = K2SO4 + MnSO4 + H2O+ CO2#chemical reaction#kimyoviyreaksiya#chemistry#kimyoСкачать

Практическая работа № 6 Получение оксида углерода (IV) и получение его свойств. Распознавание карбонатов. химия 9 класс
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Химия 9 класс Практическая работа № 6
«Получение оксида углерода ( IV ) и изучение его свойств. Распознавание карбонатов»
Цель: научить получать углекислый газ реакцией обмена; продолжить ознакомление с химическими свойствами углекислого газа; познакомить с методами распознавания карбонатов.
Планируемые результаты: уметь получать и собирать углекислый газ в лаборатории, описывать наблюдаемые явления, доказывать наличие оксида углерода ( IV ), распознавать соли угольной кислоты в растворе.
Техника безопасности: осторожное обращение с химреактивами и стеклянной посудой.
Оборудование и реактивы: кусочки мрамора или мела, фенолфталеин, лакмус,
растворы: соляной кислоты , гидроксида натрия, нитрата серебра( I ), хлорида бария; вода, известковая вода, в пронумерованных пробирках кристаллические вещества( сульфат натрия, хлорид цинка, карбонат калия, силикат натрия), пробирки, газоотводная трубка с пробкой, стакан.
1.Получение оксида углерода ( IV ) и определение его свойств
1.Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты
При воздействии соляной кислоты на мрамор выделяется углекислый газ
2. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2-3 мл известковой воды
Образуется нерастворимое вещество карбонат кальция
3. Пропускаем углекислый газ еще некоторое время
Раствор становится прозрачным
При пропускании углекислого газа через известковую воду образуется карбонат кальция, который затем растворяется, превращаясь в гидрокарбонат
4. Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Затем поместите трубку в пробирку с 2-3 мл дистиллированной воды и пропустите через неё газ. Через несколько минут выньте трубку из раствора, внесите в полученный раствор универсальную индикаторную бумагу (синий лакмус)
В воде образуется слабая угольная кислота
5.В пробирку налейте 2-3 мл разбавленного раствора гидроксида натрия и добавьте к нему несколько капель фенолфталеина. Затем через раствор пропустите газ
Малиновая окраска исчезает, раствор становится прозрачным
Идет реакция между CO 2 и NaOH
Это еще раз подтверждает кислотные свойства
CO 2
В четырёх пронумерованных пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, какое вещество находится в каждой пробирке. Na 2 SO 4 , ZnCl 2 , K 2 CO 3, Na 2 SiO 3
В каждую из пробирок добавляем раствор соляной кислоты
В двух пробирках ничего не изменилось, в одной из пробирок выделился газ, в другой студенистый осадок
Выделение газа при действии кислоты — признак карбонатов
Студенистый осадок – образовалась нерастворимая кремниевая кислота
Два оставшихся вещества растворяем водой и добавляем раствор хлорида бария
1) Выпал белый осадок
Это качественная реакция на сульфат-ион, значит, в данной пробирке находится сульфат натрия
В оставшийся раствор добавляем раствор нитрата серебра (I)
2) Выпал белый осадок
Реакция является качественной на хлорид-ион, в данной пробирке — хлорид цинка
Вывод: качественной реакцией на карбонат-ион является действие сильной кислоты, которая вытесняет слабую кислоту из раствора ее соли, происходит выделение углекислого газа.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 956 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 51 человек из 29 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 569 440 материалов в базе
Материал подходит для УМК
«Химия», Рудзитис Г.Е., Фельдман Ф.Г.
§ 36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Другие материалы
- 14.02.2022
- 25
- 0
- 14.02.2022
- 30
- 0
- 14.02.2022
- 24
- 0
- 14.02.2022
- 33
- 0
- 14.02.2022
- 21
- 0
- 14.02.2022
- 48
- 0
- 14.02.2022
- 25
- 0
- 14.02.2022
- 22
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 14.02.2022 1245
- DOCX 209.5 кбайт
- 17 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Хубазова Анжелла Мовлдиевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год и 10 месяцев
- Подписчики: 3
- Всего просмотров: 19005
- Всего материалов: 47
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:КАК УРАВНЯТЬ Fe + H2SO4 (конц) = Fe2(SO4)3 + SO2 + H2O ЭЛЕКТРОННЫМ БАЛАНСОМ / Реакция с нагревомСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Ba(OH)2+H2SO4=BaSO4+H2O Ионное и молекулярное уравнения реакции, демонстрация.Скачать

H2SO4+C-SO2+CO2+H2O электронный баланс подпишите окислитель восстановитель
2H2SO4+C = 2SO2 + CO2 + 2H2O
S(+6) +2e ⇒ S(+4) — окислитель, процесс восстановления.
С(0) — 4e ⇒ C(+4) — восстановитель, процесс окисления.
Если ответ по предмету Химия отсутствует или он оказался неправильным, то попробуй воспользоваться поиском других ответов во всей базе сайта.
🔥 Видео
BaCl2+H2SO4=BaSO4+HCl Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Ba(NO3)2+H2SO4=BaSO4+HNO3 Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Химическая реакция FeSO4 с KMnO4 и H2SO4Скачать

Ni(OH)2+H2SO4=NiSO4+H2O Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Химическая реакция KMnO4 с H2SO4 и H2O2Скачать

КАК НАПИСАТЬ РЕАКЦИЮ KMnO4 + MnSO4 + H2O и УРАВНЯТЬ ЕЁ / Реакция перманганата и сульфата марганцаСкачать

Взаимодействие H2SO4 и HNO3 с неметаллами. ОВР серной и азотной кислот. ЕГЭ по Химии 2019Скачать

Cu + HNO3 р., Na2O2 + Na, S+H2SO4, баланс коэффициенты, уравнение, медь, пероксид натрия, сераСкачать

Цветные осадки и другие признаки протекания реакции.Скачать
Задание №20 (ОВР, электронный баланс). ОГЭ химия 2021.Скачать

Найдите сумму коэффициентов в правой части уравнения. H2S + H2SO4 + K2Cr2O7 = Cr2(SO4)3 + SСкачать

Получим гидроксиды в 2 стадии (закрепление материала)Скачать
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химическая реакция KI с H2SO4 и H2O2Скачать

ОВР. KMnO4+H2O2+H2SO4Скачать

Химическая реакция KMnO4 с H2SO4 и NaNO2Скачать
















