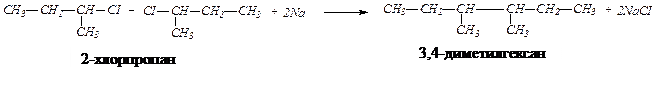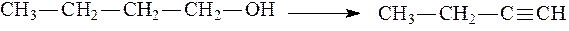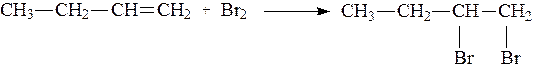Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
Видео:Видео №3. Как составить изомерыСкачать  Примеры решения задач. Пример 1.Составьте уравнение реакции бромирования 2-метилбутанаПример 1.Составьте уравнение реакции бромирования 2-метилбутана. Напишите и назовите по международной номенклатуре изомеры полученного соединения. Решение задачи. Вспомним правила названий органических веществ по международной номенклатуре (ИЮПАК). Номенклатура ИЮПАК строится следующим образом: выбирается наиболее длинная цепь атомов углерода и нумеруется, нумерация начинается с того конца, ближе к которому располагается радикал-заместитель. При наличии нескольких заместителей сумма цифр, обозначающих положение их в цепи, должна быть наименьшей. В названии вещества указывается цифрой место заместителя, называется сам заместитель, а затем главная цепь по числу атомов углерода с добавлением суффикса, соответствующего тому или иному классу органических соединений. Если радикалы повторяются, то перечисляются цифры, указывающие их положение, а число одинаковых радикалов указывается приставками ди-, три-, тетра- и т.д. По названию вещества определяем, какова главная цепь в указанном углеводороде. Напишем и пронумеруем цепочку углеродных атомов. Выявим заместители. Используя названия радикалов-заместителей, записываем их у соответствующих атомов углерода в главной цепи. Проверяем формулу углеводорода, следим за количеством атомов водорода у каждого углеродного атома, учитывая, что валентность атома углерода в органических соединениях равна четырем. Главная цепь – бутан, в нее входит четыре атома углерода. У второго атома углерода расположена метильная группа. Формула исходного соединения имеет вид:
При написании уравнений реакций предельных углеводородов, к которым относится исходный углеводород, следует знать, что для этих углеводородов характерными являются реакции замещения, причем в реакции замещения легче всего вступает водород у третичного атома углерода, затем у вторичного и труднее всего у первичного атома углерода. В данном случае, замещение идет у второго атома углерода, так как он третичный.
Составляем формулы изомеров для полученного галогенпроизводного углеводорода. Сначала записываем изомеры галогенпроизводных, у которых главная цепь атомов углерода содержит 5 углеродных атомов.
После этого записываем изомеры, содержащие в главной цепи 4 атома углерода.
Теперь записываем изомер, содержащий в главной цепи 3 атома углерода.
Пример 2.Какие продукты реакции образуется при нитровании 2,4-диметилпентана в условиях реакции Коновалова? Решение задачи. При нитровании 2,5-диметилгексана в условиях реакции Коновалова (t=140 0 C, 14–20% раствор HNO3, повышенное давление) преимущественно образуется продукт замещения атома водорода при третичных атомах углерода С2 или С4. Поскольку молекула имеет ось симметрии, то продукт будет один – 2-нитро-2,4-диметилпентан. Побочными процессами, сопровождающими реакции нитрования, являются расщепление углеродной цепи (преимущественно рядом с разветвлением) и образование нитропроизводных с меньшим числом атомов углерода. Чем длиннее цепь алкана и выше температура, тем интенсивнее протекает этот процесс. В данной задаче таких продуктов не будет: они образуются при парофазном нитровании алканов (t = 300 о C)
Пример 3.Получите 3,4-диметилгексан из галогенпроизводных алканов по реакции Вюрца, без образования побочных продуктов. Решение задачи. Для синтеза вещества по его формуле необходимо: а) записать структурную формулу получаемого соединения; б) обдумать направления синтеза; в) написать формулы исходных веществ; г) написать уравнения реакций.
По названию вещества записываем формулу получаемого предельного углеводорода: Получение алканов из галогенопроизводных по реакции Вюрца производится при взаимодействии двух галогенопроизводных с меньшим числом углеродных атомов, чем в синтезируемом соединении, в присутствии металлического натрия. Для выбора подходящих галогенпроизводных нужно разделить формулу алкана на два любых фрагмента, которые в месте разъединения должны соединяться с атомами галогена. В смеси двух галогенпроизводных с металлическим натрием реакция может проходить между двумя различными по строению галогенпроизводными и двумя парами одинаковых галогенпроизводных. В результате в первом случае образуются три алкана — один основной и два побочных. По условию задачи, для получения алкана без образования побочных продуктов, нужно разделить исходный углеводород на два одинаковых фрагмента, которые образуют одно галогенпроизводное. Такое возможно только для симметричных алканов. Искомый углеводород симметричен и мы его делим таким образом:
Уравнение реакции Вюрца имеет вид:
Пример 4.Используя необходимые органические и неорганические реагенты, синтезируйте бутин-1 из бутанола-1. Решение задачи. Запишем структурные формулы исходного соединения и конечного продукта:
На первой стадии проведем внутримулекулярную дегидратацию спирта:
Далее, получим вицинальное дигалогенпроизводное, действуя на полученный алкен раствором брома в четыреххлористом углероде:
Для получения бутина-1 проведем реакцию элиминирования (отщепления двух молекул галогеноводорода — НBr), действуя на 1,2-дибромбутан спиртовым раствором щелочи:
В этом синтезе на первый взгляд кажется более простым превращение бутена-1 в бутин-1 путем дегидрирования. Однако при осуществлении дегидрирования алкенов всегда образуются алкадиены с сопряженными связями – как термодинамически более стабильные, чем алкины. Пример 5.Напишите уравнение реакции взаимодействия пентадиена-1,3 с хлором при 40 0 С. Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать  Сколько монобромпроизводных может образоваться при бромировании углеводорода 2 — метилпентана?Химия | 10 — 11 классы Сколько монобромпроизводных может образоваться при бромировании углеводорода 2 — метилпентана? Ьвлчлчттвичлвбьвкак то так. Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  При взаимодействии 1, 74 г алкана с бромом образовалось 4, 11 г монобромпроизводного?При взаимодействии 1, 74 г алкана с бромом образовалось 4, 11 г монобромпроизводного. Определите молекулярную формулу алкана. Видео:25. Схема реакции и химическое уравнениеСкачать  Сколько раз идёт бромирование гексана, и почему?Сколько раз идёт бромирование гексана, и почему? Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Плотность алкана по азоту равна 2?Плотность алкана по азоту равна 2. В его состав входят 85, 7% углерода и 14, 3% водорода. Составьте структурную формулу алкана. Напишите уравнение реакции его бромирования с образованием монобромпроизводного. Видео:7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать  При бромировании 92 г метилциклогексана образовалось 108 г монобромпроизводного?При бромировании 92 г метилциклогексана образовалось 108 г монобромпроизводного. Определите выход реакции галогенирования и массовые доли веществ в полученной жидкой органической смеси. Видео:Составление формул органических соединений по названиюСкачать  Механизм бромирования на свету?Механизм бромирования на свету. Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать  Получить толуол и написать с ним реакции?Получить толуол и написать с ним реакции. Нитрования, бромирования при темпер. , бромирования в присутствии alcl3. Видео:Бромирование ТОЛУОЛА спиртовым раствором БРОМА. Опыты по органической химии Химические экспериментыСкачать  Какой реакцией можно доказать, что насыщенные углеводороды (алканы (al — kanes), парафины) не вступают в реакцию бромирования обычных условиях?Какой реакцией можно доказать, что насыщенные углеводороды (алканы (al — kanes), парафины) не вступают в реакцию бромирования обычных условиях? При каких условиях возможно бромирования? Приведите соответствующие уравнения реакций. Видео:Окислительно-восстановительное титрование: броматометрия, иодатометрия.Скачать  2 — хлор — 3 метилпентан?2 — хлор — 3 метилпентан. Видео:5.3. Циклоалканы: Химические свойства. ЕГЭ по химииСкачать  Сколько граммов брома потребуется для бромирования 16, 8 алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6, 72л водорода?Сколько граммов брома потребуется для бромирования 16, 8 алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6, 72л водорода? Каков состав и исходное строение углеводорода. Видео:Изомеры, гомологи, органическая химияСкачать  Монохлорпроизводное некоторого углеводорода содержит 46?Монохлорпроизводное некоторого углеводорода содержит 46. 4%хлора, а его монобромпроизводное — 66. Напишите структурные формулы всех возможных изомеров монобромпроизводного. На этой странице находится вопрос Сколько монобромпроизводных может образоваться при бромировании углеводорода 2 — метилпентана?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 10 — 11 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку. Mr(SO3) = 32 + 3 * 16 = 80 W(S) = 32 / 80 = 0. 4 = 40% Mr(SO2) = 32 + 2 * 16 = 64 W(S) = 32 / 64 = 0. 5 = 50% В 0, 8 раза. M(CuSO4) = 64 + 32 + 4 * 16 = 160 г / моль n(CuSO4) = 1. 6 / 160 = 0. 01 моль. Дано n(H2SO4) = 3 mol — — — — — — — — — — — — — — — — — — — — — — — — — — — — N(H2SO4) N = n * N(A) = 3 * 6. 02 * 10 ^ 23 = 1. 806 * 10 ^ 24 молекул ответ 1. 806 * 10 ^ 24 молекул. Все легко. Простые вещества состоят из 1 химического элемента, например : Mg, Ca. Сложные вещества состоят из 2 и более химических элементов, например : KOH или MgO. Вот, думаю понятно будет. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O M(H2SO4) = 98г / моль M(BaSO4) = 233г / ммоль m(H2SO4) = 100 * 5 / 100 = 5г n(H2SO4) = 5 / 98 = 0, 051моль nH2SO4 : nBaSO4 = 1 : 1 n(BaSO4) = 0, 051моль m(BaSO4) = 0, 051 * 233 = 11, 9г. 2H2 + O2 = 2h2o M(h2o) = 18 г / моль, v = 0, 5 моль( из уравнения) , m(h2o) = 18 * 0. 5 = 9 г. 💡 ВидеоХимические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  Химические свойства циклоалканов. Малые циклы: циклопропан и циклобутан.Скачать  Алканы. Химические свойства. Ч.1. Реакции радикального замещения.Скачать  Номенклатура Алкенов и Алкинов. Органическая химия. ЕГЭ.Скачать  Номенклатура алканов. Учимся давать названия алканам.Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать  Определение реакций опор в балке. Сопромат.Скачать  |

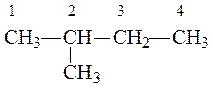
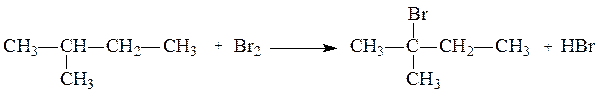

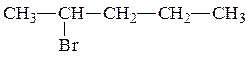
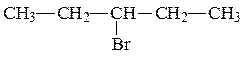
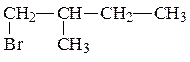
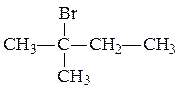
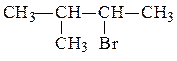
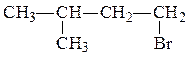
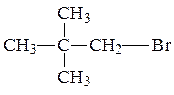
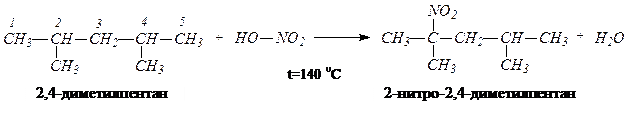
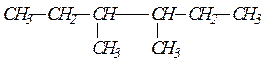
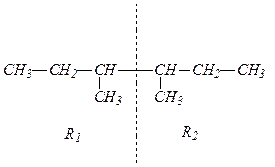
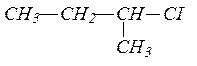 R1 и R2 одинаковы, поэтому нужный галогенуглеводород имеет структурную формулу
R1 и R2 одинаковы, поэтому нужный галогенуглеводород имеет структурную формулу