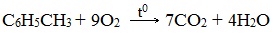Вы будете перенаправлены на Автор24
Бензол не вступает в реакции свободнорадикального замещения с хлором или бромом, которые являются типичными реакциями для алканов и циклоалканов. Энергия связи $C-H$ в бензоле составляет 110 ккал/моль, что значительно превышает энергию вторичной $CH$-связи в алканах (95 ккал/моль). Поэтому уже на первой стадии предполагаемого цепного радикального замещения наблюдается энергетическое препятствие и она оказывается эндотермической, что препятствует процессу замещения в целом:
Энергетически предпочтительнее оказывается радикальное присоединение хлора к бензолу с образованием гексахлорциклогексана.
- Замещение атома водорода атомом галогена в боковой цепи
- Готовые работы на аналогичную тему
- Бромирование толуола
- Бромирование в боковую цепь ароматических соединений $N$-бромсукцинимидом
- При бромировании толуола (при нагревании без катализатора на свету) образуется бромистый бензил C6H5—CH2Br и выделяется бромистый водород
- Ваш ответ
- решение вопроса
- Похожие вопросы
- Уравнение реакции бромирование толуола на свету
- Реакции замещения
- Реакции присоединения
- Реакции окисления
- 🎦 Видео
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Замещение атома водорода атомом галогена в боковой цепи
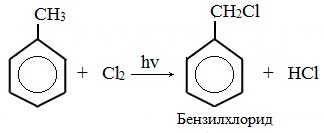
В боковой цепи атом галогена вводят при нагревании в присутствии радикальных инициаторов или под действием облучения по механизму радикального замещения. Например, хлорирование толуола выглядит так:
Механизм этой реакции состоит в преобразованиях:
Готовые работы на аналогичную тему
Протеканию такой реакции способствуют легкость образования и большая устойчивость бензильного радикала благодаря х-р-сопряжению неспаренного свободного электрона с $pi$-связями бензольного кольца. Поэтому при галогенирования аренов в с большими чем метательный боковыми цепями атака реагентом в первую очередь происходит в $alpha$-положении к бензольному кольцу с получением устойчивых радикалов бензильного типа:
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Бромирование толуола
Бромирование толуола проходит более селективно, чем хлорирование с образованием только дибромзамищенных соединений:
Как инициатор используют азодиизобутиронитрил.
Селективность галогенирования растет с уменьшением реакционной способности агента в ряде $F_2 > Cl_2 > Br_2 > J_2$.
Йодирование не применяется как препаративный метод, потому что молекулярный йод имеет низкую энергию, недостаточную для ведения радикального процесса. Йод — ингибитор реакции.
Непосредственное взаимодействие углеводородов с фтором дает углерод и фтороводород. Свободный фтор вызывает крекинг углеводородного цепи, потому что эта реакция сильно экзотермическая. Фторпроизводные углеводородов получают с помощью неорганических фторидов ($CoF_3$), тетрафторэтилена, фторотана ($CHClBr — F_3C$).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Бромирование в боковую цепь ароматических соединений $N$-бромсукцинимидом
$N$-Бромсукцинимид (БСИ, NBS) — $N$-бромид янтарной кислоты. Широко применяется в синтетической органической химии в качестве бромирующего реагента.
Галогенирование $N$-бромсукцинимидами в боковую цепь ароматических соединений является радикальной реакцией, аналогечной рассмотренным ранее. Ему способствуют УФ-облучение или радикальные инициаторы (бензоилпероксид, AIBN и т.д.). Самой распространенной реакцией является галогенирование метильной группы, прямо соединенной с ароматическим ядром. Этот процесс характеризуется высокой селективностью.
Например, толуол не реагирует с $N$-бромосукцинимидом без катализатора, но в присутствии перекиси бензоила образует бромистый бензил (64%). При наличии в бензольном ядре заместителя, способного оказывать негативный индуктивный эффект (о-хлоротолуен, п-нитротолуен), бромирование боковой цепи может происходить и без катализатора, однако присутствие катализатора увеличивает выход бромопроихводного и сокращает время реакции.
Аналогично в других алкилзамещенных ароматических соединениях замещения можно направить в ядро или в метильную группу в зависимости от применяемых условий. Замещения в боковой цепи происходит без катализаторов также для 1- и 2-метилнафталенов, ди- и трифенилметанов, флуорена и родственных соединений. При действии NBS на 2,6- и 2,3-диметилнафталины селективно бромируется одна из метильных групп.
Интересный случай составляет 1-етилнафталин, в котором наблюдается бромирование в боковую цепь, причем образуется винилнафталин (73%), в противовес около родственному аценафтену, для которого реакция происходит в ядро. В присутствии пероксида преобладает первая реакция и образуется аценафтилен.
Если субстрат содержит две метильные группы, связанные с ароматическим ядром, возможно образование бис-бромометильных производных:
Применяя облучение видимым светом к арену и соответствующему количеству NBS, можно селективно фотобромировать одну или две боковые метильные группы в диметиларенах. Так, фотобромирование 1,4, 1,8-, 2,3- и 2,6-диметилнафталенов, 4,4′-диметилбифенила с помощью 2.2 мл. экв. NBS дает соответствующие бис-бромометильные арены, тогда как с 1.1 мл. экв. NBS получают бромометиларены.
При изучении реакций бромирования ароматических соединений в боковую цепь с помощью NBS установлено, что селективность атаки брома зависит от примененного растворителя.
Реакции бромирования NBS различных алкил-арилов, проведенные с чистыми реагентами или в воде, в присутствии ультразвука или при микроволновом облучении демонстрируют различную хемоселективнисть. Так, при проведении реакции в водном растворе с применением ультразвука наблюдается замещение в ядро, тогда как с микроволнами происходит как $alpha$-монобрмирование в боковую цепь, так и замещение в ядро.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

При бромировании толуола (при нагревании без катализатора на свету) образуется бромистый бензил C6H5—CH2Br и выделяется бромистый водород
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Ваш ответ
Видео:Бромирование БензолаСкачать

решение вопроса
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Уравнение реакции бромирование толуола на свету
Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
Реакции замещения
1. Реакции с участием бензольного кольца
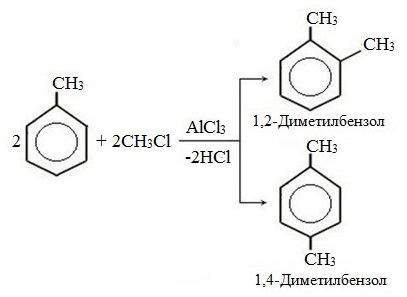
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
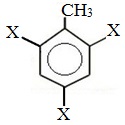
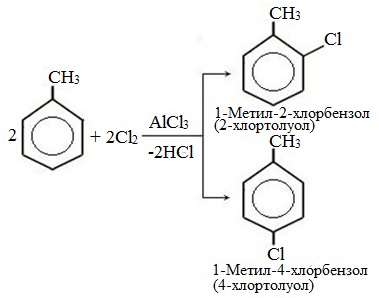
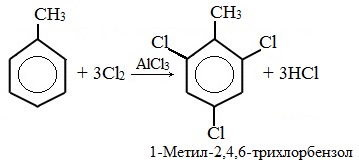
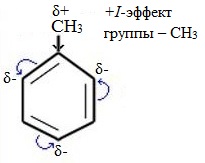
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
а) галогениерование
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
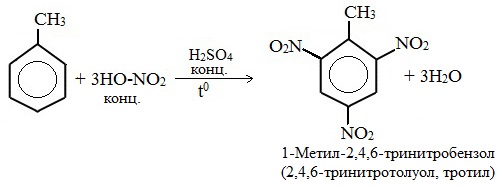
б) нитрование
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
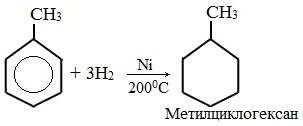
Реакции присоединения
а) гидрирование
Реакции окисления
а) горение
б) неполное окисление
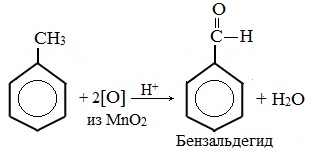
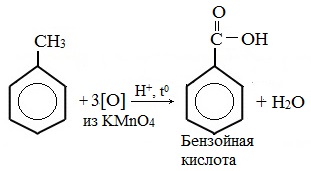
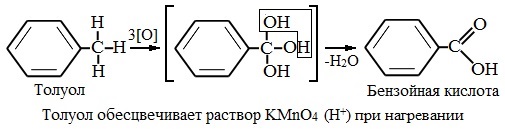
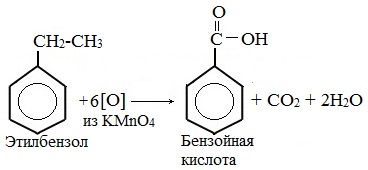
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
🎦 Видео
Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Арены: реакции замещения | Химия ЕГЭ для 10 класса | УмскулСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

25. Схема реакции и химическое уравнениеСкачать

Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

Химия 10 класс (Урок№4 - Арены (ароматические углеводороды).)Скачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Бензол и его гомологи | Химические свойства | ПолучениеСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать