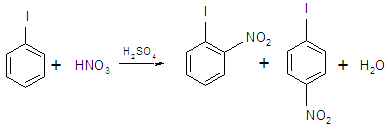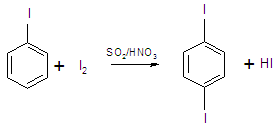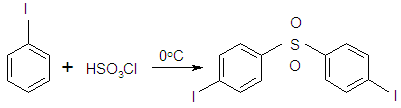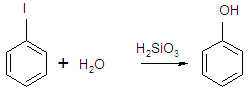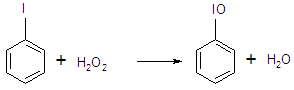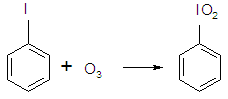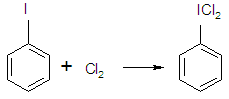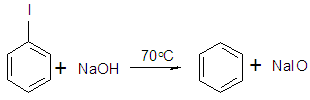Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- СИНТЕЗ И ИДЕНТИФИКАЦИЯ йодбензола.
- Введение
- Глава I. Обзор литературы
- Йодбензол. Физические свойства
- Йодбензол. Химические свойства
- Методики синтеза йодбензола
- Напишите уравнение реакции присоединения йода к бензолу?
- Что легче вступает в реакции присоединения и почему?
- Напишите, пожалуйста, уравнение реакций нитрования бензола и толуола?
- Напишите уравнение реакции и укажите течение этой реакции : бензол — гексохлорциклогексан?
- Реакция бензола с водородом это 1) необратимая реакция присоединения 2) обратимая реакция присоединения Подскажите пожалуйста?
- Для ароматических углеводородов ряда бензола : Выберите один ответ?
- Напишите уравнение реакции : получение бромбензола из бензола?
- Напишите уравнение реакции бромирования бензола в присутствии катализатора?
- Укажите, какие из перечисленных веществ вступают в реакцию присоединения с хлором, этан, пропен, бензол, ацетилен?
- Напишите уравнение реакции : горение бензола?
- Составьте уравнения реакций взаимодействия бензола с галогенами присоединения, замещения укажите условия проведений реакций?
Видео:Опыты по химии. Отношение бензола к йодной и бромной водеСкачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:реакция крахмала с йодомСкачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:Химическая реакция йода и алюминия.Скачать

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:Йод - САМЫЙ КРАСОЧНЫЙ ЭЛЕМЕНТ НА ЗЕМЛЕ!Скачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:ПОЛУЧЕНИЕ ОГНЯ ИЗ ЙОДА И АЛЮМИНИЯСкачать

СИНТЕЗ И ИДЕНТИФИКАЦИЯ йодбензола.
| Реклама от Google |
| Доступные действия |
|
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО РЫБОЛОВСТВУ
Федеральное государственное БЮДЖЕТНОЕ образовательное учреждение
высшего профессионального образования
«МУРМАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
ПО ДИСЦИПЛИНЕ «ОРГАНИЧЕСКАЯ ХИМИЯ»
СИНТЕЗ И ИДЕНТИФИКАЦИЯ
Выполнил: студент группы Х-2
Руководитель: к.т.н., доцент
Глава I. Обзор литературы.. 4
Йодбензол. Физические свойства. 4
Йодбензол. Химические свойства. 4
Методики синтеза йодбензола. 6
Идентификация йодбензола. 11
Глава II. Экспериментальная часть. 12
Синтез йодбензола. 12
Список литературы.. 17
Видео:Галилео. Эксперимент. Алюминий с йодомСкачать

Введение
Йодбензол – органическое вещество, имеющее формулу С6Н5I. Применяется в органическом синтезе. Обладает местным раздражающим действием.
Цель курсовой работы: синтезировать и идентифицировать йодбензол.
1. Изучить все возможные методы синтеза йодбензола.
2. Выбрать наиболее простой способ синтеза йодбензола.
3. Синтезировать йодбензол.
4. Идентифицировать вещество.
Объект изучения: йодбензол.
Предмет изучения: органическая химия.
Курсовая работа состоит из введения, двух глав, заключения и списка литературы.
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Глава I. Обзор литературы
Видео:Опыты по химии. Вытеснение йода и брома хлоромСкачать

Йодбензол. Физические свойства
Йодбензол — бесцветная жидкость со своеобразным эфирным запахом. Нерастворим в воде, хорошо растворим в спирте, эфире, хлороформе. Тпл = 31°С, Ткип = 188,5 °С, показатель преломления 1,8383. Молекулярная масса 204 г/моль, плотность 1,8307 г/см 3 .
Видео:Химические свойства бензола и его гомологов. 3 часть. 11 класс.Скачать

Йодбензол. Химические свойства
1. Электрофильное замещение в йодбензоле происходит с образованием пара- и орто-производных.
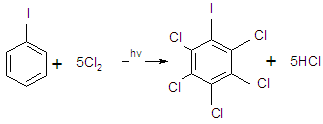
2. При действии на йодбензол жидкого Сl2 на солнечном свету образуются производные от n-хлориодбензола до пентахлориодбензола.
3. Нагревание с I2 в ледяной уксусной кислоте при одновременной обработке SO2 и дымящей HNO3 или NaNO2 и дымящей H2SO4 при 200 °С приводит к n-дииодбензолу.
4. При взаимодействии с хлорсульфоновой кислотой при 0 °С — n,n»-дииод дифенилсульфон
5. Йодбензол — арилирующий агент;
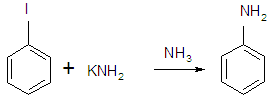
а) реагирует с KNH2 в жидком NH3 с образованием анилина
б) с водяным паром в присутствии активированной H2SiO3 (380 °С) образует фенол
в) с KCN — бензонитрил
6. Легко окисляется
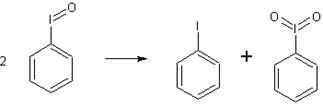
а) Н2О2 или надсерной кислотой до иодозобензола
б) озоном до иодилбензола
в) При действии хлора в безводной среде образуется С6Н5IСl2.
7. Восстанавливается электролитически в спиртовом р-ре NaOH при 70°С в бензол.
Видео:Получение бензола и его гомологов. 2 часть. 11 класс.Скачать

Методики синтеза йодбензола
1. Йодбензол с хорошим выходом получают обработкой кислого раствора соли фенилдиазония йодистым калием:
2. Для получения йодбензола прямым путем надо нагревать в запаянной трубке смесь бензола, йода и йодноватой кислоты: йодноватая кислота окисляет йодистый водород до свободного йода.
3. 22 г перхлората серебра и 10 г карбоната кальция смешивают со 100 мл бензола и к суспензии при охлаждении и перемешивании в течение 15 мин добавляют 25 г иода. Смесь фильтруют, трижды промывают водой, высушивают хлористым кальцием и перегоняют.
Выход иодбензола составляет 16 г (80%), т.кип. 184 С.
4. К раствору 5 г анилина в смеси 25 конц. НСl с 75 см3 Н2О постепенно приливают раствор 4 г NaNO2 в 20 см3 Н2О, пока не посинеет иодокрахмальная бумажка. Проба производится спустя пять минут после приливания NaNO2. К смеси приливают раствор 12,5 г KJ в 25 см3 Н2О, 2—3 часа держат в холодной воде и затем нагревают на водяной бане до прекращения выделения азота. После этого прибавляют избыток NaOH и отгоняют C6H5J с водяным паром (трубка, приводящая пар, должна касаться дна колбы). Нижний слой дестиллата отделяют, сушат на СаСl2 и перегоняют с термометром. Т. кип. 189—190°. Выход — 10 г.
В 1-литровую трехгорлую колбу, снабженную механической мешалкой, обратным холодильником и делительной воронкой, помещают 381 г (1,5 мол.) иода и 400 г (455 мл; 5,1 мол.) бензола. Смесь нагревают примерно до 50° на водяной бане, после чего к ней медленно при перемешивании прибавляют через делительную воронку 275 мл (6,15 мол.) азотной кислоты уд. веса 1,50 в течение приблизительно 1 часа 15 минут. При этом происходит обильное выделение окислов азота; их отводят в открытое окно или в вытяжной шкаф при помощи трубки, соединенной с верхним концом холодильника, или же поглощают с помощью специальной ловушки. Реакция идет ровно, и температура медленно повышается без наружного нагревания до тех пор, пока смесь не закипит спокойно. По прибавлении всего количества азотной кислоты смесь кипятят с обратным холодильником в продолжение 15 мин. Если реакционная масса все еще содержит иод, то к теплой смеси следует медленно прибавить еще некоторое количество азотной кислоты до исчезновения пурпурной окраски, обусловленной иодом; жидкость принимает при этом коричневато-красную окраску.
Нижний красноватый маслянистый слой отделяют и смешивают с равным объемом 10%-ного раствора едкого натра; полученную смесь подвергают перегонке с водяным паром из 2-литровой колбы до тех пор, пока не перестанет переходить масло. К концу перегонки в приемнике появляется желтое твердое вещество; оно представляет собою смесь нитросоединений; эту смесь удаляют, энергично взбалтывая дестиллат около 3 час. с 20 мл концентрированной соляной кислоты, 300 мл воды и 200 г железных опилок в 2-литровой колбе, соединенной с обратным холодильником.
Смеси дают охладиться, после чего ее фильтруют. Фильтрат подкисляют соляной кислотой до отчетливо кислой реакции на конго и снова подвергают перегонке с водяным паром. Полученное масло отделяют и перегоняют при атмосферном давлении с дефлегматором. Фракцию, кипящую при 180—190°, перегоняют вторично, собирая чистый йодбензол при 184—186°. Выход: 523— 531 г
5. В 5-литровой колбе приготовляют жидкую пасту из 110 г (0,5 моля) иодозобензола и воды; эту смесь быстро перегоняют с водяным паром до тех пор, пока не отгонится почти весь йодбензол
При этом отгоняется чистый йодбензол, около 46 г, выход 90%. Перегонку не рекомендуется продолжать дольше, чем это необходимо; содержимое колбы следует сразу же охладить. Белое твердое вещество выпадающее в колбе — йодоксибензол.
6. Известны йодирование бензола в среде ССl4 системой I2-C6H5I-(OCOCF3)2 при 20°С (выход йодбензола 72%), йодом в присутствии SbCl5 или тетрафторбората нитрония, а также через таллийорганические соединения (выход 96%):
PhH + Tl(OCOCF3) → PhTl(OCOCF3)2
PhTl(OCOCF3)2 + KI → PhI
7. В стакан, снабженный термометром и капельной воронкой, помещают 9,9 мл анилина и предварительно приготовленный раствор 11 мл концентрированной серной кислоты в 65 мл воды. Смесь охлаждают до 0 °С в кристаллизаторе со льдом и из капельной воронки, конец которой погружен на 1—2 см в жидкость, постепенно добавляют предварительно приготовленный раствор 7,7 г натрия нитрита в 45 мл воды. Диазотирование проводят при температуре не выше +5 °С. После введения раствора натрия нитрита капельную воронку заменяют механической мешалкой и реакционную смесь перемешивают в течение 1 ч. Избыток азотистой кислоты удаляют добавлением
2 г мочевины (до прекращения выделения газа).
К раствору соли диазония осторожно приливают предварительно приготовленный раствор 29 г калия йодида в 35 мл воды и смесь выдерживают в течение 1 ч (избыток калия йодида препятствует образованию побочного продукта — фенола). Затем содержимое стакана переносят в круглодонную колбу с обратным шариковым холодильником и нагревают на водяной бане до прекращения выделения азота. Для связывания фенола в виде натрия фенолята (натрия фенолят в отличие от фенола не перегоняется с водяным паром) смесь подщелачивают 10 %-ным раствором натрия гидроксида до сильнощелочной среды по универсальной индикаторной бумаге. Йодбензол отгоняют из этой же колбы с водяным паром до тех пор, пока из холодильника не перестанут стекать маслянистые капли. Дистиллят переносят в делительную воронку и отделяют нижний слой йодбензола от воды в коническую колбу.
Выделение продукта. Сырой йодбензол имеет светло-желтую окраску. Если полученный раствор бурого цвета (наличие свободного йода), то его встряхивают в делительной воронке с небольшим количеством раствора натрия сульфита до осветления и вновь отделяют нижний слой, сушат кальция хлоридом безводным, фильтруют в колбу Вюрца через складчатый фильтр и перегоняют, собирая фракцию с Т = 189—190 °С.
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Напишите уравнение реакции присоединения йода к бензолу?
Химия | 5 — 9 классы
Напишите уравнение реакции присоединения йода к бензолу.
C6H6 + i2 = C6H5i + Hi ( катализатор ali3).
Видео:Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

Что легче вступает в реакции присоединения и почему?
Что легче вступает в реакции присоединения и почему?
Этилен или бензол.
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Напишите, пожалуйста, уравнение реакций нитрования бензола и толуола?
Напишите, пожалуйста, уравнение реакций нитрования бензола и толуола.
Видео:Получаем йод из спиртовой настойки (химия)Скачать

Напишите уравнение реакции и укажите течение этой реакции : бензол — гексохлорциклогексан?
Напишите уравнение реакции и укажите течение этой реакции : бензол — гексохлорциклогексан.
Видео:Получение БЕНЗОЛАСкачать

Реакция бензола с водородом это 1) необратимая реакция присоединения 2) обратимая реакция присоединения Подскажите пожалуйста?
Реакция бензола с водородом это 1) необратимая реакция присоединения 2) обратимая реакция присоединения Подскажите пожалуйста.
Видео:Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать

Для ароматических углеводородов ряда бензола : Выберите один ответ?
Для ароматических углеводородов ряда бензола : Выберите один ответ.
A. не характерны ни реакции присоединения, ни реакции замещенияb.
Характерны реакции присоединения и не характерны реакции замещенияc.
Характерны и реакции присоединения, и реакции замещенияd.
Характерны и реакциизамещения и не характерны реакции присоединения.
Видео:А ты знаешь сколько существует изомеров бензола?😏😱#химия #олимпиаднаяхимия. [ChemToday]Скачать
![А ты знаешь сколько существует изомеров бензола?😏😱#химия #олимпиаднаяхимия. [ChemToday]](https://i.ytimg.com/vi/0mdl03FTjE8/0.jpg)
Напишите уравнение реакции : получение бромбензола из бензола?
Напишите уравнение реакции : получение бромбензола из бензола.
Видео:Опыты по химии. Растворение йода в воде и спиртеСкачать

Напишите уравнение реакции бромирования бензола в присутствии катализатора?
Напишите уравнение реакции бромирования бензола в присутствии катализатора.
Укажите, какие из перечисленных веществ вступают в реакцию присоединения с хлором, этан, пропен, бензол, ацетилен?
Укажите, какие из перечисленных веществ вступают в реакцию присоединения с хлором, этан, пропен, бензол, ацетилен.
Напишите уравнения возможных реакций и назовите продукты.
Напишите уравнение реакции : горение бензола?
Напишите уравнение реакции : горение бензола.
Составьте уравнения реакций взаимодействия бензола с галогенами присоединения, замещения укажите условия проведений реакций?
Составьте уравнения реакций взаимодействия бензола с галогенами присоединения, замещения укажите условия проведений реакций.
На этой странице вы найдете ответ на вопрос Напишите уравнение реакции присоединения йода к бензолу?. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
Всьо очень просто 112 делиш на 22, 4 = 5 моль Ответ 5 моль) Надеюсь что помог).
K2O CaO Li2O MgO Ag2O MnO2 MnO Mn2O7.
Пасан ну ты в каком классе.
2al + 6hcl = 2alcl3 + 3h2 13 коеффициентов.
Бредовый рассказ Кот Васька и старик часто рыбачили. Старик удил рыбу, а Васька сидел рядом. Однажды поймал старик рыбу. Не простую, а золотую. Васька хотел съесть ее, но вдруг она заговорила. Попросила она отпустить ее и тогда исполнит любое же..
22 * 2 = 44 44 — 32 = 12 значит, это СО2, или, проще сказать, углерод.
Потому что элементы соединяясь друг с другом образуют соединения.
P2O5 + 6NaOH→2Na3PO4 + 3H2O H2SO4 + 2NaOH→2H2O + Na2SO4 H2SO4 + Zn→ZnSO4 + H2 H2SO4 + MgCO3→MgSO4 + CO2 + H2O H2SO4 + 2AgNO3→2HNO3 + Ag2SO4 2NaOH + Zn0→Na2ZnO2 + H2 2NaOH + MgCO3→Mg(OH)2 + Na2CO3 2NaOH + 2AgNO3→Ag2O + 2NaNO3 + H2O Zn + 2AgNO3→2Ag + Z..
СвойстваЭтилен(другое название —этен) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частичнорастворим в воде(25, 6 мл в 100 мл воды при 0°C), этаноле ..
Жозеф Луи Пруст открыл закон постоянства веществ.