Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Сульфирование бензола: строение, свойства и структурная формула
- Принцип сульфирования
- Сульфирующие агенты
- Процесс сульфирования: описание
- Свойства продукта
- Введение нескольких сульфогрупп
- Влияние температуры
- Сульфирование «в парах»
- Другие способы
- Выделение сульфокислот
- Acetyl
- 🎬 Видео
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
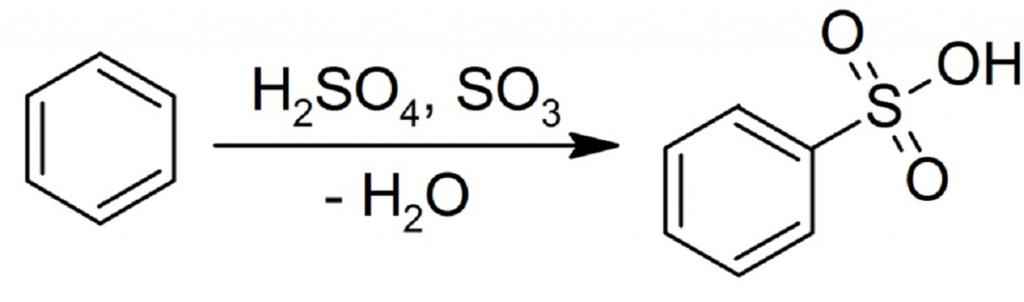
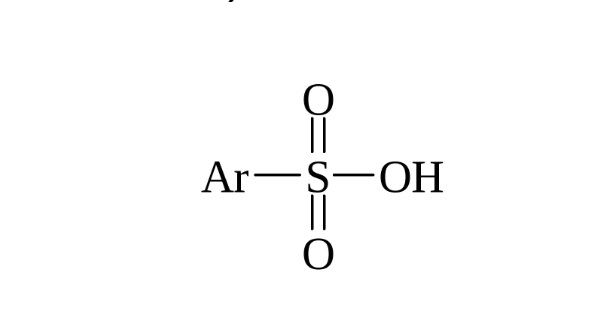
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:Серная кислота и ее соли. 9 класс.Скачать

Сульфирование бензола: строение, свойства и структурная формула
Сульфирование бензола, а также других ароматических углеводородов – одна из важнейших реакций в органической химии, так как ее продукты находят широкое промышленное применение. Для получения сульфокислот бензол обрабатывают серной кислотой или олеумом. Сульфирование может также проводиться ступенчато для создания нескольких функциональных групп.
Видео:Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать

Принцип сульфирования
Сульфирование бензола представляет собой введение сульфогруппы SO3H – замещение ею атома водорода в органическом соединении. В результате полученные вещества приобретают кислотные свойства и становятся растворимыми в воде. В дальнейшем, путем отщепления сульфогруппы, можно синтезировать другие соединения – аминобензол (анилин), галогенобензол, нитробензол, гидроксибензол (фенол).
Этому процессу подвергают не только сами углеводороды, но и их производные. Гомологичные соединения бензола (толуол и ксилол) сульфируются легче, а наиболее активно данная реакция проходит с анилином и фенолом.
Реакция сульфирования бензола, наряду с нитрированием, является одной из наиболее характерных для ароматических углеводородов. Замещение водорода у таких веществ протекает гораздо легче, чем у алифатических органических соединений.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Сульфирующие агенты
В качестве сульфирующих агентов могут применяться следующие вещества:
- серная кислота H2SO4 в различной концентрации;
- олеум (дымящая серная кислота);
- хлорсульфоновая кислота – HSO₃Cl;
- серный ангидрид;
- купоросное масло (H2SO4 в концентрации 93% и более);
- моногидрат серной кислоты;
- сульфурилхлорид SO₂Cl₂;
- щелочные соли сернистой кислоты;
- полисульфаты;
- кислые соли серной кислоты.
Наиболее часто в механизме сульфирования бензола применяется олеум – раствор SO3 в стопроцентной серной кислоте. Сорта олеума подбираются такие, у которых концентрация триоксида серы составляет около 65%, так как данные составы остаются жидкими при обычных условиях. При использовании этого вещества механизм реакции сульфирования бензола происходит с высокой скоростью.
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Процесс сульфирования: описание
Реакция бензола с олеумом происходит так:
Структурно порядок реакции сульфирования бензола выглядит следующим образом:
Целевым продуктом являются сульфокислоты. При обработке 92-94% серной кислотой их выход составляет 90-96%.
Сульфирование при 3-кратном избытке концентрированной серной кислоты протекает по следующей схеме:
Так как процесс идет медленно (хотя при этом выделяется тепло), то требуется нагревание.
К недостаткам сульфирования бензола серной кислотой относят:
- небольшая концентрация электрофилов;
- быстрое падение скорости реакции при разбавлении кислоты водой;
- агрессивность реакционной среды;
- необходимость применения нейтрализующих реагентов, большое количество отходов (экологический аспект).
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Свойства продукта
Химические свойства бензола при сульфировании характеризуются следующими особенностями:
- бесцветное или светло-желтое легкоплавкое кристаллическое вещество с резким запахом;
- хорошая растворимость в воде, практически полная диссоциация;
- высокая поглощающая способность в отношении паров воды, на воздухе кристаллы расплываются;
- ярко выраженный кислотный характер;
- соединение разлагается водой с выделением токсичных газов;
- пары тяжелее воздуха;
- константа кислотности – в пределах 5,0-8,0.
Одно из наиболее важных свойств сульфокислот – их способность обменивать сульфогруппу на другие функциональные группы, непосредственное введение которых в структуру ароматических углеводородов является затруднительным.
Видео:Взаимодействие сахара с концентрированной серной кислотойСкачать

Введение нескольких сульфогрупп
Замещение двух или трех атомов водорода проводится ступенчато, путем поэтапного изменения следующих параметров:
- сульфирующий агент;
- концентрация или количество этого вещества;
- температура.
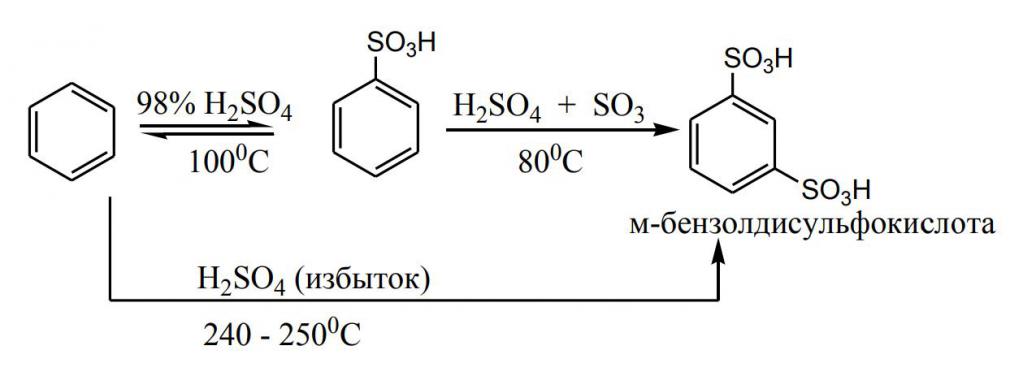
Получение мета-бензолдисульфокислоты производится в 2 стадии:
- Сульфирование C6H6 концентрированной кислотой H2SO4, в результате чего образуется моносульфокислота.
- Обработка продукта предыдущей реакции избытком 20% олеума при температуре 100 о С (или 60% при 60-80 о С). Так как первичное введение сульфогруппы значительно замедляет последующее сульфирование (примерно в 10 000 раз), то вторая реакция проводится в более жестких условиях.
Дальнейшее сульфирование до 3- и 5-бензолсульфокислоты возможно только при воздействии олеумом в 60% концентрации при температуре 250 о С в присутствии катализатора – сульфата ртути.
В обычных условиях реакция сульфирования является обратимой, но если используется олеум с высоким содержанием ангидрида, то процесс становится необратимым. То же наблюдается при обработке бензола хлорсульфоновой кислотой.
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Влияние температуры
Повышение температуры при сульфировании бензола не только увеличивает скорость течения реакции, но и приводит к образованию побочных продуктов: полисульфокислот, сульфонов, окислов. При нагреве выше 160 °С отмечается появление дисульфокислот.
Поэтому каждая реакция должна проводиться при определенной температуре. От нее также зависит место присоединения группы SO3H (региоселективность) в ароматических углеводородах.
Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Сульфирование «в парах»
В производственных условиях одним из самых экономичных методов получения бензолсульфокислоты является проведение реакции в «парах». Эта технология позволяет сократить потребность H2SO4 почти в 2 раза, по сравнению с процессом, при котором используется жидкая фаза этого вещества. К недостаткам реакции относится снижение скорости сульфирования.
Устранение недостатков, связанных с применением H2SO4 в жидком состоянии, возможно путем удаления воды из реакционной массы или применением олеума (повышением концентрации SO3).
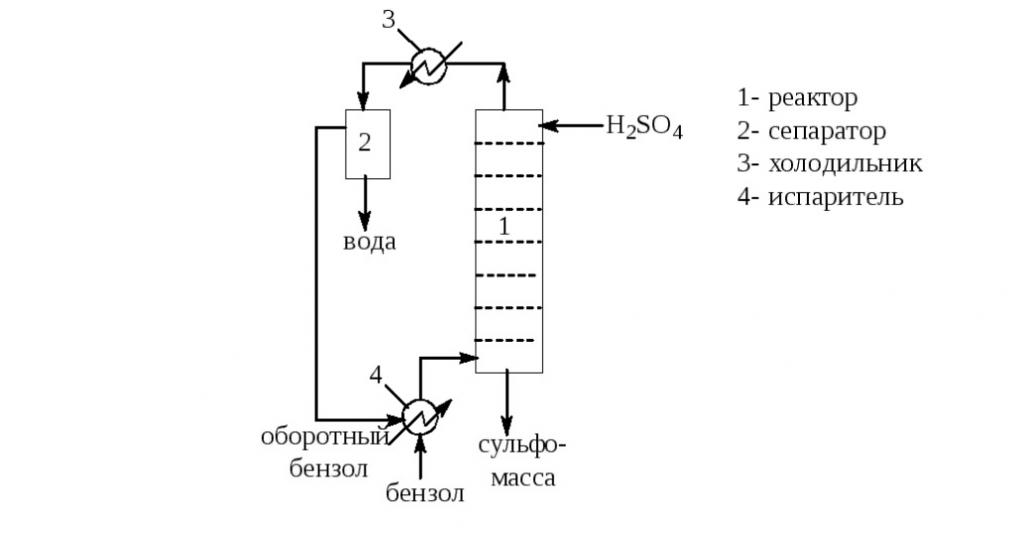
Технология сульфирования бензола в этом случае протекает следующим образом:
- Бензол из емкости подают в трубную обвязку испарителя при помощи насоса. В этом устройстве вещество нагревается паром, проходящим по внешним трубам. Затем пары доводят до t=150 °С.
- Бензол в парообразном состоянии в избытке подают в реактор, где он проходит через слой концентрированной серной кислоты при температуре 150 °С.
- В холодильнике C6H6 и H2O конденсируются и охлаждаются до температуры 30 °С.
- В сепараторе происходит расслоение смеси, а оборотный бензол возвращают на сульфирование.
Остатки бензола в сульфомассе удаляют при помощи отдувки воздухом. Затем смесь поступает на нейтрализацию в аппарат, облицованный внутри кислотоупорной плиткой. Эта реакция проводится при участии водного раствора Na₂SO₃. После обработки массу направляют в колонну для устранения диоксида серы. Полученный продукт используют для получения фенола с помощью щелочного плавления (в настоящее время этот процесс утратил промышленное значение, фенол синтезируют из изопропилбензола) или упаривают до сухого остатка бензолсульфоната натрия.
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Другие способы
Применяют и другие методики сульфирования бензола:
- Жидкий углеводород пропускают противотоком сквозь слой H2SO4. Полученный продукт растворяют сначала в бензоле, а потом вымывают водой.
- Сульфирование олеумом слабой концентрации при повышенной температуре 190-250 °С и давлении 1-3 МПа. Появление побочных продуктов подавляется путем введения бензолсульфоната натрия.
Видео:59. Химические свойства бензолаСкачать

Выделение сульфокислот
Так как продукты реакции хорошо растворимы, их выделение производят в виде солей. Для этого в сульфомассу, при постоянном помешивании, вводят нейтрализующие агенты, в качестве которых применяют следующие вещества:
Выделение свободных сульфокислот производят при реакции с ионнообменными смолами или подкислением хлороводородом.
Видео:Взаимодействие серной кислоты с металламиСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎬 ВидеоИзучаем химические свойства концентрированной серной кислоты!Скачать  Нитрование разных производных бензола. Химический опытСкачать  Нитрование бензолаСкачать  |