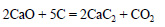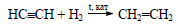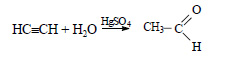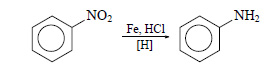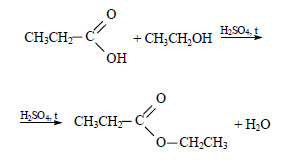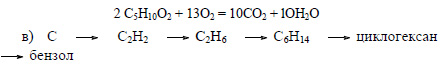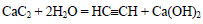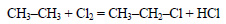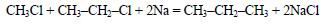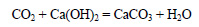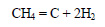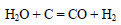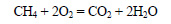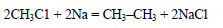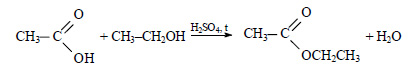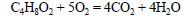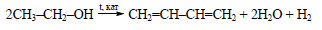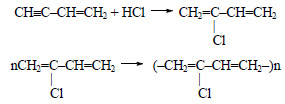Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Составьте уравнения реакций по следующей схеме, отражающей генетическую связь между органическими и неорганическими веществами:
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Химические свойства бензола
- Химические свойства бензола
- Химические свойства гомологов бензола — алкилбензолов
- 🌟 Видео
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
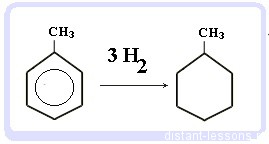
1.1. Гидрирование
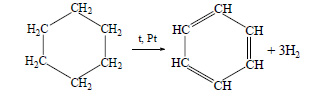
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
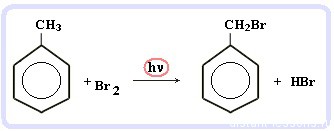
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
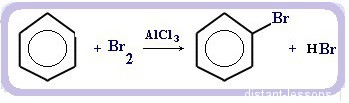
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
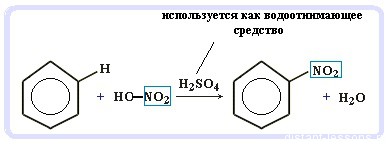
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
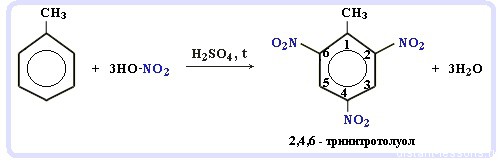
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
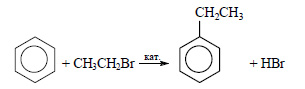
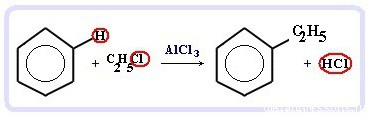
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
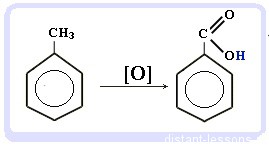
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:Арены: реакции замещения | Химия ЕГЭ для 10 класса | УмскулСкачать

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:Ароматические углеводороды. Бензол | Органическая химия ЕГЭ, ЦТСкачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

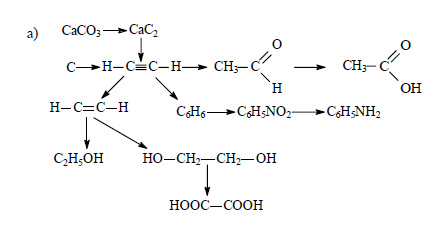
Составьте уравнения реакций по следующей схеме, отражающей генетическую связь между органическими и неорганическими веществами:
Ответ:
При сильном нагревании карбонат кальция разлагается на оксид кальция и оксид углерода (IV):
Оксид кальция при высокой температуре реагирует с углем с образованием карбида кальция:
При действии на карбид кальция воды получается ацетилен:
Этиловый спирт из ацетилена можно получить в две стадии. При гидрировании ацетилена в присутствии катализатора образуется этилен:
При присоединении к этилену воды в присутствии кислот образуется этиловый спирт.
При окислении этилена раствором перманганата калия образуется этиленгликоль:
При окислении этиленгликоля образуется щавелевая кислота:
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
При окислении уксусного альдегида образуется уксусная кислота:
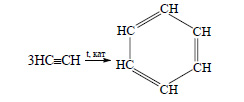
Из трех молекул ацетилена может образоваться молекула бензола (реакция тримеризации):
При действии на бензол смеси концентрированной азотной кислоты и концентрированной серной кислоты происходит замещение атома водорода на нитрогруппу и образуется нитробензол:
Нитробензол можно восстановить в аминобензол (анилин):
Из этана в две стадии можно получить этанол. При хлорировании этана образуется хлорэтан:
При действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.
При реакции этанола с пропионовой кислотой образуется этилпропионат (этиловый эфир пропионовой кислоты):
При сгорании этилпропионата образуется оксид углерода (IV). Молекулярная формула этилпропионата C5H10O2.
Оксид кальция при высокой температуре реагирует с углем с образованием карбида кальция:
При действии на карбид кальция воды получается ацетилен:
При хлорировании этана образуется хлорэтан:
При реакции хлорэтана с хлорметаном в присутствии натрия образуется пропан:
Из пропана в две стадии можно получить гексан. При хлорировании пропана образуется смесь изомеров – 1-хлорпропана и 2-хлорпропана. Изомеры имеют разные температуры кипения и их можно разделить перегонкой.
При взаимодействии 1-хлорпропана с натрием образуется гексан:
При взаимодействии 1-хлорпропана с натрием образуется гексан:
Бензол можно получить также при дегидрировании циклогексана:
г) Составьте уравнения реакций согласно второму форзацу учебника «Химия-11»:
При горении угля образуется оксид углерода (IV):
При реакции оксида углерода с гидроксидом кальция образуется оксид углерода (IV):
При сильном нагревании карбонат кальция разлагается на оксид кальция и оксид углерода (IV):
Оксид кальция образуется также при реакции кальция с кислородом:
При реакции кальция с водой образуется гидроксид кальция:
При реакции кальция с соляной кислотой образуется хлорид кальция:
Из хлорида кальция можно получить кальций электролизом расплава:
При реакции кальция или оксида кальция с углеродом при высокой температуре образуется карбид кальция:
При реакции карбида кальция с водой образуется ацетилен:
Ацетилен можно получить также из метана:
При разложении метана образуется также углерод:
Синтез-газ можно получить, пропуская водяной пар через раскаленный уголь:
Синтез-газ получают также из смеси метана и кислорода при нагревании в присутствии катализатора. При этом протекают следующие реакции: часть метана сгорает с образованием оксида углерода (IV) и воды.
Затем образовавшиеся вода и оксид углерода (IV) взаимодействую с оставшимся метаном:
Из синтез-газа можно получить уксусный альдегид при помощи следующей последовательности реакций:
При пропускании синтез-газа над катализатором образуется метанол:
При действии на метанол хлороводорода в присутствии серной кислоты образуется хлорметан (метилхлорид):
При взаимодействии хлорметана с натрием образуется этан (реакция Вюрца):
Из этана в две стадии можно получить этанол. При хлорировании этана образуется хлорэтан:
При действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.
Этанол окисляется оксидом меди при нагревании в уксусный альдегид:
При гидрировании ацетилена в присутствии катализатора образуется этилен:
Наоборот, при дегидрировании ацетилена образуется этилен:
При присоединении к этилену воды в присутствии кислот образуется этиловый спирт.
При сильном нагревании этилового спирта с серной кислотой происходит дегидратация и образуется этилен:
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
При окислении уксусного альдегида образуется уксусная кислота:
При восстановлении уксусного альдегида образуется этиловый спирт:
При реакции уксусной кислоты с этиловым спиртом образуется этилацетат:
При горении этилацетата образуется оксид углерода (IV):
Из этилового спирта в присутствии катализаторов образуется 1,3-бутадиен:
При полимеризации бутадиена получается синтетический каучук.
Ацетилен димеризуется с образованием винилацетилена.
При присоединении к винилацетилену хлороводорода образуется 2-хлорбутадиен-1,3 (хлоропрен), при полимеризации которого образуется хлоропреновый каучук.
При тримеризации ацетилена образуется бензол:
При реакции бензола с бромэтаном в присутствии катализатора образуется этилбензол (алкилирование бензола):
При дегидрировании этилбензола образуется винилбензол (стирол):
При полимеризации стирола образуется полистирол:

задача №1
к главе «Глава VII. Генетическая связь органических и неорганических веществ».
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Видео:Получение бензола и его гомологов. 2 часть. 11 класс.Скачать

Химические свойства бензола
В лекции о бензоле мы рассмотрели строение молекулы и определили, что бензольное кольцо — уникальная система. И у этой системы свои характеристики, отличающиеся от свойств других углеводородов.

Что это означает? Это означает, что разрушить эту систему (раскрыть кольцо) возможно при специальных условиях — давление, температура, катализатор…
Для бензола и его гомологов характерны реакции замещения.
Остальные реакции идут с трудом.
Лучше, конечно, разделить химические свойства бензола и химические свойства алкилбензолов. По сути, алкилбензолы — вещества с двумя функциональными группами — бензольным кольцом и насыщенным алкильным радикалом, для которого более характерны свойства алканов.
Видео:Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

Химические свойства бензола
Реакции замещения в бензольном кольце проходят в присутствии катализаторов: солей Al(3+) или Fe(3+):
Реакция галогенирования бензола (взаимодействие с бромом — качественная реакция на бензол):
C6H6 + Br2 = C6H5Br + HBr
Нитрование бензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы -OH):
C6H6 + HO-NO2 → C6H5NO2 + H2O
Химические свойства бензола — Алкилирование — получение гомологов бензола, алкилбензолов (катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):
С6H6 + С2H5Cl → C6H5C2H5 + HCl
Химические свойства гомологов бензола — алкилбензолов
Реакции замещения алкилбензолов:
во-первых, гомологи бензола более ракционноспособны — легче вступают в реакции,
во-вторых, эти реакции идут немного по-другому:
Галогенирование алкилбензолов:
С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr
Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор — соли Al(3+)
Нитрование алкилбензолов:
С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3
тринитротолуол, он же тротил
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5CH3 + [O] → C6H5COOH — бензойная кислота
Гидрирование бензола и алкилбензолов:
Тут уже различий нет. при гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 H2 → C6H12 циклогексан
С6H5CH3 + 3 H2 → C6H11-CH3 — метилциклогексан
Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
🌟 Видео
Бромирование БензолаСкачать

Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

А ты знаешь сколько существует изомеров бензола?😏😱#химия #олимпиаднаяхимия. [ChemToday]Скачать
![А ты знаешь сколько существует изомеров бензола?😏😱#химия #олимпиаднаяхимия. [ChemToday]](https://i.ytimg.com/vi/0mdl03FTjE8/0.jpg)
Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Химические свойства бензола и его гомологов. 3 часть. 11 класс.Скачать

Отношения бензола к бромной воде и раствору перманганата калияСкачать

Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать

Химические свойства бензола | Химия 10 класс | УмскулСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать