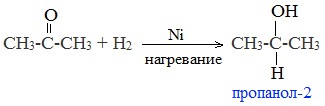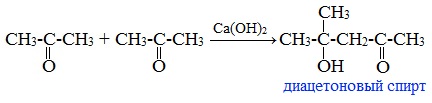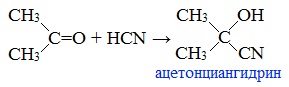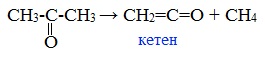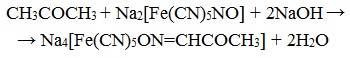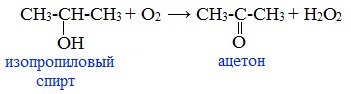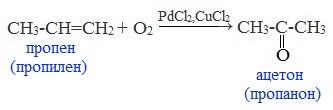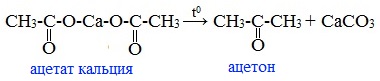Задание 338.
Написать уравнения реакций присоединения водорода и гидросульфита натрия к следующим соединениям: а) ацетону; б) метилпропилкетону; в) пентаналю.
Решение:
а)
1) присоединение водорода к ацетону:
При этом из кетона получается вторичный спирт.
2) присоединение гидросульфита натрия к ацетону:
Ацетон присоединяет гидросульфит натрия с образованием бисульфитного соединения.
1) присоединение водорода к метилпропилкетону:
При этом из метилпропилкетона получается вторичный спирт.
2) присоединение гидросульфита натрия к метилпропилкетоу:
Метилпропилкетон присоединяет гидросульфит натрия с образованием бисульфитного соединения.
1) присоединение водорода к пентаналю:
При этом образуется первичный спирт.
2) присоединение гидросульфита натрия к пентаналю:
При этом образуется гидросульфитное производное пентаналя.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Уравнение реакции ацетона с водородом
Ацетон — простейший представитель насыщенных кетонов.
Физические свойства
Ацетон (пропанон-2, диметилкетон) СН3-СО-СН3 — летучая бесцветная жидкость с характерным запахом и температурой кипения 56 0 С.

Он хорошо растворяет многие органические вещества (жиры, смолы, ацетилцеллюлозу, воск, резину и др.), поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности.
Ацетон встречается в организме человека. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе.
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины.
Токсичность ацетона
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови.
При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
1. Гидрирование (восстановление)
При тех же условиях, что и формальдегид, ацетон присоединят водород:
Водород присоединяется вследствие разрыва двойной связи карбонильной группы.
2. Взаимодействие с гидросульфитом натрия
Ацетон один из немногих кетонов образует бисульфитное соединение:
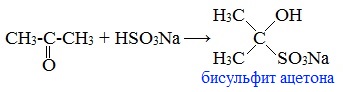
Под действием щелочей ацетон вступает в альдольную самоконденсацию, с образованием «ацетонового» (диацетонового) спирта:
4. Взаимодействие с синильной кислотой
Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты с образованием ацетонциангидрина:
5. Пиролиз ацетона
При нагревании выше 500 0 C ацетон распадается на кетен и метан:
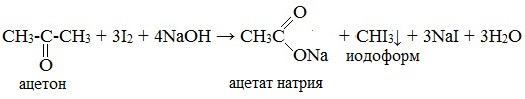
6. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на ацетон!
При взаимодействии ацетона с избытком йода в щелочной среде образуется йодоформ – желтое вещество с характерным запахом:
Аналогичные реакции идут с хлором и бромом, но только реакция с йодом приводит к нерастворимому йодоформу.
7. Взаимодействие с нитропруссидом натрия
Качественная реакция на ацетон!
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску . При подкислении уксусной кислотой CH3COOH окраска переходит в красно-фиолетовую :
Йодоформная реакция и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче при сахарном диабете.
Получение
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, окислением пропена, «кумольным» способом, окислением изопропилового спирта, гидратацией ацетилена водяным паром.
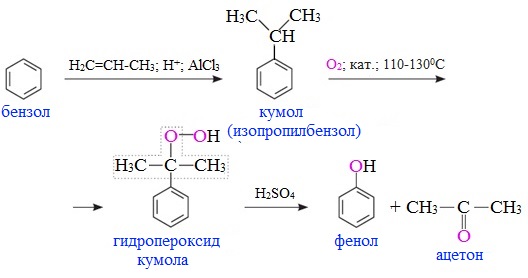
1.Кумольный способ
Данный способ получения фенола основан на окислении кумола (изопропилбензола). В качестве исходных продуктов используют бензол и пропилен.
Процесс протекает в три стадии. На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса-Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
Окисление кумола — экономически выгодный метод, так как позволяет получить наряду с фенолом другой важный продукт — ацетон (на 1 кг фенола приходится 0,6 кг ацетона). В настоящее время этот метод наиболее широко используется в промышленности и позволяет производить более 80% синтетического фенола.
2. Окисление изопропилового спирта
Ацетон получают в больших количествах при окислении изопропилового спирта:
В качестве катализатора применяется медь, серебро, никель, платина и др. Воздух, насыщенный парами изопропилового спирта, пропускают над тонким слоем катализатора при температуре 400-650 0 С.
Если процесс окисления протекает в жидкой фазе, то, как побочный продукт образуется пероксид водорода:
3. Каталитическое окисление пропена кислородом воздуха
В промышленности ацетон получают прямым окислением пропена в жидкой фазе в присутствии катализатора — смеси PdCl2 и CuCl2 при температуре 100 0 C:
4. Брожение крахмала
Незначительное значение имеет метод брожения крахмала под действием бактерий с образованием ацетона и бутанола. Метод характеризуется малыми выходами.
5. Пиролиз ацетата кальция
Ацетон можно получить пиролизом ацетата кальция:
6. Гидратация ацетилена водяным паром
Реакция протекает при 400-460 0 С над катализатором, содержащим оксиды железа и марганца:
Применение
В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс, красителей, взрывчатых веществ, а также в фотографии.
Ацетон применяется в производство искусственного шелка и синтетической кожи, в производстве смазочных масел, бездымного пороха, кинопленки.
В химической промышленности ацетон является промежуточным химическим соединением при производстве многих химикатов, таких как кетен, уксусный ангидрид, бисфенол А, метилметакрилат, хлороформ, изофорон, йодоформ, витамин С.
Метилметакрилат применяется, главным образом, в виде листов пластика, порошков для литья и формовки, поверхностных покрытий, эмульсионных полимеров, волокон, чернил и пленок.
Метилметакрилат также применяется в производстве материалов, известных под названием плексигласа или люцита. Они используются в зубных протезах, твердых контактных линзах, и клеях.
Метилметакрилат – мономер для синтеза полиметилметакрилата («органическое сырье»).
Видео:Водород/химические свойства водорода/8 классСкачать

Уравнение реакции ацетона с водородом
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| A | Б | В | Г |
А) При взаимодействии кетонов и водорода (гидрирование, восстановление) получаются вторичные спирты:
.
Таким образом, букве А соответствует цифра 2 (пропанол-2).
Б) При взаимодействии алкенов и воды (гидратация) получаются спирты. Реакция протекает по правилу Марковникова:
.
Таким образом, букве Б соответствует цифра 2 (пропанол-2).
В) При взаимодействии альдегидов и водорода (гидрирование, восстановление) получаются первичные спирты:
.
Таким образом, букве В соответствует цифра 1 (пропанол-1).
Г) При взаимодействии пропионовой кислоты и щелочного металла получаются соль и водород:
.
Таким образом, букве Г соответствует цифра 5 (пропионат натрия).
📹 Видео
Водород. 8 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

38. Водород. Химические свойстваСкачать

Свойства и применение водорода. 8 класс.Скачать

Уравнивание реакций горения углеводородовСкачать

Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Решаем два варианта Добротина за 2 часаСкачать

Получение АЦЕТОНАСкачать

7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать

Физические и химические свойства водорода Применение водородаСкачать

Как получают перекись водородаСкачать

Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

Реакция 90 ного пероксида водорода и ацетонаСкачать

Взаимодействие хлора с водородомСкачать

Бромоформ - CHBr3. Реакция Ацетона, Брома и Гидроксида Натрия. Реакция (CH3)2CO, Br2 и NaOHСкачать

Окисление ацетона хромовым ангидридомСкачать

ПОЛУЧЕНИЕ ХЛОРОФОРМА. Реакция Гипохлорита Натрия и Ацетона. Реакция NaClO + (CH3)2COСкачать

Химические свойства алканов. 1 часть. 10 класс.Скачать