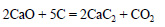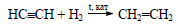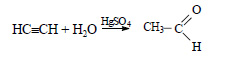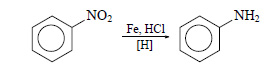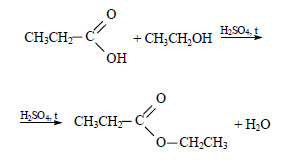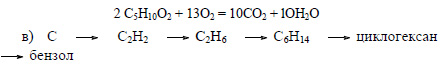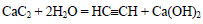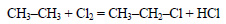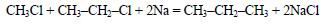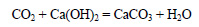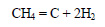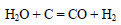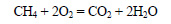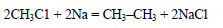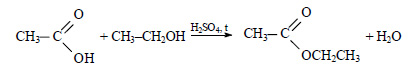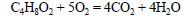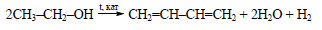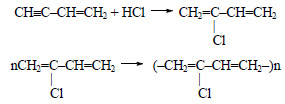Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение этанола
- Водородные связи и физические свойства спиртов
- Изомерия спиртов
- Структурная изомерия
- Химические свойства этанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление этанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование этанола
- Получение этанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Получение этанола спиртовым брожением глюкозы
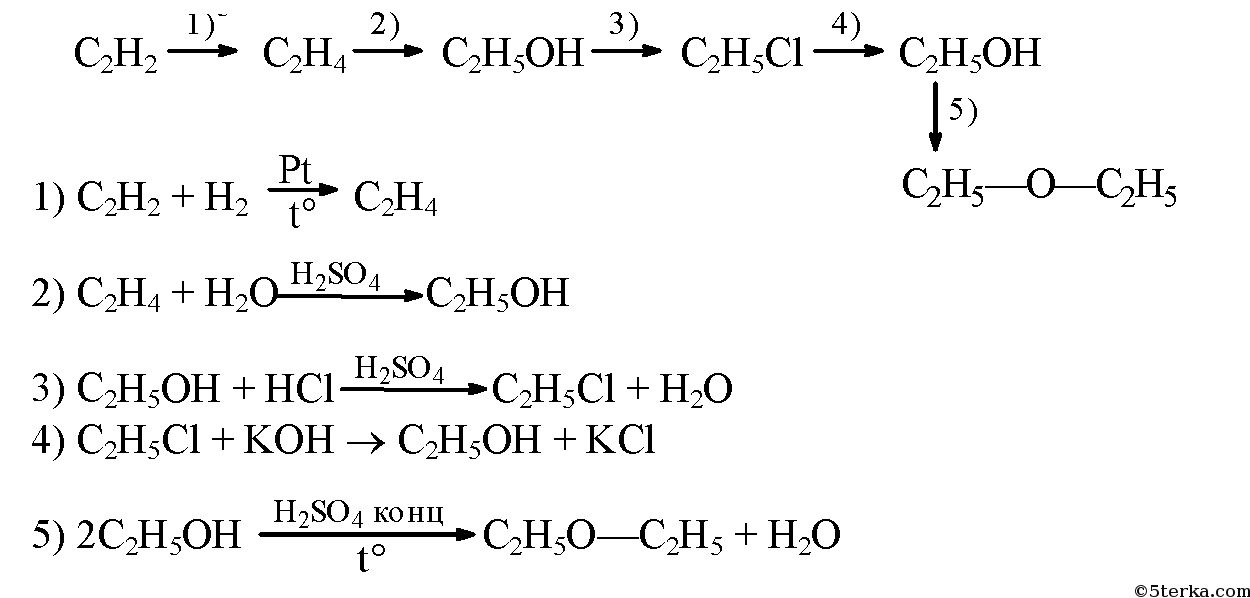
- 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ацетилен → этилен → этанол —хлорэтан → этанол → диэтиловый эфир.
- 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ацетилен → этилен → этанол —хлорэтан → этанол → диэтиловый эфир.
- Уравнение реакции ацетилена с этанолом
- ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ
- ФОРМУЛА ИЗОБРЕТЕНИЯ
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Изомерия спиртов
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Видео:Видеоопыты. Органика 58. Окисление этанола раствором перманганата калияСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Видео:Органическая химия. Практическая часть - решение задачи. 9 класс.Скачать

В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
Видео:3.3. Алкины: Химические свойстваСкачать

4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
Видео:Получение и изучение свойств этилена. Опыт 2Скачать

5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Получение этанола
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Видео:Все задания №32 из сборника ЕГЭ 2023 (часть 1) | Химия ЕГЭ для 10 класса | УмскулСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Видео:Именные реакции в органической химии | Химия ЕГЭСкачать

Видео:Практическая работа "Получение этилена и опыты с ним" 10 классСкачать

4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Видео:Цепочки превращений по органической химии. Вариант №3. Свойства спиртов.Скачать

3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ацетилен → этилен → этанол —хлорэтан → этанол → диэтиловый эфир.
Видео:Взаимосвязь органических веществ (вопрос 16 и 33 в заданиях ЕГЭ-2019)Скачать

3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ацетилен → этилен → этанол —хлорэтан → этанол → диэтиловый эфир.

задача №3
к главе «Тема VI. Спирты и фенолы. Работа 1 Предельные одноатомные спирты. Вариант 4».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Как БЫСТРО понять Химию? Органическая Химия с нуляСкачать

Уравнение реакции ацетилена с этанолом

задача №1
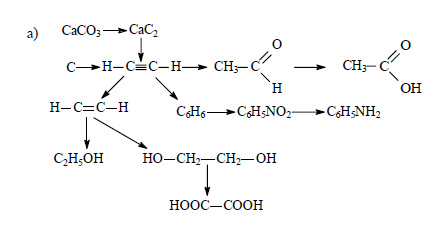
к главе «Глава VII. Генетическая связь органических и неорганических веществ».
Ответ:
При сильном нагревании карбонат кальция разлагается на оксид кальция и оксид углерода (IV):
Оксид кальция при высокой температуре реагирует с углем с образованием карбида кальция:
При действии на карбид кальция воды получается ацетилен:
Этиловый спирт из ацетилена можно получить в две стадии. При гидрировании ацетилена в присутствии катализатора образуется этилен:
При присоединении к этилену воды в присутствии кислот образуется этиловый спирт.
При окислении этилена раствором перманганата калия образуется этиленгликоль:
При окислении этиленгликоля образуется щавелевая кислота:
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
При окислении уксусного альдегида образуется уксусная кислота:
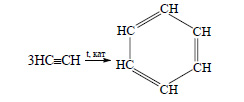
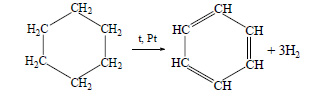
Из трех молекул ацетилена может образоваться молекула бензола (реакция тримеризации):
При действии на бензол смеси концентрированной азотной кислоты и концентрированной серной кислоты происходит замещение атома водорода на нитрогруппу и образуется нитробензол:
Нитробензол можно восстановить в аминобензол (анилин):
Из этана в две стадии можно получить этанол. При хлорировании этана образуется хлорэтан:
При действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.
При реакции этанола с пропионовой кислотой образуется этилпропионат (этиловый эфир пропионовой кислоты):
При сгорании этилпропионата образуется оксид углерода (IV). Молекулярная формула этилпропионата C5H10O2.
Оксид кальция при высокой температуре реагирует с углем с образованием карбида кальция:
При действии на карбид кальция воды получается ацетилен:
При хлорировании этана образуется хлорэтан:
При реакции хлорэтана с хлорметаном в присутствии натрия образуется пропан:
Из пропана в две стадии можно получить гексан. При хлорировании пропана образуется смесь изомеров – 1-хлорпропана и 2-хлорпропана. Изомеры имеют разные температуры кипения и их можно разделить перегонкой.
При взаимодействии 1-хлорпропана с натрием образуется гексан:
При взаимодействии 1-хлорпропана с натрием образуется гексан:
Бензол можно получить также при дегидрировании циклогексана:
г) Составьте уравнения реакций согласно второму форзацу учебника «Химия-11»:
При горении угля образуется оксид углерода (IV):
При реакции оксида углерода с гидроксидом кальция образуется оксид углерода (IV):
При сильном нагревании карбонат кальция разлагается на оксид кальция и оксид углерода (IV):
Оксид кальция образуется также при реакции кальция с кислородом:
При реакции кальция с водой образуется гидроксид кальция:
При реакции кальция с соляной кислотой образуется хлорид кальция:
Из хлорида кальция можно получить кальций электролизом расплава:
При реакции кальция или оксида кальция с углеродом при высокой температуре образуется карбид кальция:
При реакции карбида кальция с водой образуется ацетилен:
Ацетилен можно получить также из метана:
При разложении метана образуется также углерод:
Синтез-газ можно получить, пропуская водяной пар через раскаленный уголь:
Синтез-газ получают также из смеси метана и кислорода при нагревании в присутствии катализатора. При этом протекают следующие реакции: часть метана сгорает с образованием оксида углерода (IV) и воды.
Затем образовавшиеся вода и оксид углерода (IV) взаимодействую с оставшимся метаном:
Из синтез-газа можно получить уксусный альдегид при помощи следующей последовательности реакций:
При пропускании синтез-газа над катализатором образуется метанол:
При действии на метанол хлороводорода в присутствии серной кислоты образуется хлорметан (метилхлорид):
При взаимодействии хлорметана с натрием образуется этан (реакция Вюрца):
Из этана в две стадии можно получить этанол. При хлорировании этана образуется хлорэтан:
При действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.
Этанол окисляется оксидом меди при нагревании в уксусный альдегид:
При гидрировании ацетилена в присутствии катализатора образуется этилен:
Наоборот, при дегидрировании ацетилена образуется этилен:
При присоединении к этилену воды в присутствии кислот образуется этиловый спирт.
При сильном нагревании этилового спирта с серной кислотой происходит дегидратация и образуется этилен:
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
При окислении уксусного альдегида образуется уксусная кислота:
При восстановлении уксусного альдегида образуется этиловый спирт:
При реакции уксусной кислоты с этиловым спиртом образуется этилацетат:
При горении этилацетата образуется оксид углерода (IV):
Из этилового спирта в присутствии катализаторов образуется 1,3-бутадиен:
При полимеризации бутадиена получается синтетический каучук.
Ацетилен димеризуется с образованием винилацетилена.
При присоединении к винилацетилену хлороводорода образуется 2-хлорбутадиен-1,3 (хлоропрен), при полимеризации которого образуется хлоропреновый каучук.
При тримеризации ацетилена образуется бензол:
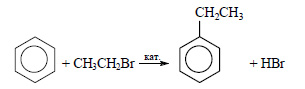
При реакции бензола с бромэтаном в присутствии катализатора образуется этилбензол (алкилирование бензола):
При дегидрировании этилбензола образуется винилбензол (стирол):
При полимеризации стирола образуется полистирол:
Изобретение относится к способам получения этилового спирта и уксусной кислоты или их смеси, которые могут быть использованы во многих отраслях народного хозяйства. Первый способ заключается в том, что этиловый спирт или уксусную кислоту получают из ацетилена путем его обработки окислителем-восстановителем — 30-40% водными растворами перекиси водорода и гидразин-гидрата при мольном соотношении ацетилен : перекись водорода : гидразин-гидрат 1:1:1 или 1: 2: 0,5 соответственно. Второй способ заключается в том, что этиловый спирт и/или уксусную кислоту получают из ацетальдегидаммиака обработкой кислородом при мольном соотношении ацетальдегидаммиак : кислород 1:3,75 или 1: 2,25 в присутствии катализатора перманганата калия при 75-80 o С. Исходный ацетальдегидаммиак получают из карбида кальция и аммиака или ацетилена и нашатырного спирта. Способ позволяет снизить взрыво- и пожароопасность. 2 с. п. ф-лы.
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ
Изобретение относится к получению этилового спирта и уксусной кислоты или их смеси и может быть использовано во многих отраслях народного хозяйства.
Существует значительное количество способов приготовления этилового спирта и уксусной кислоты. В частности известны способы окислением этилена с получением уксусной кислоты в смеси с уксусным альдегидом (US 1943385) или взаимодействием этилена и кислорода с получением уксусной кислоты, минуя стадию образования уксусного альдегида (RU 2131409). Известен также способ получения уксусной кислоты из ацетилена и кислорода в присутствии ртутных соединений и необходимых для реакции количеств воды с добавлением, при необходимости, других катализаторов (SU 8015).
Известен также способ получения уксусной кислоты или этилового спирта с использованием ацетилена, получаемого из карбида кальция, который является одним из ближайших аналогов (см. стр. 427, 444, Г.Реми, Курс неорганической химии, том 1, Издательство «Мир», Москва, 1972 г.).
Согласно этому аналогу полученный из карбида кальция ацетилен расщепляется в генераторе в присутствии ртути при 70-80 o С. В итоге образуется ацетальдегид, который затем перерабатывается в уксусную кислоту (кислород + перманганат калия) или в этиловой спирт (каталитически водородом).
Указанный способ позволяет получать в нужном количестве эти продукты. Однако он имеет ряд недостатков: применение раздельного оборудования, стойкого к агрессивным средам; использование в качестве катализатора ртути, очень вредной для здоровья человека; образование твердых отходов и шлама; большие потери ртути и перманганата; необходимость разделения ацетальдегида и уксусной кислоты (этилового спирта).
Настоящее изобретение позволяет использовать в качестве реагентов перекись водорода и гидразин-гидрат в виде 30-40%-ных водных растворов. При контакте этих веществ друг с другом и с ацетиленом в реакторе происходит образование спирта или кислоты
1. С2Н2+H2O2+N2H4•H2O=C2H5OH+2H2O+N2
26+34+50=46+36+28
1кг+1,3+1,9=1,8кг+1,4+1,0
2. 2С2Н2+4H2O2+N2H4•H2O=2CH3COOH+5H2O+N2
52+136+50=120+90+28
1кг+2,6+0,97=2,37+1,7+0,5
Течение реакций неогне- и невзрывоопасно, так как процесс протекает в среде азота, освобождающегося при разложении гидразина перекисью. Он является как бы побочным продуктом и может быть использован для любых нужд производства, в том числе и для получения гидразина.
Таким образом, предлагаемый способ позволяет при использовании одних и тех же реагентов и аппаратов получать из ацетилена этиловый спирт и уксусную кислоту, минуя стадию образования ацетальдегида и его переработку в указанные продукты. Тепла, выделяемого первой реакцией, вполне достаточно для испарения этилового спирта из реактора. В случае уксусной кислоты необходимо последующее отделение ее от воды.
Предлагаемый способ лишен всех недостатков, присущих ближайшему аналогу, и имеет существенные преимущества: прост в исполнении; не требует излишнего оборудования; в зависимости от спроса позволяет перестраиваться с этилового спирта на уксусную кислоту, не меняя оборудования; технология не связана с применением катализаторов, так как роль окислителя-восстановителя ацетилена выполняет перекись водорода и гидразин-гидрат, выпускаемые промышленностью в значительных количествах.
В случае использования в качестве исходного реагента ацетальдегидаммиака (твердое вещество, растворимое в воде), который образуется при воздействии на карбид кальция или ацетилен аммиаком или нашатырным спиртом, реакции идут по схемам:
3CH3CH=NH+3,75O2=3CH3COOH+1,5H2O+1,5N2
129+120=180+27+42
1кг+0,92=1,39+0,21+0,32
3CH3CH=NH+2,25O2=1,5CH3COOH+1,5C2H5OH+1,5N2
129+72=90+69+42
1кг+0,56=0,7+0,54+0,32
В качестве катализатора служит перманганат калия. Процесс протекает при 75-80 o С. Азот и спирт испаряются. Уксусная кислота по первой схеме получается в виде 87- процентного водного раствора, а по второй (после улетучивания спирта и азота) — концентрированной. Такой метод не связан с применением гидразин-гидрата и перекиси водорода. В остальном, в части технологического оформления, он не отличается от вышеописанного. В обоих случаях исходным сырьем является карбид кальция или газообразный ацетилен.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Способ получения этилового спирта или уксусной кислоты из ацетилена, отличающийся тем, что ацетилен подвергают обработке окислителем-восстановителем — 30-40% водными растворами перекиси водорода и гидразин-гидрата при мольном соотношении ацетилен : перекись водорода : гидразин-гидрат 1:1:1 или 1:2:0,5 соответственно.
2. Способ получения этилового спирта и/или уксусной кислоты, отличающийся тем, что ацетальдегидаммиак, полученный из карбида кальция и аммиака или ацетилена и нашатырного спирта, подвергают обработке кислородом при мольном соотношении ацетальдегидаммиак : кислород 1:3,75 или 1:2,25 в присутствии катализатора перманганата калия при 75-80 o С.
Ответ оставил Гость
Из ацетилена можно легко сделать особый ацетиленовый моносахарид (ацетилид глюкозы). Для этого нужно смешать поваренную соль с сахаром в пропорции 1:100, растворить в воде и пропустить ацетилен через раствор. Ацетилид глюкозы выпадает в осадок. Далее добавляем немного дрожжей, закрываем крышкой и настаиваем неделю в тёплом месте. Далее отгоняем этанол из полученной смеси.
Нельзя всё время учиться. А для развлечения мы рекомендуем вам поиграть в отличную игру: