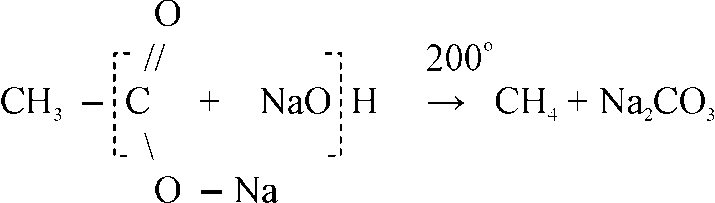Метан в лаборатории получают прокаливанием безводного ацетата натрия с натронной известью. Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция. Возьмем натронную известь и ацетат натрия, тщательно перемешаем и поместим в пробирку. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь. Через некоторое время начинает выделяться метан
Поджигаем метан . Он горит почти бесцветным пламенем. При горении метана образуется углекислый газ и вода.
Оборудование: штатив, пробирка с газоотводной трубкой, ступка фарфоровая с пестиком, шпатель, горелка.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Видео:Получение метанаСкачать

Опыты по химии. Предельные углеводороды
Постановка опытов и текст – к.п.н. Павел Беспалов.
Получение метана
Метан в лаборатории получают прокаливанием безводного ацетата натрия с натронной известью. Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция. Тщательно перемешаем натронную известь с ацетатом натрия и поместим в пробирку. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь. Через некоторое время начинает выделяться метан
CH3COONa + NaOH = CH4 + Na2CO3
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами. Не допускать попадания натронной извести на кожу.
Горение метана и изучение его физических свойств
Заполним метаном цилиндр. Метан представляет собой бесцветный газ, мало растворимый в воде. Он легче воздуха, поэтому легко улетучивается из открытого цилиндра. При поджигании метан загорается. При сгорании метана образуются углекислый газ и водяные пары.
CH4 + 2О2 = СО2 + 2 Н2О
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами. Не допускать попадания натронной извести на кожу.
Взрыв метана с кислородом
Для полного сгорания метана на один объем метана нужно взять два объема кислорода (см. уравнение реакции). Пластиковую бутылку, разделенную метками на три равные части, заполним способом вытеснения воды одной частью метана и двумя частями кислорода. При поджигании смеси происходит взрыв — полное сгорание метана в кислороде.
CH4 + 2О2 = СО2 + 2 Н2О
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами.
Отношение метана к раствору перманганата калия и бромной воде
Получаем метан прокаливанием безводного ацетата натрия с натронной известью. Пропустим метан через раствор перманганата калия. Никаких видимых изменений не наблюдаем. Бромная вода также не изменяет своей окраски. Метан стоек к окислителям и не вступает в реакцию с бромом при данных условиях.
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами.
Горение жидких углеводородов
Возьмем для опыта гексан и керосин.
Молекула гексана содержит шесть атомов углерода. Керосин – это смесь молекул алканов, в составе которых от двенадцати до восемнадцати атомов углерода. Подожжем небольшие количества гексана и керосина. Гексан загорается сразу: алканы с небольшой молекулярной массой загораются легко.
Поджечь керосин оказывается немного труднее, появляется коптящее пламя. В виде копоти выделяется несгоревший углерод. Большинство алканов горят коптящим пламенем из-за высокого содержания углерода. Мы убедились в том, что алканы с небольшой молекулярной массой загораются легче, чем алканы с большой молекулярной массой.
Оборудование: фарфоровые чашки, лучина, огнезащитная прокладка.
Техника безопасности. Соблюдать правила работы с горючими жидкостями. Работать с небольшими количествами жидких углеводородов (не более 2 мл).
Горение твердых углеводородов (на примере парафина)
Парафин – смесь твердых алканов, содержащих в своем составе от 16 до 40 атомов углерода. Твердый парафин на воздухе загорается с трудом. Кипящий парафин на воздухе самовозгорается. Нагреем парафин до кипения. Выливаем кипящий парафин из пробирки в кристаллизатор, наполненный водой. Кипящий парафин, смешиваясь с воздухом, загорается. При горении парафина образуются углекислый газ и водяные пары.
Оборудование: пробирка, зажим пробирочный, горелка, кристаллизатор.
Техника безопасности. Соблюдать правила работы с горючими веществами. Не наклоняться над кипящим парафином. Не допускать попадание парафина на одежду, кожу.
Установление качественного состава предельных углеводородов
Общим методом определения углерода и водорода в органических соединениях является окисление веществ оксидом двухвалентной меди. При этом углерод окисляется до углекислого газа, а водород до воды. Оксид меди (II) восстанавливается до меди или до оксида одновалентной меди, имеющих красный цвет
С18Н38 + СuО = 18СО2 + 19 Н2О + 55Сu
Углекислый газ обнаруживают при помощи известковой воды. Известковая вода мутнеет от углекислого газа.
Ca (OH)2 + CO2 = CaCO3 ↓ + H2O
Воду обнаруживают безводным сульфатом меди (II). Под действием воды белый сульфат меди (II) переходит в голубой кристаллогидрат — медный купорос
CuSO4 + 5H2O = CuSO4 * 5 H2O
Оборудование: пробирка с газоотводной трубкой, стакан, штатив, горелка.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Определение содержания хлора в органических соединениях
Качественно определить содержание галогена в органическом соединении можно при помощи медной проволоки. При нагревании с оксидом меди (II) галогенсодержащие вещества сгорают с образованием летучих соединений, окрашивающих пламя в сине-зеленый цвет. Эта качественная реакция на галогены в органических соединениях называется пробой Бейльштейна. Для проведения пробы медную проволоку прокаливают в пламени горелки, опускают в жидкость или касаются твердого вещества и вновь вносят в пламя горелки. Появление сине-зеленого окрашивания, свидетельствует о наличии галогена в органическом соединении. Испытаем диметиламин хлорид и убедимся в том, что в его составе присутствует галоген — хлор.
Оборудование: горелка, медная спираль.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Видео:Получение метанаСкачать

По теме лабораторной работы
Лабораторная работа № 1
Тема: Получение метана и изучение его свойств.
Цель: изучить свойства метана; опытным путем исследовать их.
Реактивы и оборудование: прибор для получения газа, заправленный смесью ацетата натрия и натронной извести, металлический штатив, держалка, кристаллизатор, штатив с пробирками, раствор перманганата калия, раствор йодной воды, стакан, спиртовка, спички.
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Предельными или насыщенными углеводородами называют ациклические углеводороды, в которых все валентности атомов углерода, не затраченные на образование углерод – углеродных (С — С) связей, насыщены атомами водорода. Ациклические соединения – вещества, имеющие прямую или разветвленную, но обязательно открытую (незамкнутую) цепь углеродных атомов. Первым членом класса предельных углеводородов является метан – СН4. Предельные углеводороды образуют гомологический ряд. Гомологическим рядом называют ряд органических соединений, сходных по своему химическому строению, имеющих общие методы получения, обладающих близкими химическими и закономерно изменяющимися физическими свойствами.
Общая формула предельных углеводородов CnH2n +2. Метан представляет собой газ (tкип. = -111 о С, tпл. = -192 о С), легче воздуха.
Молекулы предельных углеводородов содержат ковалентные связи. Вследствие малой химической активности предельные углеводороды получили название парафинов (от латинского выражения: лишенные сродства, с трудом вступающие в реакции). Парафины настолько малоактивны, что даже с очень активными химическими реагентами (О2, галогены) вступают во взаимодействие только после предварительного возбуждения реагирующих веществ – нагревания или под действием яркого (или ультрафиолетового) света.
В молекулах предельных углеводородов атомы углерода либо связаны между собой простыми связями (С – С связи) либо с атомами водорода
(С – Н связи). Поэтому при химических реакциях могут разрываться или
С – С или С – Н связи. Наиболее важными реакциями, характеризующими химические свойства предельных углеводородов, являются реакции замещения атомов водорода на
атомы галогенов. Образуются моно-, ди-, три- и полигалогензамещенные предельных углеводородов.
Гомологи метана могут расщепляться не только с разрывом С – Н связей и отщеплением водорода (дегидрогенизация), но и с разрывом С – С связей (крекинг). При этом образуется смесь предельных и непредельных соединений, например:
В лаборатории для получения метана и его гомологов пользуются разложением солей органических кислот при прокаливании их со щелочами:
Другим лабораторным способом получения предельных углеводородов служит реакция Вюрца – нагревание моногалогенпроизводных предельных углеводородов с металлическим натрием:
В этой реакции происходит «удвоение» радикалов, входящих в состав галогенпроизводного, т.е. из С3Н7Cl можно получить С6Н14 и т.д.
ХОД РАБОТЫ
Опыт №1.Получение метана
Метан в лаборатории получают прокаливанием безводного ацетата натрия с натронной известью. Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция. Возьмем натронную известь и ацетат натрия, тщательно перемешаем и поместим в пробирку. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь. Через некоторое время начинает выделяться метан
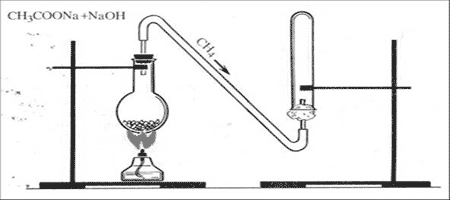
Поджигаем метан. Он горит почти бесцветным пламенем. При горении метана образуется углекислый газ и вода.
Опыт №2.Горение метана и изучение его физических свойств
Заполним метаном цилиндр. Метан представляет собой бесцветный газ, мало растворимый в воде. Он легче воздуха, поэтому легко улетучивается из открытого цилиндра. При поджигании метан загорается. При сгорании метана образуются углекислый газ и водяные пары.
🎥 Видео
"Горячий лёд" - эксперимент и получение ацетата натрия!Скачать

Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

Ацетат натрия - получение метана и ацетона. Sodium acetate - making methane and actone!Скачать

Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Получение ацетата натрия двумя способами. Наблюдение разного теплового эффектаСкачать

Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать

Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать

Приготовление Ацетата натрия для электролита НикелированияСкачать

Ацетат натрия, изготовление.Скачать

Получение Ацетата НатрияСкачать

Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать

Обнаружение ионов в растворе. Качественные реакцииСкачать

Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Качественная реакция ионов калия с гидротартратом натрияСкачать

Реакция СУЛЬФИТА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Простые опыты по химии.Скачать

Реакция Силиката Натрия С Солями. Получение Нерастворимых Силикатов.Скачать

ЧЕМ ПОГАСИТЬ КИСЛОТУ В ЦАРЕ, ПРИ АФФИНАЖЕ? ДЕЛАЮ АЦЕТАТ НАТРИЯ ( CH3COONa )!Скачать

Чем заменить сульфаминку и мочевину при осаждении золота?Скачать