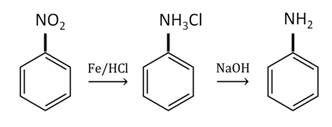
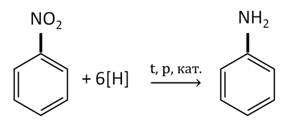
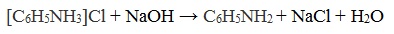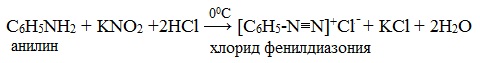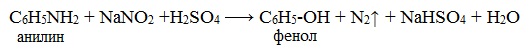Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
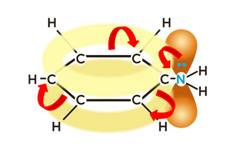
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
- I. Основные свойства
- II. Особые свойства анилина
- III. Окисление анилина
- IV. Диазотирование анилина
- Acetyl
- Уравнение реакции анилина с ангидридом уксусной кислоты
- Владельцы сайта
- Анилин
- Анилин. Его свойства и применение .mp4
- 35 Анилин.mp4
- Изучение физических свойств анилина.mp4
- Реакция анилина с соляной кислотой.mp4
- Раствор анилина, изучение среды.mp4
- Бромирование анилина.mp4
- Окисление анилина раствором дихромата калия.mp4
- Окисление анилина раствором хлорной извести.mp4
- 🌟 Видео
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
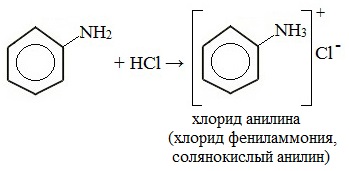
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
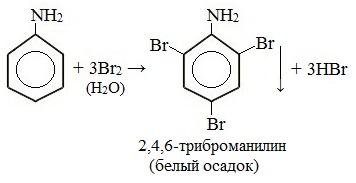
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
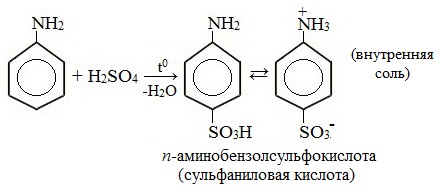
2. Сульфирование
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Видео:Качественная Реакция На Салициловую И Уксусную КислотуСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Задача на разбавление уксусного ангидрида уксусной кислотой. Органика. Олимпиада.Скачать  Уравнение реакции анилина с ангидридом уксусной кислоты3757 дн. с момента Владельцы сайта
АнилинАнилин. Его свойства и применение .mp435 Анилин.mp4Анилин – это ароматический амин. Его называют так, потому что аминогруппа у него связана непосредственно с атомом углерода бензольного кольца. Анилин, или фениламин, имеет формулу С 6 H 5 NH 2 . Он представляет собой бесцветную маслянистую жидкость с характерным запахом, мало растворим в воде, но хорошо растворяется в этаноле и бензоле. (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Изучение физических свойств анилина.mp4Свойства аминогруппы: Рассмотрим химические свойства анилина. Он реагирует с кислотами. Так, в реакции анилина с соляной кислотой образуется хлорид фениламмония. Реакция анилина с соляной кислотой.mp4Эта реакция подтверждает тот факт, что аммиак и амины – основания, причём амины более сильные основания. Однако анилин – более слабое основание, чем алифатические амины. Это объясняется наличием в его молекуле бензольного кольца, которое оказывает влияние на неподелённую пару электронов атома азота. Электронная пара электронов атома азота также взаимодействует с электронным облаком бензольного кольца, что приводит к ослаблению основных свойств. Анилин с водой не реагирует и не изменяет окраску индикатора. Раствор анилина, изучение среды.mp4Таким образом, основные свойства у аммиака выражены сильнее, чем у анилина; у первичных аминов осно вные свойства выражены сильнее, чем у аммиака, а наиболее выраженными основными свойствами обладают вторичные амины. Для анилина характерна реакция горения, при этом образуется оксид углерода (IV), азот и вода. 4C6H 5 NH 2 + 31O 2 → 24CO 2 ↑ + 2N 2 ↑ + 14H 2 O Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. Для анилина характерны свойства бензольного кольца – действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях: С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком. Бромирование анилина.mp4Для анилина характерны реакции галогенирования. Так, в реакции анилина с бромной водой образуется белый осадок 2,4,6-триброманилина. C 6 H 5 NH 2 + 3Br 2 → C 6 H 2 NH 2 Br 3 ↓ + 3HBr Эту реакцию используют для обнаружения анилина. Эта реакция подтверждает влияние аминогруппы на бензольное кольцо. Аминогруппа активирует бензольное кольцо, поэтому реакция бромирования анилина идёт легче, чем в бензоле. Окисление анилина раствором дихромата калия.mp4Окисление анилина раствором хлорной извести.mp4В реакции анилина с хлорангидридом уксусной кислоты получают ацетанилид, который использовали как первое синтетическое жаропонижающее средство. В реакции анилина с серной кислотой образуется вещество, которое называют ещё сульфаниловой кислотой, это вещество используют как промежуточное вещество в синтезе лекарственных средств и красителей. С древних времён люди использовали природный краситель синего цвета – индиго. Из-за того, что этот краситель стоил очень дорого, учёные давно пытались его синтезировать. Адольф Байер − немецкий химик, профессор Страсбургского и Мюнхенского университетов. Ему принадлежат замечательные синтезы органических соединений, в том числе синтез индиго − важнейшего природного красителя. Исследовал реакции конденсации. Изучал многие классы органических соединений. Лауреат Нобелевской премии В 1840 году Фрицше обнаружил, что при нагревании со щёлочью синяя окраска индиго исчезает и образуется вязкая масса. Очистив это вещество, Фрицше получил жидкость с характерным запахом и назвал её анилином (от арабского an-nil «синий»). В 1841 г русский химик Зинин открыл способ восстановления нитробензола до ароматического амина – бензамида. Николай Николаевич Зинин − выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества. Анилин в лаборатории получают восстановлением нитробензола железом в присутствии соляной кислоты. В промышленности анилин получают по реакции Зинина, то есть восстановлением нитробензола. Эта реакции идёт под давлением в присутствии катализаторов. Анилин находит широкое применение. Его используют для синтеза красителей, лекарств и взрывчатых веществ. Таким образом, представителем ароматических аминов является анилин. Свойства анилина обусловлены наличием аминогруппы и бензольного кольца. Анилин реагирует с кислотами, вступает в реакцию с бромной водой. Получают анилин в промышленности по реакции Зинина. Анилин используют в производстве красителей, лекарств и взрывчатых веществ. 🌟 ВидеоЛабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать  Изъятие ангидрида уксусной кислотыСкачать  Практическая работа.Получение и свойства уксусной кислоты.Скачать  12.4. Анилин: Строение, химические свойства, способы получения. ЕГЭ по химииСкачать  Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать  Получение ЛЕДЯНОЙ УКСУСНОЙ кислоты!Скачать  12. В-О Получение анилинаСкачать  Какие из следующих веществ не вступают в реакцию с уксусной кислотой? 1) хлор; 2) фенол; 3) магний;Скачать  Даже 1 ч.л. ЯБЛОЧНОГО УКСУСА вызывает необратимые процессы в ОРГАНИЗМЕ ЧЕЛОВЕКАСкачать  Получение ледяной уксусной кислоты/Synthesis of glacial acetic acidСкачать  Изучение адсорбции уксусной кислоты из водного раствора на активированном углеСкачать  Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать  Амины. АнилинСкачать  Тесты по химии. Уксусная кислота. А35 РТ 16-17 этап 3Скачать  Взаимодействие уксусной кислоты с металламиСкачать  Получение уксусного альдегидаСкачать  Лекция 18Скачать  #55. Анилин. Строение. Химические свойства. Получение.Скачать  |