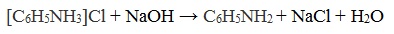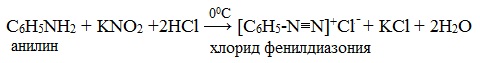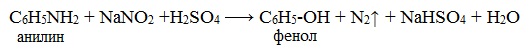Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
- I. Основные свойства
- II. Особые свойства анилина
- III. Окисление анилина
- IV. Диазотирование анилина
- 1.напишите уравнения реакций между : а) анилином и серной кислотой; б) метиламином и соляной кислотой;
- Анилин. Свойства анилина.
- Строение анилина.
- Физические свойства анилина.
- Получение анилина.
- Химические свойства анилина.
- Применение анилина.
- 💡 Видео
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
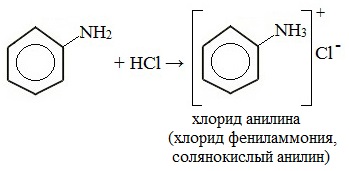
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
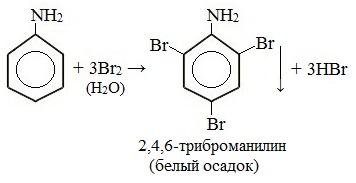
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
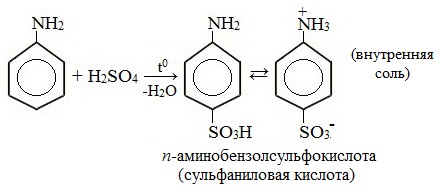
2. Сульфирование
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Видео:Серная кислота и ее соли. 9 класс.Скачать

1.напишите уравнения реакций между : а) анилином и серной кислотой; б) метиламином и соляной кислотой;
в) анилином и бромом; г) хлороводородом и этиламином. Укажите названия образующихся веществ.
2. напишите структурные формулы всех изомерных аминов состава C3H9N. назовите эти вещества.
3. при восстановлении нитробензола массой 24,6 г. получен анилин массой 17 г. рассчитайте массовую долю выхода анилина.
1/ C6H5NH2 + H2SO4 = <C6H5NH4]SO4 — сульфат фениламмония б/ CH3-NH2 + HCl = [CH3NH3]Cl -хлорид метиламмония в/ С6Н5NH2 + 3Br2 = C6H2Br3-NH2 + 3HBr /2,4,6-триброманилин и бромоводород/ г/ С2Н5-NH2 + HCl = Cl — хлорид этиламмония. 2/ СН3—N/CH3/-CH3 триметиламин, CH3-NH-C2H5 — метил, этиламин. C3H7-NH2- пропиламин. 3/ C6H5-NO2 + 6H = C6H5-NH2 +2H2O Mr/C6H5NO2/ = 123г/моль Mr/ C6H5NH2/ = 93г/моль Теоретический выход = 24,6*93/123 = 18,6г . Массовая доля выхода w= 17/18,6 = 0,914 или 91,4%
1/ C6H5NH2 + H2SO4 = <C6H5NH4]SO4 — сульфат фениламмония б/ CH3-NH2 + HCl = [CH3NH3]Cl -хлорид метиламмония в/ С6Н5NH2 + 3Br2 = C6H2Br3-NH2 + 3HBr /2,4,6-триброманилин и бромоводород/ г/ С2Н5-NH2 + HCl = Cl — хлорид этиламмония. 2/ СН3—N/CH3/-CH3 триметиламин, CH3-NH-C2H5 — метил, этиламин. C3H7-NH2- пропиламин. 3/ C6H5-NO2 + 6H = C6H5-NH2 +2H2O Mr/C6H5NO2/ = 123г/моль Mr/ C6H5NH2/ = 93г/моль Теоретический выход = 24,6*93/123 = 18,6г . Массовая доля выхода w= 17/18,6 = 0,914 или 91,4%
Видео:Изучаем химические свойства концентрированной серной кислоты!Скачать

Анилин. Свойства анилина.
Анилин (фениламин) C5H5NH2 – представитель класса ароматических аминов, в которых аминогруппа связана напрямую с бензольным кольцом.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Строение анилина.
Неподеленная пара атома азота реагирует с π-системой бензольного кольца. Взаимодействие можно представить так:
На атоме азота появляется частично положительный заряд, и основные свойства понижаются. А в бензольном кольце, наоборот, электронная плототность повышается, и наиболее сильно в орто- и пара- положениях:
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Физические свойства анилина.
Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворимы в воде, но хорошо – в этиловом спирте и в бензоле.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение анилина.
1. Основным способом получения анилина является процесс восстановления нитробензола. Для этого используют никелевый или медный катализатор при 250-350 °С:
В лаборатории используют восстановления цинка в кислой среде или алюминия в щелочной:
Видео:Взаимодействие серной кислоты с металламиСкачать

Химические свойства анилина.
Анилин является более слабым основанием, чем алифатические амины, т.к. электронная пара азота частично смещена в бензольное кольцо.
Анилин вступает в реакцию с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
2. Анилин вступает в реакции электрофильного замещения в безольном кольце. Аминогруппа направляет замещение в орто- и пара- положения. Анилин легко бромируется, при этом выпадает белый осадок:
3. С концентрированной азотной кислотой анилин взаимодействует со взрывом. На время реакции можно защитить аминогруппу (превратить ее в амидную перед нитрованием), а после нитрования гидролизовать амид с образованием исходной аминогруппы:
3. При взаимодействии с азотистой кислотой образуются соли диазония:
4. Анилин легко подвергается окислению, темнее при хранении. Если на анилин действовать хлорной известью, то водный раствор анилин окрашивается в интенсивный фиолетовый цвет. Это реакция является качественной.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Применение анилина.
Анилин используют преимущественно для синтеза лекарственных средств и красителей:
💡 Видео
Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Особенности серной и азотной кислот | Химия ЕГЭ, ЦТСкачать

Серная кислота. Химические свойства. Реакции с металлами.Скачать

Взаимодействие цинка с серной кислотойСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Реакция обмена между оксидом меди и серной кислотойСкачать

Реакция цинка с соляной кислотой. Химический опытСкачать

Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Взаимодействие сахара с концентрированной серной кислотойСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

распознавание растворов соляной, азотной и серной кислотСкачать