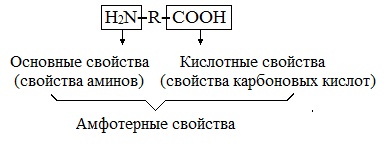
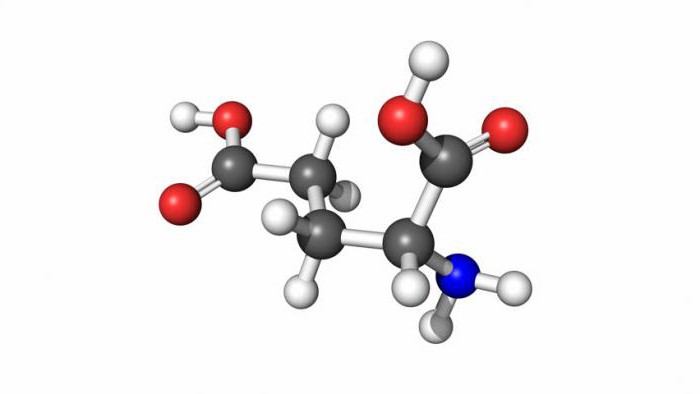
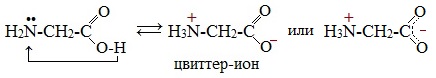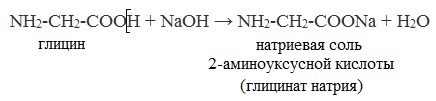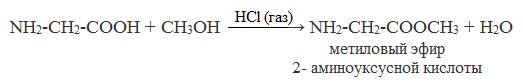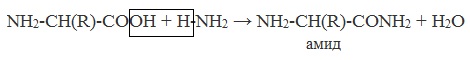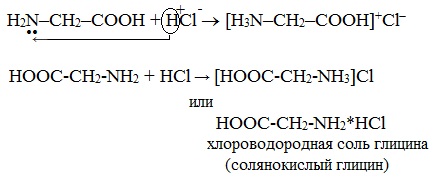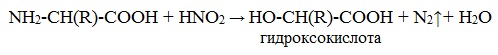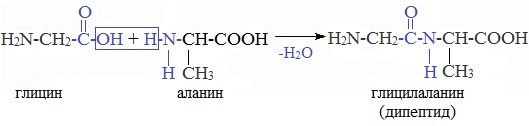Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
- Кислотно-основное равновесие в водных растворах
- 1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- 2. Взаимодействие с основаниями и кислотами
- 3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
- 4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
- 5. Качественные реакции!
- Acetyl
- Аминоуксусная кислота: получение и применение
- Способы получения
- Биологическое значение глицина
- Химические свойства
- Использование в медицине
- Использование в промышленности
- 📽️ Видео
Кислотно-основное равновесие в водных растворах
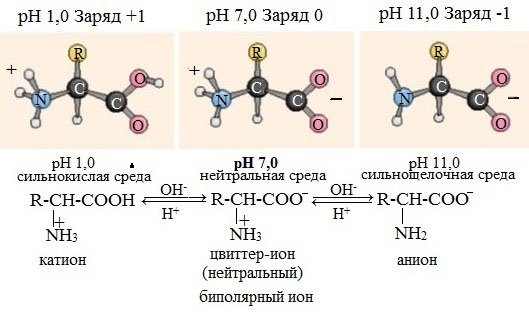
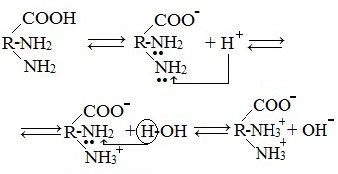
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
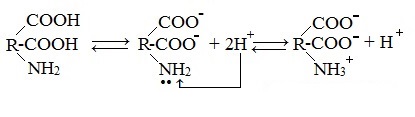
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
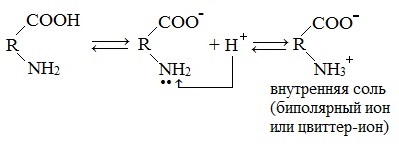
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
2. Взаимодействие с основаниями и кислотами
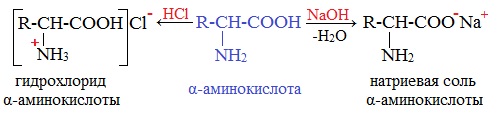
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
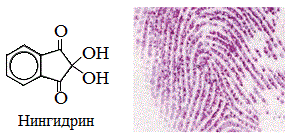
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
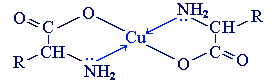
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Видео:Опыты по химии. Аминокислоты: агрегатное состояние; отношение к воде; отношение к индикаторуСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Образование медной соли аминоуксусной кислотыСкачать  Аминоуксусная кислота: получение и применениеАминоуксусная кислота (или глицин) имеет значение для нормальной жизнедеятельности организма человека. Именно поэтому важно рассмотреть подробнее основные физические и химические свойства данного органического вещества, обратить внимание на его использование. Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Способы полученияСначала остановимся на основных способах получения глицина. Аминоуксусная кислота может быть получена двухстадийным синтезом. На первом этапе осуществляется взаимодействие хлоруксусной кислоты с хлором. В качестве основного условия успешного протекания данного химического процесса является использование катализатора. На второй стадии происходит реакция между полученной хлоруксусной кислотой и аммиаком, конечным продуктом будет 2-аминоуксусная кислота. Видео:Кислотно-основные свойства аминокислоты глицина. Химический опытСкачать  Биологическое значение глицинаДанное вещество есть в составе многих биологически активных веществ и белковых молекул. Аминоуксусная кислота является исходным сырьем для синтеза пуриновых оснований и порфиринов. Что такое аминоуксусная кислота? Формула вещества: NH2 —CH2 —COOH, что свидетельствует о наличии амфотерных свойств. Во многих участках спинного и головного мозга есть рецепторы к глицину. По мере связывания с рецепторами, аминоуксусная кислота оказывает «тормозящий» эффект на нейроны. Данное вещество уменьшает процесс выделения импульсов нейронами, которые являются «возбудителями» таких соединений, как глютаминовая кислота. Кроме того, глицин связывается с индивидуальными системами рецепторов, которые стимулируют передачу сигнала от аспартата и нейротрансмиттеров глутамата. В спинном мозге аминоуксусная кислота вызывает торможение нейронов, поэтому применяется в неврологии для снижения повышенного тонуса мышц. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Химические свойстваАминоуксусная кислота реагирует с кислотами, проявляя свои слабые основные свойства. Данная реакция возможна благодаря наличию неспаренной пары электронов на азоте в аминогруппе. Реакция имеет донорно-акцепторный механизм, связана с образованием солей. Кроме того, аминоуксусная кислота легко вступает во взаимодействие со спиртами (этерификацию), образуя при этом сложный эфир. Проводят ее с применением в качестве катализатора концентрированной серной кислоты. Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Использование в медицинеФармакологический препарат аминоуксусной кислоты оказывает успокаивающее (седативное) действие на пациента. Глицин признан мягким транквилизатором, слабым антидепрессантом, позволяющим снижать чувство страха, тревоги, психоэмоционального напряжения. Глицин включен в перечень веществ, позитивно воздействующих на снижение алкогольного отравления. В качестве вспомогательного препарата данное вещество является ноотропным компонентом, способствует улучшению памяти, ассоциативным процессам. Глицин стимулирует обменные процессы, активизирует и нормализует процессы защитного торможения, происходящие в центральной нервной системе. При его употреблении повышается умственная работоспособность, снижается психоэмоциональное напряжение. Благодаря антитоксичному действию, препарат справляется со следующими задачами:
Глицин достаточно быстро попадает во многие биологические жидкости и ткани организма, включая и головной мозг. Данная аминокислота метаболизируется до углекислого газа и воды, она не накапливается в тканях. Анализируемая аминокислота признана регулятором обменных процессов. При систематическом употреблении данного вещества наблюдается адреноблокирующее действие. Часто препарат назначают детям и подросткам с повышенной активностью, выражающейся в отклонениях от нормального поведения. Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать  Использование в промышленностиГлицин в пищевой промышленности представлен в виде добавки Е 640. Он применяется в качестве модификатора аромата и вкуса. 📽️ ВидеоВзаимодействие металлов с кислотами. 8 класс.Скачать  494 Органическая химия Азотсодержащие орнанические соединение Аминокислоты Задача №4Скачать  Реакции ионного обмена. 9 класс.Скачать  Разбор варианта №1 от Широкопояса, БорисоваСкачать  Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать  Реакция получения азотистой кислоты | NaNO2 + HCl → NaCl + HNO2Скачать  ВСЯ ХИМИЯ 11 КЛАСС ЕНТ Аминокислоты / Олеум / Смеси WannaBeTeacher Усенов УланСкачать  Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать  Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать  СОСТАВИТЕЛИ ЕГЭ ПО ХИМИИ ОТВЕЧАЮТ НА ВОПРОСЫСкачать  25. Схема реакции и химическое уравнениеСкачать  АминокислотыСкачать  Аминокислоты. Получение. Все 6 реакций ЕГЭ.Скачать  |