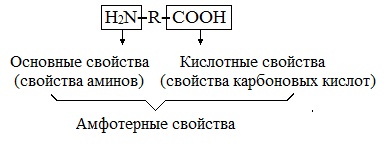
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
- Кислотно-основное равновесие в водных растворах
- 1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- 2. Взаимодействие с основаниями и кислотами
- 3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
- 4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
- 5. Качественные реакции!
- Билет №16. Аминокислоты, их состав и химические свойства: взаимодействие с соляной кислотой, щелочами, друг с другом
- Химические свойства аминокислот взаимодействие с соляной кислотой
- Состав аминокислот
- Получение аминокислот
- Химические свойства аминокислот
- Состав аминокислот
- Получение аминокислот
- Химические свойства аминокислот
- 🔍 Видео
Кислотно-основное равновесие в водных растворах
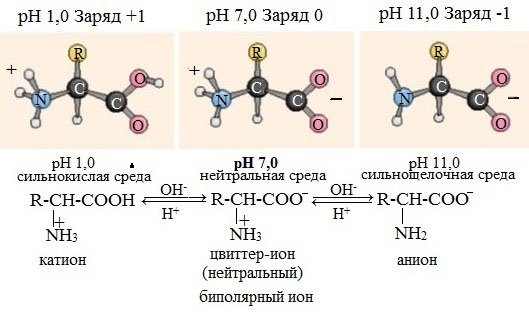
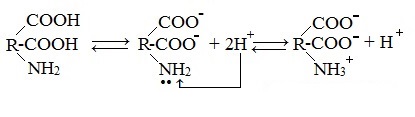
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
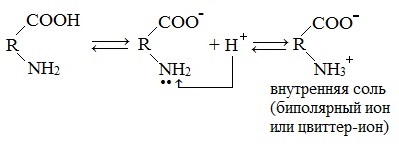
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
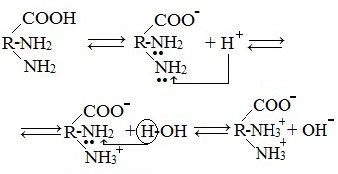
2. Взаимодействие с основаниями и кислотами
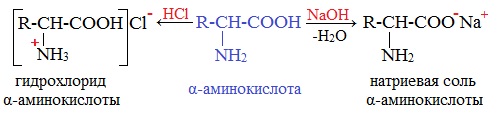
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
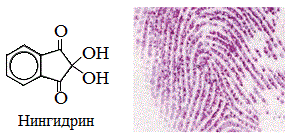
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
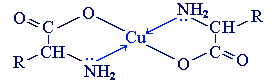
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Билет №16. Аминокислоты, их состав и химические свойства: взаимодействие с соляной кислотой, щелочами, друг с другом
Читайте также:
|
| Видео (кликните для воспроизведения). |
Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других культур, в зеленых частях растений. Не растворимы в воде, растворах солей и этанола, но хорошо растворимы в слабых растворах щелочей. Содержат все незаменимые аминокислоты, являются полноценными продуктами питания.
Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием в этих белках пролина и неполярных аминокислот).
К протеиноидам относятся белки опорных тканей (кость, хрящ, связки, сухожилия, ногти, волосы), для них характерно высокое содержание серы. Эти белки нерастворимы или трудно растворимы в воде, солевых и водно-спиртовых смесях..К протеиноидам относятся кератин, коллаген, фиброин.
Это кислые белки невысокой молекулярной массы (15-17 тыс.), растворимы в воде и слабых солевых растворах. Осаждаются нейтральными солями при 100%-м насыщении. Участвуют в поддержании осмотического давления крови, транспортируют с кровью различные вещества. Содержатся в сыворотке крови, молоке, яичном белке.
Молекулярная масса до 100 тыс. В воде нерастворимы, но растворимы в слабых солевых растворах и осаждаются в менее концентрированных растворах (уже при 50%-м насыщении). Содержатся в семенах растений, особенно в бобовых и масленичных; в плазме крови и в некоторых других биологических жидкостях. Выполняют функцию иммунной защиты, обеспечивают устойчивость организма к вирусным инфекционным заболеваниям.
Видео:Аминокислоты. 1 часть. 11 класс.Скачать

Состав аминокислот
Аминокислоты — это производные углеводородов. В состав аминокислот входят молекулы, у которых есть два вида функциональных групп: карбоксильная группа, имеющая кислотные свойства и аминогруппа, обладающая основными свойствами этого вещества.
Состав аминокислот можно выразить формулой: NH2-R-COOH.
Примерами аминокислот могут быть:
- Аминоуксусная NH2-СH2-COOH
- Аминопропионовая NH2-СH2-СH2-COOH
- Аминокапроновая NH2-(СH2)5-COOH
- Аминоэнантовая NH2-(СH2)6-COOH
- Аминобензойная NH2-С6H4-COOH
Глутаминовая кислта. АминокислотыГлицин. Аминокислоты
Ацетилхолин. АминокислотыДофамин. АминокислотыСератонин. Аминокислоты
В зависимости от расположения этих функциональных групп возникает множество изомеров. Наибольший интерес представляет А-аминокислоты, то есть аминокислоты, в которых карбоксильная группа и аминогруппа находятся рядом. Именно А-аминокислоты входят в состав белков!
Аминокислоты — это твёрдые кристаллические вещества, что объясняется строением их молекул. В состав аминокислот входит внутренняя соль, где соль, надо понимать, как сложное вещество с химической точки зрения!).
Получение аминокислот
Сератонин. Аминокислоты 

Химические свойства аминокислот
Химические свойства аминокислот определяются наличием двух противоположных по свойствам функциональных групп (карбоксильная группа и аминогруппа), входящих в состав аминокислот, что придает им амфотерные свойства (свойства и кислоты, и основания одновременно). Так, аминокислоты вступают в химическую реакцию с основаниями и спиртами, при этом образуются химические соединения, аналогичные продуктам реакции карбоновых кислот со щелочами и спиртами — соли и сложные эфиры.
Как основания, аминокислоты легко взаимодействуют с кислотами, при этом образуются соли.
Химические свойства аминокислот позволяют им взаимодействовать друг с другом, но такое взаимодействие отличается от привычных реакций. В результате химических реакции могут образовываться соединения с большим числом аминокислотных остатков — полипептиды. Группа атомов — CO — NH, входящих в состав аминокислот, называется пептидной группой, а связь между атомами азота и углерода — пептидная связь или амидная связь. Благодаря этим связям остатки аминокислот соединяются молекулах белков и некоторых волокон (например, в капроне)
Аминокислоты как «кирпичики», из которых построены белки, применяются в медицине: их прописывают больным и сильно и сильно ослабленным после тяжёлых операций и лечения, при заболеваниях желудочного тракта, а также нервных заболеваний. Аминокислоты используют в сельском хозяйстве в качестве добавки к корму животных.
Аминопропионовая кислота — образуется при гидролизе натурального шёлка. А вот её остаток содержится почти во всех белках!
Видео:Взаимодействие цинка с соляной кислотой I ЕГЭ по химииСкачать

Состав аминокислот
Аминокислоты — это производные углеводородов. В состав аминокислот входят молекулы, у которых есть два вида функциональных групп: карбоксильная группа, имеющая кислотные свойства и аминогруппа, обладающая основными свойствами этого вещества.
Состав аминокислот можно выразить формулой: NH2-R-COOH.
Примерами аминокислот могут быть:
- Аминоуксусная NH2-СH2-COOH
- Аминопропионовая NH2-СH2-СH2-COOH
- Аминокапроновая NH2-(СH2)5-COOH
- Аминоэнантовая NH2-(СH2)6-COOH
- Аминобензойная NH2-С6H4-COOH
Глутаминовая кислта. АминокислотыГлицин. Аминокислоты
Ацетилхолин. АминокислотыДофамин. АминокислотыСератонин. Аминокислоты
В зависимости от расположения этих функциональных групп возникает множество изомеров. Наибольший интерес представляет А-аминокислоты, то есть аминокислоты, в которых карбоксильная группа и аминогруппа находятся рядом. Именно А-аминокислоты входят в состав белков!
Аминокислоты — это твёрдые кристаллические вещества, что объясняется строением их молекул. В состав аминокислот входит внутренняя соль, где соль, надо понимать, как сложное вещество с химической точки зрения!).
Получение аминокислот
Сератонин. Аминокислоты 

Химические свойства аминокислот
Химические свойства аминокислот определяются наличием двух противоположных по свойствам функциональных групп (карбоксильная группа и аминогруппа), входящих в состав аминокислот, что придает им амфотерные свойства (свойства и кислоты, и основания одновременно). Так, аминокислоты вступают в химическую реакцию с основаниями и спиртами, при этом образуются химические соединения, аналогичные продуктам реакции карбоновых кислот со щелочами и спиртами — соли и сложные эфиры.
Как основания, аминокислоты легко взаимодействуют с кислотами, при этом образуются соли.
Химические свойства аминокислот позволяют им взаимодействовать друг с другом, но такое взаимодействие отличается от привычных реакций. В результате химических реакции могут образовываться соединения с большим числом аминокислотных остатков — полипептиды. Группа атомов — CO — NH, входящих в состав аминокислот, называется пептидной группой, а связь между атомами азота и углерода — пептидная связь или амидная связь. Благодаря этим связям остатки аминокислот соединяются молекулах белков и некоторых волокон (например, в капроне)
Аминокислоты как «кирпичики», из которых построены белки, применяются в медицине: их прописывают больным и сильно и сильно ослабленным после тяжёлых операций и лечения, при заболеваниях желудочного тракта, а также нервных заболеваний. Аминокислоты используют в сельском хозяйстве в качестве добавки к корму животных.
Аминопропионовая кислота — образуется при гидролизе натурального шёлка. А вот её остаток содержится почти во всех белках!
🔍 Видео
ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Реакция цинка с соляной кислотой. Химический опытСкачать

Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать

Аминокислоты. Получение. Все 6 реакций ЕГЭ.Скачать

Аминокислоты. Реакции декарбоксилирования. БиохимияСкачать

Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать

108. Химические свойства аминокислотСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Реакция карбоната кальция и соляной кислотыСкачать

В 50 РАЗ ДЕШЕВЛЕ АМ-КОНЦЕНТРАТ СВОИМИ РУКАМИ. Аминокислотный витаминный комплекс - домашний рецепт.Скачать

Кислотно-щелочной баланс. Правда и мифы о закислении организма.Скачать

Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать

АМИНОКИСЛОТЫ. ГОТОВИМСЯ К МИКРОКОНТРОЛЮСкачать

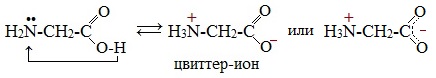
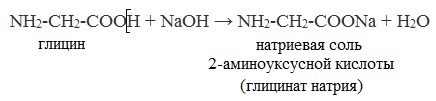
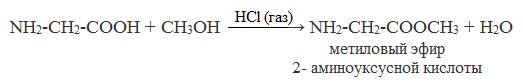
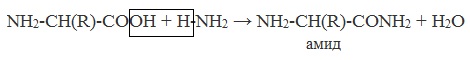
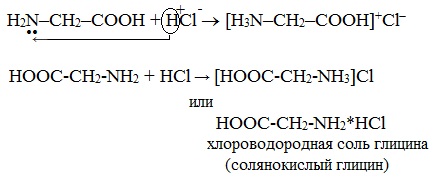
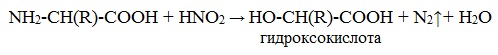

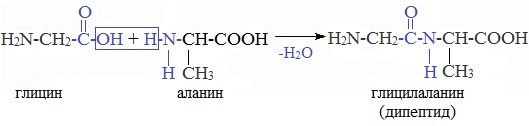


 + Н3N-СН2—СОO — .
+ Н3N-СН2—СОO — . H2N-CH(R)-COOR’ + Н2О.
H2N-CH(R)-COOR’ + Н2О.










