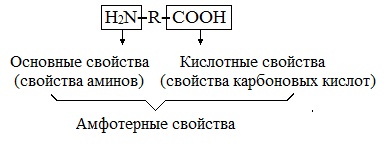
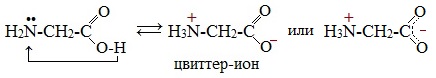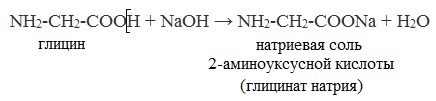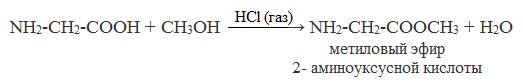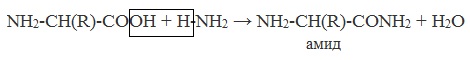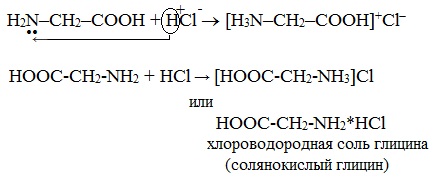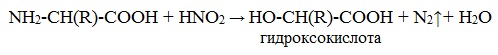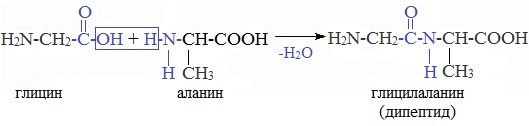Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
- Кислотно-основное равновесие в водных растворах
- 1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- 2. Взаимодействие с основаниями и кислотами
- 3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
- 4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
- 5. Качественные реакции!
- Химические свойства аминокислот: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации).
- Белки и аминокислоты
- 🎦 Видео
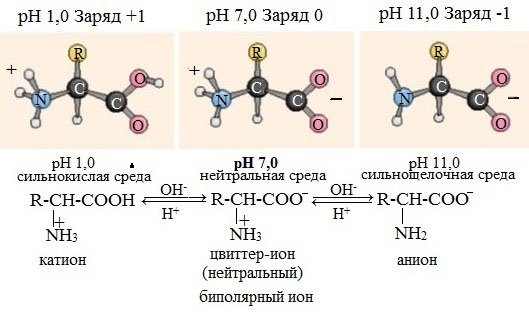
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
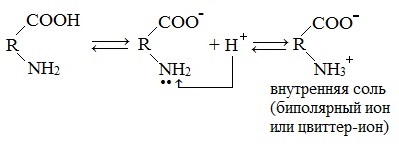
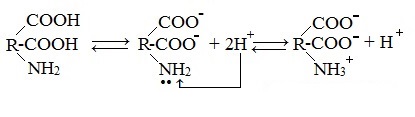
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
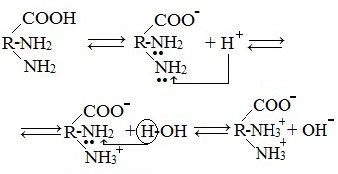
2. Взаимодействие с основаниями и кислотами
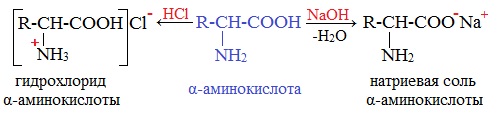
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
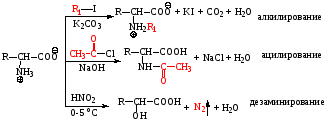
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
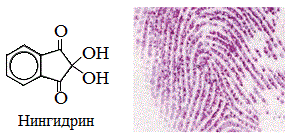
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
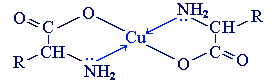
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Видео:#2.Правило определения взаимодействия веществ друг с другом.Правило Бертолле. Реакции ионного обменаСкачать

Химические свойства аминокислот: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации).
1) Образование солей это амфотерные соединения, поэтому они способны образовывать соли как с кислотами, так и с основаниями.-. Аминокислоты
-Аминокислоты способны также образовывать устойчивые комплексные соли с ионами некоторых двухвалентных металлов: Cua 2+ , Ni 2+ , Zn 2+ , Co 2+ . С ионами Cu 2+ получаются кристаллические хелатные соли синего цвета, которые используются для выявления, выделения и очистки аминокислот (качественная реакция).
2) Реакции по карбоксильной группе
3) Реакции по аминогруппе
4) Реакции аминокислот под действием ферментов
5. Аминокислоты взаимодействуют друг с другом
-СО–NH – пептидная группа (амидная группа)
Пептидная связь и полипептиды.
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей.Карбоксильная группа одной аминокислоты ковалентно связывается с аминогруппой другой аминокислоты. При этом возникает R-CO-NH-R связь, называемая пептидной связью. При этом происходит отщепление молекулы воды .

Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве. Пептидные связи очень прочны и являются ковалентными.
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью. Такими являются целый ряд гормонов – окситоцин (9 аминокислотных остатков), вазопрессин (9), брадикинин (9) регулирующий тонус сосудов, тиреолиберин (3), антибиотики – грамицидин, пептиды, обладающие обезболивающим действием (энкефалины(5) и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
Видео:Аминокислоты. Получение. Все 6 реакций ЕГЭ.Скачать

Белки и аминокислоты
Белки (син. протеины) — высокомолекулярные органические вещества, построенные из остатков аминокислот. По своему биологическому значению принадлежат к числу важнейших составных частей организма.
Несомненно, белки абсолютно необходимы для жизни растений, животных и грибов. Именно вследствие такого большого значения белки получили названия протеинов (греч. protos — первый, главный).
Качественной реакцией на белки служит ксантопротеиновая реакция. Ее проводят путем добавления к раствору белка HNO3(конц.) до тех пор, пока не прекратится выпадение осадка. Осадок окрашивается в характерный желтый цвет.
Аминокислота
Аминокислота — органическая кислота, содержащая, по меньшей мере, одну карбоксильную группу (COOH) и одну аминогруппу (NH2). Аминокислоты являются основной составляющей всех белков.
В построении белков участвуют 20 наиболее распространенных аминокислот. На данном этапе учить их наизусть не обязательно, эта задача настигнет вас на кафедре биохимии 😉
И все же для успешного изучения данной темы мы возьмем за основу две аминокислоты: глицин и аланин.
Я хочу вас обрадовать (надеюсь, что обрадую)). Если вы успешно изучили темы: карбоновые кислоты, амины — то вы уже знаете химические свойства аминокислот!
Они напоминают амфотерные соединения: по аминогруппе вступают в реакции с кислотами, по карбоксильной — с основаниями. Мы разберем их подробнее чуть ниже.
Получение аминокислот
Аминокислоты можно получить в реакции аммиака с галогенкарбоновыми кислотами.
Химические свойства аминокислот
- Основные свойства
За счет наличия аминогруппы, аминокислоты проявляют основные свойства. Реагируют с кислотами.
По карбоксильной группе аминокислоты способны вступать в реакции с металлами, основными оксидами, основаниями и солями более слабых кислот.
Аминокислоты способны вступать в реакцию этерификации, образуя сложные эфиры.
В молекуле белка аминокислоты связаны друг с другом пептидной связью. Она образуется между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
🎦 Видео
Аминокислоты. 1 часть. 11 класс.Скачать

Реакции на аминогруппуСкачать

Биохимия. Качественные реакции для определения белков, аминокислот и углеводов (С. Смирнов)Скачать

Химия 10 класс (Урок№12 - Аминокислоты. Белки.)Скачать

Опыты по химии. Аминокислоты: агрегатное состояние; отношение к воде; отношение к индикаторуСкачать

Аминокислоты. Реакции декарбоксилирования. БиохимияСкачать

62. Аминокислоты (часть 2)Скачать

Аминокислоты и белки | ЕГЭ по химии 2023Скачать

АминокислотыСкачать

Аминокислоты | Химия 10 класс | УмскулСкачать

Аминокислоты | ЕГЭ | BioFamilyСкачать

Аминокислоты | Химия ЕГЭ 10 класс | УмскулСкачать

10 класс Химические свойства аминокислотСкачать

Химии. Аминокислоты и белкиСкачать

Лекция получение аминокислот (ур.10 кл)Скачать

61. Аминокислоты (часть 1)Скачать

Все об азотсодержащих соединениях | Химия ЕГЭ 2023 | УмскулСкачать

108. Химические свойства аминокислотСкачать