Химические свойства самого распространенного металла
Алюминий — активный металл. Он устойчив на воздухе, при нормальной температуре быстро окисляется, покрываясь плотной пленкой оксида, которая защищает металл от дальнейшего разрушения.
- Взаимодействие алюминия с другими веществами
- Взаимодействие с неметаллами
- Взаимодействие алюминия с водородом
- Алюминий и его водородная пористость
- Гидрид алюминия
- Содержание
- Молекулярная структура
- Физические свойства
- Химические свойства
- Получение
- Применение
- Алюминий. Химия алюминия и его соединений
- Алюминий
- Положение в периодической системе химических элементов
- Электронное строение алюминия и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- 🔍 Видео
Видео:Взаимодействие алюминия со щёлочью и водойСкачать

Взаимодействие алюминия с другими веществами
При обычных условиях не взаимодействует с водой даже в состоянии кипения. При удалении защитной оксидной пленки алюминий вступает в энергичное взаимодействие с водяным паром воздуха, превращаясь в рыхлую массу гидроксида алюминия с выделением водорода и тепла. Уравнение реакции:
2Al + 6H₂O = 2Al(OH)₃ + 3H₂
Если снять защитную оксидную пленку с алюминия, то металл вступает в активное взаимодействие с кислородом. При этом порошок алюминия сгорает, образуя оксид. Уравнение реакции:
Этот металл также активно взаимодействует со многими кислотами. При реакции с соляной кислотой наблюдается выделение водорода:
2Al + 6HCl = 2AlCl₃ + 3H₂
При обычных условиях концентрированная азотная кислота не взаимодействует с алюминием, так как будучи сильным окислителем, она делает оксидную пленку еще крепче. По этой причине азотная кислота хранится и перевозится в алюминиевой посуде.
Алюминий при обычной температуре пассивируется разбавленной азотной и концентрированной серной кислотами. В горячей серной кислоте металл растворяется:
2Al + 4H₂SO4 = Al₂(SO4)₃ + S + 4H₂O
Видео:Получение чистого водорода путем химической реакции алюминия со щелочамиСкачать

Взаимодействие с неметаллами
Алюминий реагирует с галогенами, серой, азотом, углеродом и всеми неметаллами. Для протекания реакции необходимо нагревание, после чего взаимодействие происходит с выделением большого количества тепла.
Видео:Взаимодействие алюминия с водойСкачать

Взаимодействие алюминия с водородом
Алюминий непосредственно с водородом не реагирует, хотя известно твердое полимерное соединение алан, в котором существуют так называемые трехцентровые связи. При температуре выше 100 градусов Цельсия алан необратимо разлагается на простые вещества. Гидрид алюминия бурно реагирует с водой.
Алюминий напрямую не реагирует с водородом: металл образует соединения путем потери электронов, которые принимаются другими элементами. Атомы водорода не принимают электроны, которые отдают металлы для образования соединений. «Принуждать» атомы водорода принять электроны с образованием твердых ионных соединений (гидридов) могут только очень реактивные металлы (калий, натрий, магний, кальций). Для прямого синтеза гидрида алюминия из водорода и алюминия требуется огромное давление (около 2 миллиардов атмосфер) и температура выше 800 К. Здесь вы сможете узнать о химических свойствах других металлов.
Следует отметить, что водород — это единственный газ, заметно растворяющийся в алюминии и его сплавах. Растворимость водорода изменяется пропорционально температуре и квадратному корню из давления. Растворимость водорода в жидком алюминии значительно выше, чем в твердом. Это свойство незначительно изменяется в зависимости от химического состава сплавов.
Видео:Химическая реакция йода и алюминия.Скачать

Алюминий и его водородная пористость
Образование в алюминии пузырей водорода непосредственно зависит от скорости охлаждения и затвердевания, а также от наличия центров зарождения для выделения водорода — захваченных внутрь расплава оксидов. Для образования пористости алюминия необходимо значительное превышение содержания растворенного водорода по сравнению с растворимостью водорода в твердом алюминии. При отсутствии центров зарождения для выделения водорода требуется относительно высокая концентрация вещества.
Расположение водорода в затвердевшем алюминии зависит от уровня его содержания в жидком алюминии и условий, при которых происходило затвердевание. Так как водородная пористость — это результат механизмов зарождения и роста, контролируемых диффузией, то такие процессы, как снижение концентрации водорода и увеличение скорости затвердевания, подавляют зарождение и рост пор. Из-за этого выполненные методом литья в разъемный кокиль отливки металла более подвержены дефектам, связанным с водородом, чем отливки, изготовленные методом литья под давлением.
Есть разные источники попадания водорода в алюминий.
Шихтовые материалы (лом, слитки, литейный возврат, оксиды, песок и смазки, применяющиеся при механической обработке). Эти загрязнители — потенциальные источники водорода, образовавшегося при химическом разложении паров воды или восстановлении органических веществ.
Плавильные инструменты. Скребки, пики, лопаты являются источником водорода. Оксиды и остатки флюсов на инструментах впитывают влагу из окружающего воздуха. Печные огнеупоры, распределительные каналы, ковши для отбора проб, известковые желоба и цементные растворы — потенциальные источники водорода.
Атмосфера печи. Если плавильная печь работает на мазуте или на природном газе, возможно неполное сгорание топлива с образованием свободного водорода.
Флюсы (гигроскопичные соли, готовые мгновенно впитывать воду). По этой причине влажный флюс неизбежно вносит в расплав водород, образовавшийся при химическом разложении воды.
Литейные формы. В процессе заполнения литейной формы жидкий алюминий течет турбулентно и захватывает воздух во внутренний объем. Если воздух не успеет выйти из формы до начала затвердевания алюминия, то водовод проникнет в металл.
Видео:Водород/химические свойства водорода/8 классСкачать

Гидрид алюминия
| Гидрид алюминия | |
|---|---|
 | |
| Систематическое наименование | Гидрид алюминия |
| Традиционные названия | Гидрид алюминия, гидрид алюминия III, алан |
| Хим. формула | (AlH3)n |
| Рац. формула | AlH3 |
| Состояние | твёрдое |
| Молярная масса | 30,005 г/моль |
| Плотность | 1,45 |
| Температура | |
| • разложения | 105 |
| Энтальпия | |
| • образования | − 12 кДж/моль |
| Рег. номер CAS | 7784-21-6 |
| PubChem | 14488 |
| Рег. номер EINECS | 232-053-2 |
| SMILES | |
| ChEBI | 30136 |
| ChemSpider | 13833 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
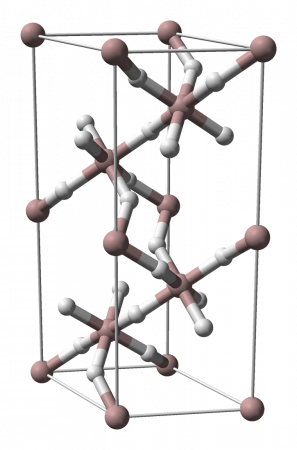
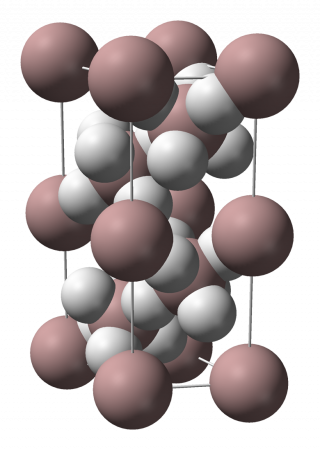
Гидрид алюминия — AlH3, неорганическое бинарное соединение алюминия с водородом. В нормальных условиях — бесцветное или белое твёрдое вещество, имеющее полимерную структуру: (AlH3)n.
Впервые был получен в 1942 году действием тлеющего электрического разряда на смесь триметилалюминия и водорода.
Используется как компонент ракетного топлива, мощный восстановитель в органическом синтезе и в качестве катализатора для реакций полимеризации.
Видео:Активный алюминий 🧪 Реакция алюминия с водой ⚗️ Опыты по химииСкачать

Содержание
- 1 Молекулярная структура
- 2 Физические свойства
- 3 Химические свойства
- 4 Получение
- 5 Применение
Видео:Взаимодействие алюминия с водойСкачать

Молекулярная структура
В обычных условиях гидрид алюминия имеет полимерную молекулярную структуру (AlH3)n, при этом его кристаллическая форма существует в семи полиморфных модификациях: α-(AlH3)n, α 1 -(AlH3)n, β-(AlH3)n, δ-(AlH3)n, ε-(AlH3)n, γ-(AlH3)n, ζ-(AlH3)n.
Самой устойчивой является модификация α-(AlH3)n, имеющая гексагональную сингонию (пространственная группа R3c, а = 4,449 Å, b = 4,449 Å, c = 11,804 Å). Длина связи Al—H составляет 1,72 Å, длина связи Al—Al: 3,24 Å. Структура α-(AlH3)n представляет собой совокупность октаэдров АlН6, объединенных шестью трехцентровыми двухэлектронными связями Аl—Н—Аl в кристаллический каркас.
Модификация γ-(AlH3)n существует в ромбической сингонии, пространственная группа Pnnm (а = 5,3806 Å, b = 7,3555 Å, c = 5,77509 Å). Ячейка кристаллической решётки гидрида состоит из двух октаэдров AlH6, длина связи Al—Al составляет 2,606 Å. Особенностью структуры является наличие разветвлённой двойной мостиковой связи Al—2H—Al (длина связи Al—H: 1,68—1,70 Å) в дополнение к обычной связи Al—H—Al (длина связи Al—H: 1,77—1,78 Å). Из-за наличия больших полостей в кристаллической структуре γ-(AlH3)n, данная модификация имеет плотность примерно на 11 % меньше, чем α-(AlH3)n.
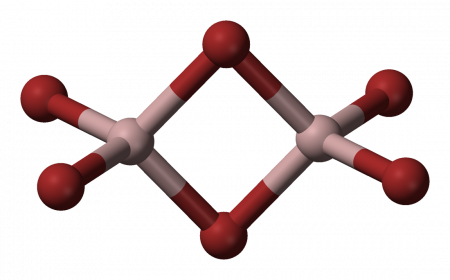
При взаимодействии распылённых лазером атомов алюминия с водородом при сверхнизких температурах (3,5 K) с последующим ультрафиолетовым излучением и нормализацией при 6,5 K, в продуктах фотолиза можно обнаружить структуры димера Al2H6, аналогичные структуре диборана B2H6. Димер (см. структуру на рисунке) очень неустойчив в конденсированном состоянии, поэтому его существование обнаружилось лишь спустя примерно пятьдесят лет после открытия гидрида алюминия.
В 2007 году группа учёных из США воздействовала на алюминий плазменным потоком атомов водорода и обнаружила, что в результате образуются различные анионные полиядерные гидриды алюминия, среди которых особый интерес вызвал анион Al4H6 − , чей нейтральный гибрид Al4H6 по расчётам должен отличаться заметной стабильностью. Структурно соединение должно представлять искажённый тетраэдр с вершинами — атомами алюминия, в котором атомы водорода образуют четыре терминальные связи Al–H и две мостиковые связи Al–H–Al. Большой энергетический порог между высшими занятыми и низшими свободными молекулярными орбиталями в сочетании с исключительно высоким значением теплоты сгорания позволяют предположить, что этот гидрид алюминия может представлять собой перспективный материал для ракетного топлива.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Физические свойства
Гидрид алюминия представляет собой твёрдое белое или бесцветное вещество. Плотность 1,45 (по другим данным 1,47) г/см³. Растворим в тетрагидрофуране (5 г в 100 г растворителя при 19,5 °C).
- стандартная энтальпия образования, ΔH o 298: −12 кДж/моль (по другим данным: −11,43±0,84 кДж/моль);
- стандартная энтропия, S o 298: 30 Дж/(моль·K) (по другим данным: 30,06±0,42 Дж/(моль·K));
- стандартная энергия Гиббса, ΔG o 298: 46 кДж/моль (по другим данным: 46,52±0,96 кДж/моль).
Большое содержание водорода в гидриде алюминия обуславливает ряд его свойств, связанных с проблемой высокотемпературной сверхпроводимости: в области давлений
60 ГПа и температуре
1000 K он обладает полупроводниковым механизмом проводимости, а в области высоких давлений и температур (до 90 ГПа и 2000 K) его проводимость сопоставима с металлической электропроводностью водорода.
Видео:Реакции с алюминиемСкачать

Химические свойства
- Соединение нестабильно: при нагревании выше 100 °C разлагается:
2 AlH3 → to 2 Al + 3 H2
- Бурно взаимодействует с водой:
AlH3 + 3 H2O → Al(OH)3 + 3 H2 ↑
- С диэтиловым эфиром образует высокореакционный, но относительно стабильный комплекс переменного состава, который часто используется для синтетических целей:
AlH3 + n(C2H5)2O → AlH3 ⋅ n(C2H5)2O Аналогичный комплекс образуется с другими низшими алифатическими эфирами, а также с триметиламином: AlH3 • N(CH3)3. Последний взаимодействует с водой со взрывом. Для стабилизации гидрида алюминия также можно использовать комплексы с другими аминами, например с N-метилпирролидином (NMP): AlH3 • NMP и AlH3 • (NMP)2.
- Гидрид алюминия — очень сильный восстановитель. Он способен восстановить углекислый газ до метана:
4 AlH3 + 3 CO2 → to 3 CH4 + 2 Al2O3 Известны многочисленные реакции восстановления органических соединений с использованием гидрида алюминия.
- Взаимодействует с гидридом лития, образуя алюмогидрид:
AlH3 + LiH → (C2H5)2O LiAlH4 Медленно вступает в реакцию с дибораном, образуя борогидрид алюминия (точнее тетрагидридоборат алюминия): 2 AlH3 + B2H6 → 2 Al(BH4)3
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение
Используемый сегодня принципиальный метод получения чистого гидрида алюминия из гидрида лития в среде диэтилового эфира был предложен ещё в 1947 году:
Хлорид лития выпадает в осадок до момента полимеризации AlH3 и отделяется от эфирного раствора, из которого путём дальнейшей отгонки эфира получают комплекс гидрида алюминия с диэтиловым эфиром.
Также гидрид алюминия по аналогии можно получить реакцией алюмогидрида лития с серной кислотой, хлоридом бериллия, хлоридом цинка, хлороводородом и алкилгалогенидами:
2 LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2 LiAlH4 + HCl → AlH3 + LiCl + H2 2 LiAlH4 + BeCl2 → 2 AlH3 + 2 LiCl + BeH2 2 LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2 LiAlH4 + R−CH2−Cl → AlH3 + LiCl + R−CH3
Вместо алюмогидрида лития можно использовать алюмогидрид натрия:
Для получения чистого гидрида (без примесей растворителя) эфирный комплекс подвергают нагреванию в вакууме с добавлением бензола или в присутствии небольших количеств LiAlH4 или смеси LiAlH4+LiBH4. При этом сперва получаются β-AlH3 и γ-AlH3 модификации, которые затем переходят в более стабильный α-AlH3.
Другим способом получения несольватированного эфиром гидрида алюминия, является электролиз алюмогидрида натрия в среде тетрагидрофурана.
Среди прочих методов отметим синтез с использованием гидрида магния:
Долгое время считалось, что гидрид алюминия невозможно получить прямым взаимодействием элементов, поэтому для его синтеза использовали приведённые выше косвенные методы. Однако, в 1992 году группа российских учёных осуществила прямой синтез гидрида из водорода и алюминия, используя высокое давление (выше 2 ГПа) и температуру (более 800 K). Вследствие очень жёстких условий протекания реакции, в настоящий момент метод имеет лишь теоретическое значение.
Видео:ВОДОРОД ПО ТРЕБОВАНИЮ. УПРАВЛЯЕМАЯ РЕАКЦИЯСкачать

Применение
Гидрид алюминия находит широкое применение в органическом синтезе в качестве сильнейшего восстанавливающего агента.
В связи с тем, что гидрид алюминия представляет собой соединение с высоким содержанием водорода (10,1 %), он используется в производстве ракетных топлив и некоторых взрывчатых веществ, а также для систем хранения и генерации в автономных энергетических водородных установках.
Видео:Решаем два варианта Добротина за 2 часаСкачать

Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
🔍 Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Галилео. Эксперимент. Растворяем алюминийСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

8 класс. Составление уравнений химических реакций.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Водород и кислород. 1 часть. 8 класс.Скачать

ТЕБЯ СПАСЕТ РЯД АКТИВНОСТИ МЕТАЛЛОВ. Ме + вода = ? #химия #школа #химияогэ #огэпохимии #химияегэСкачать