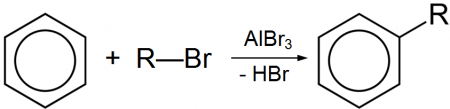Бром в обычных условиях — тяжелая красно-бурая жидкость. Бром — единственный жидкий неметалл. Бром ядовит, имеет резкий, неприятный, удушливый запах. Бром по свойствам сходен с хлором, но менее активен. легко испаряется, образуя бурые пары. В круглодонную колбу нальем немного брома. Опустим в колбу кусочек алюминиевой фольги. Закроем колбу пробкой с хлоркальциевой трубкой, в которую насыпан активированный уголь. Уголь служит для поглощения паров брома. Через некоторое время алюминий раскаляется и энергично сгорает с образованием бромида алюминия.
Оборудование: колба круглодонная, хлоркальциевая трубка с адсорбентом ( активированный уголь), пробка, штатив.
Техника безопасности. Соблюдать правила работы с жидким бромом. Использовать резиновые перчатки при переливании брома. Переливание брома проводить только под тягой.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Видео:Взаимодействие брома с алюминиемСкачать

Уравнение реакции аллюминий и бром
Курс общей и неорганической химии
(для студентов биологического факультета (биофизиков)
и для студентов факультета биоинженерии и биоинформатики)
Программа курса. Материалы лекций. Презентации лекций. Программа сетевых контрольных мероприятий
Лектор — Загорский Вячеслав Викторович — ст.н.сотр., к.х.н., д.п.н.
Видео:Опыты по химии. Взаимодействие брома с алюминиемСкачать

Реакция алюминия с бромом
Посмотреть видео:
Алюминиевые стружки начинают реагировать с бромом через десятки секунд после соприкосновения веществ. Реакция идет бурно.
К жидкому брому в пробирке присыпают алюминиевые стружки. Через некоторое время начинается экзотермическая реакция — горение алюминия в броме.
Автор и оператор
Загорский В.В.
Ассистент
Петрова Е.П.
Подготовка публикации
Мочалыгин А.Г.
Редактирование
Миняйлов В.В.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Реакция алюминия с бромомСкачать

Бромид алюминия
| Бромид алюминия | |||
|---|---|---|---|
| |||
| Систематическое наименование | Бромид алюминия | ||
| Хим. формула | AlBr3, Al2Br6 | ||
| Рац. формула | AlBr3 | ||
| Состояние | твёрдое | ||
| Молярная масса | 266,69 г/моль | ||
| Плотность | 3,205 | ||
| Температура | |||
| • плавления | 97,5 | ||
| • кипения | 255 °C | ||
| Энтальпия | |||
| • образования | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) кДж/моль | ||
| Кристаллическая структура | моноклинная | ||
| Рег. номер CAS | 7727-15-3 | ||
| PubChem | 24409 | ||
| Рег. номер EINECS | 231-779-7 | ||
| SMILES | |||
| RTECS | BD0350000 | ||
| Номер ООН | 1725 | ||
| ChemSpider | 22818 | ||
| Пиктограммы ECB |    | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромид алюминия (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула Al +3 Br 3 −1 . Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.
Видео:Бром - страшный! [NileRed]Скачать
![Бром - страшный! [NileRed]](https://i.ytimg.com/vi/608ndPt7R68/0.jpg)
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 5 Опасность для здоровья
Видео:Химическая реакция йода и алюминия.Скачать

Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
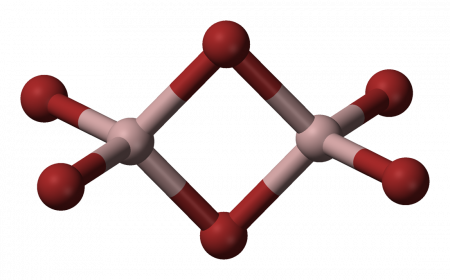
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
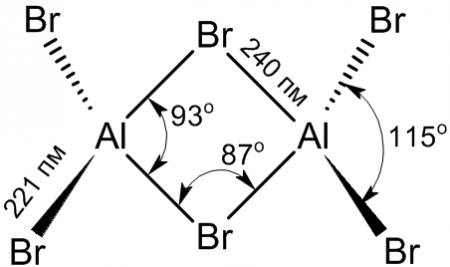
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома.
Координационное число алюминия в молекуле бромида равно 4.
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль.
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор).
Видео:Реакция алюминия с бромомСкачать

Химические свойства
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
AlBr3 + 4 H2O ⇆ [Al(H2O)4] 3+ + 3Br − [Al(H2O)4] 3+ + H2O ⇆ [Al(H2O)3(OH)] 2+ + H3O + При нагревании водного раствора гидролиз можно провести полностью: AlBr3 + 3 H2O = Al(OH)3 ↓ + 3 HBr ↑
- Вступает в реакцию со щелочами:
AlBr3 + 3 NaOH = Al(OH)3 ↓ + 3 NaBr AlBr3 + 4 NaOH = Na[Al(OH)4] + 3 NaBr
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения:
AlBr3 + H2S = AlBr3 ⋅ H2S
- При высокой температуре разлагается:
2 AlBr3 = 2 Al + 3 Br2 При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия: AlBr3 + 2 Al ⇆ 3 AlBr
- С гидридом лития образует алюмогидрид:
AlBr3 + 4 LiH = Li[AlH4] + 3 LiBr
- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы-доноры (на этом, в частности, основано его применение в органическом синтезе):
AlBr3 + C2H5Br → [C2H5] + [AlBr4] −
Видео:Бром - ЕДИНСТВЕННЫЙ ЖИДКИЙ НЕМЕТАЛЛ!Скачать

Получение
Безводный бромид алюминия получают взаимодействием простых веществ (Al и Br2):
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
2 Al + 6 HBr = 2 AlBr3 + 3 H2 ↑
Видео:Реакция алюминия с бромомСкачать

Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий.
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов, например:
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом:
Видео:Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД 50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно).
🎬 Видео
Чеченский отряд и диверсия на территории России | НОВОСТИСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Реакция брома с алюминиемСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакция алюминия с жидким бромомСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ ДЛЯ ДОМА!Скачать

Бурная реакция алюминия с бромомСкачать

Уравнивание реакций горения углеводородовСкачать

Урок химии в 9 классе. Что будет, если смешать алюминий и бром?Скачать

Реакция брома и алюминия. Замедленная съёмкаСкачать