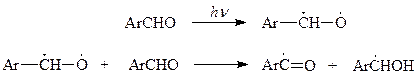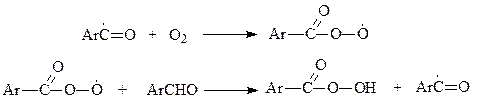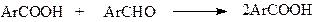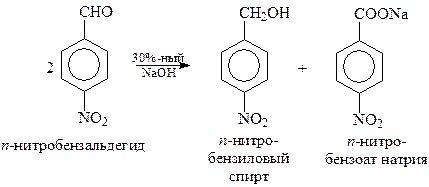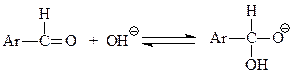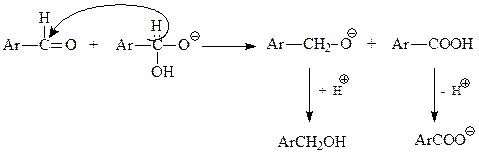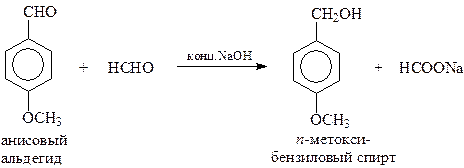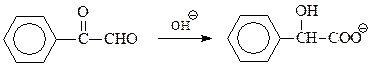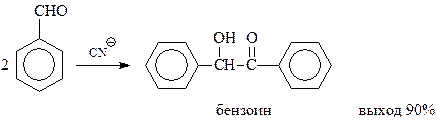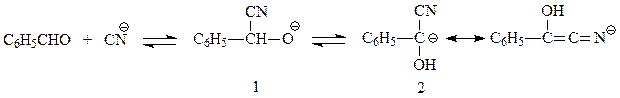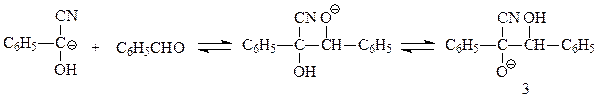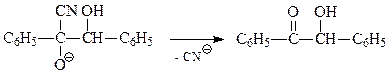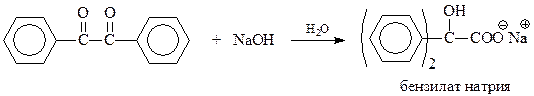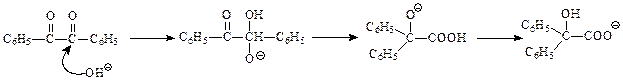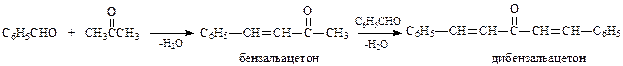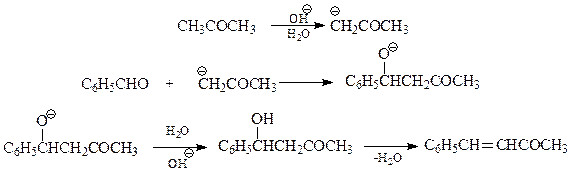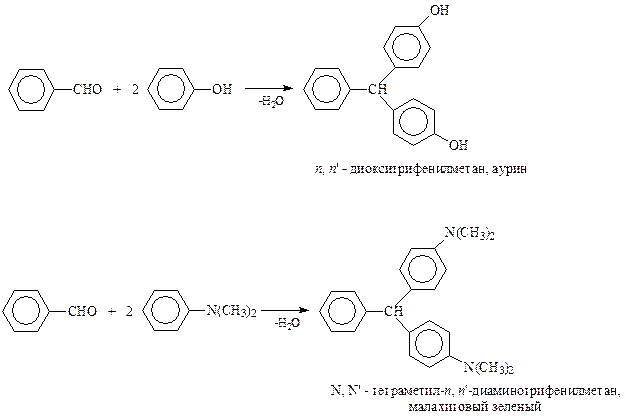Молекулы ароматических альдегидов состоят из бензольного кольца и альдегидной группы. Нетрудно предвидеть, что характерными для подобных соединений будут реакции электрофильного замещения с участием ароматического кольца (альдегидная группа – м-ориентант) и нуклеофильного присоединения по карбонильной группе альдегида. Поскольку указанные реакции рассматривались раньше, ограничимся изучением лишь тех превращений ароматических альдегидов, которые относятся к специфическим, присущим только им.
15.1.2.1. Автоокисление.Как известно, альдегидная группа легко окисляется в карбоксильную группу. В данном случае речь идет о самопроизвольном протекании этого процесса при контакте альдегида с кислородом воздуха, особенно под воздействием света и железа. Налитый тонким слоем бензальдегид при контакте с воздухом уже через несколько часов окисляется в кристаллическую бензойную кислоту.
Установлено, что самоокисление ароматических альдегидов протекает по цепному радикальному механизму. На начальных стадиях процесса – стадии инициирования цепи образуется бензоильный радикал
При развитии цепи образуется перекисный радикал и гидроперекись
Реакция гидроперекиси с альдегидом приводит к кислоте
В пользу приведенного механизма говорит факт присутствия в окисленном бензальдегиде гидроперекиси. Кроме того, известно, что автоокисление предотвращается ингибиторами.
15.1.2.2. Конденсации. При рассмотрении алифатических альдегидов было установлено, что альдегидная группа обуславливает способность соединений этого класса к различным реакциям конденсации: альдольной, кротоновой и др. Оказалось, что отдельные реакции конденсации альдегидов вполне могут быть сведены к реакциям нуклеофильного присоединения по поляризованной карбонильной группе. В реакциях конденсации одна молекула альдегида образует нуклеофильную частицу, а другая молекула альдегида присоединяет этот нуклеофил.
Ароматические альдегиды также вступают в различные реакции конденсации. Своеобразие реакций конденсации с участием ароматических альдегидов заключается в том, что они не могут иметь α-водородных атомов.
Реакция Канницаро. Ароматические альдегиды в присутствии концентрированного водного раствора щелочи вступают в реакцию Канницаро – самоокисления-восстановления с образованием молекулы спирта и карбоновой кислоты
На основе данных кинетических исследований и опытов с мечеными соединениями для реакции Канницаро предложен следующий механизм.
В начальной стадии имеет место нуклеофильное присоединение гидроксила к карбонилу
Образовавшаяся частица поставляет еще один нуклеофил – гидрид-ион – для еще одного нуклеофильного присоединения
При участии в перекрестной реакции Канницаро ароматического альдегида и формальдегида из-за легкой окисляемости алифатического альдегида неизменно получается ароматический спирт и формиат натрия
Интересно, что реакция Канницаро может протекать и как внутримолекулярный процесс
Бензоиновая конденсация. Под действием цианистых калия или натрия ароматические альдегиды вступают в так называемую бензоиновую конденсацию с образованием α-оксикетонов (ацилоинов)
Этот вид конденсации получил свое название по названию продукта конденсации бензальдегида – бензоина.
Предполагается, что бензоиновая конденсация идет по следующей схеме. Первоначально в результате нуклеофильного присоединения цианид-иона к альдегидной группе получается нуклеофильная частица
которая, в свою очередь, вступает в реакцию нуклеофильного присоединения ко второй молекуле альдегида
Продукт присоединения отщепляет цианид-ион и образует бензоин
Уникальность цианид-иона при бензоиновой конденсации вытекает из того, что он обладает достаточной для получения 1 нуклеофильностью, стабилизирует 2 и легко отщепляется от 3 с образованием ацилоина.
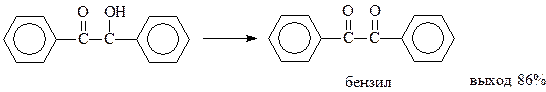
Бензоин обладает рядом интересных свойств. Он легко окисляется азотной кислотой в уксуснокислом растворе или сульфатом меди в водном пиридине в дикетон, который называют бензилом
С бензилом связана одна известная перегруппировка. При нагревании с разбавленным раствором едкого натра бензил перегруппировывается в бензиловую кислоту
В ходе бензиловой перегруппировки фенил-анион мигрирует к соседнему углероду. При этом одна карбонильная группа окисляется, а другая – восстанавливается
Бензиловая перегруппировка интересна тем, что в ходе этой реакции 1,2-фенильный сдвиг происходит при щелочном катализе. Между тем, сдвиги такого типа более характерны для реакций, протекающих при кислотном катализе.
Кротоновая конденсация.В результате реакции бензальдегида с ацетоном (недостаток) в среде разбавленной щелочи образуется бензальацетон или дибензальацетон
Хотя кротоновая конденсация с участием ароматических альдегидов и рассматривается обычно как их специфическое свойство, в действительности все происходит в рамках уже известных закономерностей превращений карбонильных соединений.
Как уже отмечалось, ароматические альдегиды лишены α-водородных атомов. Отсюда следует, что они не способны вступать в реакции типа альдольной или кротоновой конденсации. В то же время понятно, что для них вполне возможны перекрестная альдольная или кротоновая конденсации. При этом ароматические альдегиды могут выступать лишь в качестве акцепторов нуклеофилов (карбанионов), образовавшихся из карбонильных соединений с α-водородными атомами: альдегидов, кетонов, сложных эфиров (конденсация по Кляйзену), ангидридов карбоновых кислот (конденсация по Перкину). Образовавшиеся в результате реакции альдоли (β-оксикарбонильные соединения), у которых с β-углеродом связано бензольное кольцо, дегидратируются настолько быстро, что вместо спиртоальдегидов и кетонов получаются ненасыщенные карбонильные соединения.
Рассмотрим в качестве примера механизм конденсации по Кляйзену бензальдегида и ацетона
По аналогичной схеме идет конденсация по Перкину бензальдегида и уксусного ангидрида.
Конденсации с соединениями с подвижными атомами водорода. В реакциях Кляйзена и Перкина ароматические альдегиды конденсируются с соединениями с активными водородами. В этих соединениях водородные атомы становятся активными под влиянием соседней карбонильной группы. Однако водородные атомы могут стать подвижными и по другим причинам. Так, известно, что активными становятся водороды в о- и п-положениях бензольного кольца в аминах и фенолах. Действительно, для ароматических альдегидов известны реакции конденсации с подобными соединениями с образованием соединений трифенилметанового ряда, к которым относятся и многие красители
Кетоны
В ароматических кетонах карбонильная группа связана хотя бы с одним ароматическим радикалом
Видео:карбонильные соединения. часть 4Скачать

Альдольная конденсация
Вы будете перенаправлены на Автор24
Альдегиды в щелочной среде вступают в реакции альдольной конденсации (А. Бородин, Ж. Вурц, 1872):
Сначала под действием основного катализатора — гидроксид-аниона или этоксид-аниона $C_2H_5O^-$ из альдегида образуется сопряженный анион — сильный нуклеофил, который атакует электрофильный центр карбонильной группы следующей молекулы альдегида. Полученный в результате такого взаимодействия алкоголятний анион быстро превращается в альдоль.
Так, например, две молекулы пропаналя в реакции с водными растворами гидроксидов при 0-5 $^circ$С образуют 3-гидрокси-2-метилпентаналь с 55-60% выходом, а две молекулы уксусного альдегида дают альдоль с 50%-ным выходом:
Видео:АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯСкачать

Механизм альдольной конденсации катализируемой основаниями
Механизм реакций альдольной конденсации, катализируемых основаниями, включает три стадии:
На первой стадии образуются енолят-ионы. Равновесные концентрации енолят-ионов очень малы и редко превышают 1-3%, поскольку $pK_a$ альдегидов примерно равны 17-18, а для воды значение $pK_a$ равно 15,7. Присоединение енолят-ионов к карбонильным группам неионизированных молекул альдегидов на второй стадии определяет скорость всего процесса.
Готовые работы на аналогичную тему
Видео:Альдольная конденсацияСкачать

Дегидратация альдолей
Синтезированные альдоли при нагревании, как правило, легко отщепляют воду с образованием ненасыщенных карбонильных соединений. Процесс получения ненасыщенного альдегида или кетона из альдолей называют кротоновой конденсацией, по названию альдегида, впервые полученного таким методом:
Дегидратация альдолей в $alpha, beta$-ненасыщенные альдегиды также катализируется основаниями и протекает с промежуточным образованием енолят-ионов альдолей:
Видео:Альдольно-кротоновая конденсацияСкачать

Механизм альдольной конденсации катализируемой кислотами
Альдегиды способны вступать в альдольную конденсацию и в кислой сред, но остановить реакцию на стадии альдолей при этом достаточно трудно, и часто получается продукт кротоновой конденсации.
В кислых средах определяющей скорость всего процесса стадией является присоединение енолов к карбонильным группам.
В отличие от щелочного катализатора, который действует только на метиленовую компонента, при кислотном катализе наблюдается действие как на метиленовый, так и на карбонильный компонент с протонизацией атомов кислорода:
В кислых средах практически невозможно остановить процесс на стадии образования альдолей и конечными продуктами оказываются $alpha, beta$-ненасыщенные альдегиды — продукты их дегидратации.
Для протонованой метиленовой компоненты характерно отщепление $H+$ от группы $OH$ с образованием исходной карбонильной молекулы или от $alpha$-углеродного атома с образованием енола. В еноле же под влиянием $+M$-эффекта атома кислорода и $-I$-эффекта вицильной группы электронная плотность $pi$-связи смещена отгидроксильной группы, в результате чего енол реагирует далее с активированной карбонильной компонентой.
В сильнокислой среде для альдолей обычно характерна дегидратация с образованием оксида мезитила. В условиях реакции оксид мезитила реагирует с последующей молекулой карбонильного соединенния и конечным продуктом, в отличие от реакции в щелочной среде, является форон (в присутствия газообразной кислоты) или мезитилен (в присутствии концентрированной жидкой кислоты).
Видео:10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎥 ВидеоАльдольно кротоновая конденсацияСкачать  Реакция окисления альдегидов | ХимияСкачать  10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать  Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. Практическая часть. 11 класс.Скачать  Дядченко В. П. - Стратегия органического синтеза - Конденсации. Расчленение 1,4-ретронаСкачать  Лекторий ЗФТШ. X-10. Карбонильные соединения: строение, получение, химические свойстваСкачать  25. Схема реакции и химическое уравнениеСкачать  Химия 10 класс (Урок№8 - Альдегиды и кетоны.)Скачать  79. Что такое реакции поликонденсацииСкачать  Альдегиды и кетоны. Химические свойства. Все 23 реакции ЕГЭ.Скачать  Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  10 класс § 47 "Карбонильные соединения: номенклатура, изомерия, реакции присоединения"Скачать  Лекция 18Скачать  Cannizzaro reaction mechanism #jee2023Скачать  Химические свойства альдегидов и кетонов. 11 класс.Скачать  |