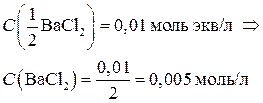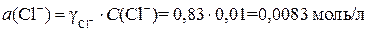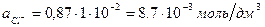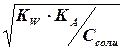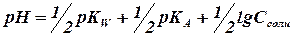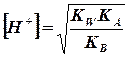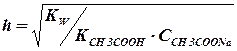Расчет ионной силы раствора
Пример 1. Рассчитать ионную силу 0,1 моль/л раствора Ca(NO3)2.
Решение. Запишем уравнение диссоциации нитрата кальция:
Ca(NO3)2 ® Ca 2+ + 2
Найдем концентрации обоих ионов по формуле (1.1):
C( 
Рассчитаем ионную силу, создаваемую ионами кальция и нитрата, по формуле (1.3):


Пример 2. Рассчитать ионную силу в растворе, содержащем 0,01 моль экв/л Al(NO3)3 и 0,01 моль экв/л BaCl2.
Решение. Запишем уравнения диссоциации солей:
Al(NO3)3 ® Al 3+ + 3
Перейдем от молярных концентраций эквивалента солей к молярным концентрациям:
Найдем молярные концентрации всех ионов по формуле (1.1):
C( 
C(Cl – ) = 2 · C(BaCl2) = 2 · 0,005 = 0,01 моль/л
Рассчитаем ионную силу, которую создают все ионы в растворе, по формуле (1.3):
Расчет коэффициентов активности
Пример 3. Рассчитать коэффициенты активности каждого из ионов в растворе, указанном в примере 2.
Решение. Для расчета коэффициентов активности ионов необходимо знать ионную силу раствора, поэтому сначала выполним все необходимые действия, как описано в примере 2:
§ запишем уравнения диссоциации солей;
§ перейдем от молярных концентраций эквивалента солей к молярным концентрациям;
§ найдем молярные концентрации всех ионов и рассчитаем ионную силу раствора: I = 0,035 моль/л.
Обращаемся к справочнику [1 или 2] и выясняем, что такого значения ионной силы в нем нет. Следовательно, придется рассчитывать коэффициенты активности по эмпирическим уравнениям. Выбираем необходимое уравнение. Поскольку 0,01
§ воспользоваться формулой (1.7).
Активность иона алюминия в растворе, содержащем 0,01 моль экв/л Al(NO3)3 и 0,01 моль экв/л BaCl2, равна:

Аналогично рассчитаем активности остальных ионов:
Как видно, для всех ионов величина активности меньше концентрации, что объясняется электростатическими взаимодействиями между ионами в растворе.
Видео:Ионная сила раствора. Теория (кратко) + задача.Скачать

Ионная сила: единицы, как ее рассчитать, примеры
Ионная сила: единицы, как ее рассчитать, примеры — Наука
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Содержание:
В ионная сила это способ выражения концентрации ионов в растворе. Это понятие было введено в 1922 году Льюисом и Рэндаллом, когда они работали над описанием коэффициента химической активности.
Когда концентрация ионов в растворе высока, между ионами с противоположным зарядом происходит электростатическое взаимодействие; Другими словами, катионы и анионы очень сильно притягиваются, что приводит к тому, что фактическая или эффективная концентрация ионов меньше, чем рассчитанная для конкретной химической реакции.
По этой причине понятие химической активности было введено как эффективная концентрация ионов в растворе, причем химическая активность является произведением молярности раствора и коэффициента химической активности.
Этот коэффициент имеет значение, близкое к единице (1) для разбавленных ионных растворов и для так называемых идеальных растворов. Это растворы, в которых межмолекулярное взаимодействие между подобными молекулами такое же, как и между разными молекулами.
Создание концепции ионной силы способствовало объяснению отклонений от идеального поведения, наблюдаемых в реальных ионных растворах.
Видео:Задача1Скачать

Блоки ионной силы
Ионная сила выражается в единицах моль / л (молярность) или моль / кг воды (молярность). Последний рекомендуется в неидеальных растворах, которые характеризуются тем, что объемы их смесей не являются полностью аддитивными.
Это означает, например, следующее: если смешать 0,5 л жидкости A и 0,5 л жидкости B, полученный объем этой смеси не обязательно будет равен 1 литру, но он может быть другим.
Ионная сила представлена символом I.
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Как рассчитать ионную силу?
Для расчета ионной силы раствора учитывается концентрация всех ионов, присутствующих в растворе, а также их соответствующие валентности.
Значение ионной силы получается по следующей формуле:
Где I, как уже было сказано, — ионная сила; C соответствует молярной или молярной ионной концентрации ионов; в то время как Z представляет их соответствующие валентности (± 1, ± 2, ± 3 и т. д.).
Выражение, которое появляется в формуле для расчета ионной силы (Σ), читается как сумма, то есть сумма произведения молярной концентрации (C) каждого иона, присутствующего в растворе, на его повышенную валентность (Z). в квадрате.
Как видно, валентность иона имеет наибольший вес в значении ионной силы раствора. Например: валентность (Z) Ca равна +2, поэтому Z 2 равно 4. В то время как валентность (Z) Na равна +1, а значит, Z 2 равно 1.
Это указывает на то, что вклад иона Са 2+ значение ионной силы при той же молярной концентрации ионов в четыре раза больше, чем у иона Na + .
Видео:Активность раствора и Коэффициент активности. В чем отличие от концентрации раствора.Скачать

Важность ионной силы
Ионная сила является подходящей мерой ионной концентрации раствора и является основой для создания теории Дебая-Хюккеля. Эта теория описывает идеальное поведение ионных растворов.
Ионная сила служит основой для расчета коэффициента активности (γя), параметр, который, в свою очередь, позволяет рассчитать химическую активность ионного соединения, причем химическая активность представляет собой фактическую и эффективную концентрацию ионного соединения в растворе.
По мере увеличения ионной силы раствора взаимодействие между ионами увеличивается. Следовательно, γ уменьшаетсяя и химическая активность ионов.
Увеличение ионной силы может снизить растворимость белков в водной среде, это свойство используется для избирательного осаждения белков. Растворы сульфата аммония с высокой ионной силой используются для осаждения и очистки белков плазмы.
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Примеры ионных сил
Видео:Практическое занятие. Ионная сила раствораСкачать
Пример 1
Рассчитайте ионную силу 0,3 М раствора хлорида калия (KCl).
KCl диссоциирует следующим образом:
Итак, у нас есть два иона: катион K + (Z = + 1) и анион Cl – (Z = -1). Затем мы применяем формулу для расчета ионной силы I:
I = 1/2 [C · (+1) 1 + С (-1) 1 ]
= 1/2 [0,3 М · 1 1 + 0,3 млн 1 1 ]
Обратите внимание, что -1 валентность Cl – Он был принят за 1, его абсолютное значение, иначе ионная сила была бы равна 0.
Видео:Задача. Ионная сила, активность ионовСкачать

Пример 2
Рассчитайте ионную силу раствора сульфата кальция (CaSO4) 0,5 млн
Дело4 диссоциирован следующим образом:
У нас есть два иона: катион Ca 2+ (Z = + 2) и анион SO4 2- (Z = -2). Затем мы применяем формулу для расчета ионной силы I:
I = 1/2 [C · (+2) 2 + С (-2) 2 ]
= 1/2 [0,5 M 4 + 0,5 M 4]
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Пример 3
Рассчитайте ионную силу буфера с конечными концентрациями двухосновного фосфата натрия (Na2HPO4) 0,3 М и одноосновный фосфат натрия (NaH2PO4) 0,4 М.
Затем2HPO4 он диссоциирован следующим образом:
В то время как NaH2PO4 диссоциирует по следующей схеме:
Мы действуем так же, как и предыдущие упражнения, на этот раз с анионами HPO4 2- (Z = -2) и H2PO4 – (Z = -1):
Обратите внимание, что концентрация Na + от Na2HPO4 он умножается на 2, так как его концентрация в два раза больше. Однако для другой соли NaH2PO4, концентрация Na + да, мы умножаем его на 1 в соответствии со стехиометрией уравнения растворения.
Видео:Ионное произведение воды. Водородный показатель. 11 класс.Скачать

Пример 4
Рассчитайте ионную силу раствора 0,15 М хлорида натрия (NaCl) и глюкозы (C6ЧАС12ИЛИ6) 0,3 М.
NaCl диссоциирует следующим образом:
Глюкоза, однако, не диссоциирует на ионы, потому что в ее химической структуре есть только ковалентные связи. Следовательно, валентность глюкозы (Z) равна нулю (0). Затем рассчитываем произведение ионной силы NaCl:
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

концентрации раствора и ионной силы.
1. Написать уравнение диссоциации сильного электролита.
2. Определить молярную концентрацию соответствующих ионов в растворе.
3. Вычислить ионную силу раствора.
4. Рассчитать или найти значения коэффициентов активности в справочной литературе.
5. Рассчитать активность соответствующих ионов.
Пример 1.Рассчитать ионную силу 0,005 М раствора CaCl2 и коэффициенты активности ионов Са +2 и 2Cl —
Решение:
Согласно уравнению диссоциации 
Коэффициенты активностей ионов определяют по формуле: 


следовательно, активность ионов вычисляется по формуле: 
Пример 2. Рассчитать активность ионов в растворе хлорида цинка с концентрацией 0,005 моль/дм 3
Решение.
1. ZnCl2 Û Zn 2+ + 2Cl —
2. CZn2+ = 0.005 моль/дм 3 ; СCl- = 2CZn2+ = 2 • 0,005 = 0,01 моль/дм 3
3. I = ½ (CZn2+•2 2 + СCl- •1 2 = ½ (0,005 • 4 + 0,010 • 1)= 0,015
4. fZn2+ = 0,64 ; fCl- = 0,88 – находят по таблицам справочника Ю.Ю.Лурье или рассчитывают так как в примере 1.
5. aZn2+ =f 
aCl- =f 
Пример 3. Рассчитать активность ионов Na + и SO4 2- в растворе, в
1 дм 3 которого содержится 0,005 моль Na2SO4 и 0,002 моль СН3СООН.
Решение.
| 10′ моль/дм |
Ионизацией молекул уксусной кислоты пренебрегают, так как слабые электролиты не вносят существенного вклада в ионную силу.
2. CNa+ = 2 • 0,005 = 0,01 моль/дм 3 ; C SO4 
3. I= ½ (0,01 • 1 2 + 0,005 • 2 2 )= 0,015
fSO4 
Пример 4. Рассчитать ионную силу раствора, полученного при смешивании равных объёмов 0,3 моль/дм 3 растворов карбоната, хлорида и гидроксида аммония.
Решение.
Ионизацией молекул гидроксида аммония пренебрегают, так как слабые электролиты почти не влияют на ионную силу раствора.
При сливании общий объём полученного раствора увеличился в три раза, следовательно, концентрации ионов стали равны:
С СО32- = 0,1 моль/дм 3 ;
C С1- = 0,1 моль/дм 3
I = ½ (0,3•1 2 +0,1•1 2 +0,1•1 2 ) = 0,4
Гидролиз. Расчет рН в растворах гидролизующихся солей.
Гидролиз — реакция взаимодействия вещества с ионами воды, сопровождающаяся нарушением равновесия диссоциации воды за счёт связывания ионов Н + или ОН — в малодиссоциирующее соединение.
Гидролиз солей
| Основание | Кислота | ||
| однооснóвная | многооснóвная | ||
| сильная (HCl) | слабая (HCN) | сильная (H2SO4) | слабая (H2S) |
| многокислотное слабое [Al(OH)3] | AlCl3 Продукты: оснóвные соли Al(OH)Cl2, Al(OH)2Cl. Гидролиз до конца не идёт; рН 7 (редкий случай) | BaSO4 Соли, практически нерастворимые в воде | BaS Продукты: Ba(HS)2, Ba(OH)2. Гидролиз до конца не идёт; рН > 7 (редкий случай) |
| однокислотное слабое (NH4OH) | NH4Cl Продукты: NH4OH, HCl. Гидролиз идёт до свободного основания и кислоты; рН 7 | Na2SO4 Гидролиз не идёт | Na2S Продукты: NaOH, NaHS. Гидролиз до конца не идёт; рН > 7 |
Количественно процесс гидролиза характеризуетсястепенью гидролиза(h) иконстантой гидролиза (Кг), которые связаны между собой
 |
Константа гидролиза определяется природой гидролизующегося иона. Для её расчёта нужно знать константу ионизации сопряжённой кислоты или основания.
Степень гидролиза зависит от природы соли и её концентрации.
Для гидролизующихся солей рассчитывают: [Н+], [ОН-], pH, рОН, aH+, aOH—, paH+, paOH—. рН раствора соли зависит от природы и концентрации гидролизующихся ионов в растворе.
А) Для солей, гидролизующихся по аниону:
An — + НОН НАn + ОН —
[ОН — ] = h * Ссоли= 
pOH = — lg[OH] Þ pH = 14- pOH
[H+] =
или в логарифмической форме:
Б) Для солей, гидролизующихся по катиону:
Kat + + НОН Û KatOH + Н +
рН + ] = h • Ссоли = 
или в логарифмической форме:
В) Для солей, гидролизующихся по катиону и аниону,
реакция раствора может быть нейтральной, слабокислой или слабоосновной в зависимости от относительной силы кислоты и основания, образующих соль.
Примеры решения задач по расчету рН в растворах гидролизующихся солей.
Пример 1. Рассчитать рН и степень гидролиза в 0,1моль/дм 3 растворе
Решение.
Соль образована катионом сильного основания и анионом слабой кислоты, т.е. гидролизуется в растворе по аниону. Записывают уравнение гидролиза
СН3СОО — + НОН Û СН3СООН + ОН —
[ОН — ] = 
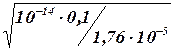
рОН= — lg [ОН — ] =— lg 7,5-10 -5 = 6 — 0,88= 5,12
pH = 14-5,12 = 8,88 среда основная
h= 0,75*10 -5 /0,1 = 0,75*10 -4 или 0,75*10 -2 %среда основная
Пример 2. Вычислить рН и рОН 0,01 моль/дм 3 раствора NH4CI, КNH3*Н20 =1,76*10 -5
Решение.
Соль образована катионом слабого основания и анионом сильной кислоты, т.е. гидролизуется в растворе по катиону. Записывают уравнение гидролиза
NH4 + + НОН Û NH4ОН + Н + рН + ] = 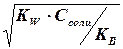

2,37 • 10 -6 моль/дм 3
рН= — lg [Н + ] = — lg 2,37 • 10 -6 = 6 — 0,38= 5,62 рОН= 14 — 5,62 = 8,38 среда слабокислая
Занятие 13. Буферные растворы.Расчет рН буферных растворов. Влияние факторов на буферную емкость.
Контрольные вопросы.
1.Протолитическое равновесие в буферных растворах. Классификация буферных растворов. Механизм буферного действия.
2.Буферная емкость и её определение.
3.Значение рН в буферных растворах (уравнение Гендерсона-Гассельбаха).
4. Роль буферных систем в организме человека. Использование буферных систем в анализе.
Буферные растворы.
Буферные растворы поддерживают постоянное значение рН среды при добавлении небольших количеств сильных кислот и оснований, а также при разбавлении или концентрировании раствора.
Механизм действия их основан на смещении ионных равновесий, поскольку буферные растворы представляют собой сопряжённую кислотно-основную пару. Буферные растворы имеют две количественные характеристики: рН и буферную ёмкость.
Расчёт рН буферных растворов
Для буферных растворов величина рН определяется природой и концентрациями растворённых веществ.
А) Буферный раствор, состоящий из слабой кислоты и её соли
 |
Б) Буферный раствор, состоящий из слабого основания и его соли
[ОН-]= Kb Cb / СсолиÞ
 |
Примеры решения задач по расчёту рН буферных растворов.
Пример 3. Рассчитать рН буферной смеси, содержащей 0,02 моль/дм 3 раствор NН4ОН в присутствии 0,2 моль/дм 3 раствора NH4Cl.
Решение.
Из справочных таблиц находят рК NH4OH = 4,75, подставляют в формулу
рН = 14- 4,75 + lg 0,02 / 0,2 = 9,35 среда основная.
Пример 4. К 100 см 3 0,2 моль/дм 3 раствора НСООН прибавили 50 см 3 0,5 моль/дм 3 HCOONa. Вычислить рН полученного раствора.
Решение.
Для расчёта новой концентрации кислоты и соли используют закон эквивалентов: C1 • V1 = C2 • V2 , где:C1 и V1 — начальные концентрации объёмы кислоты и соли,
C2 и V2 — концентрации и объёмы их после смешивания растворов. Поскольку НСООН — одноосновная кислота, то СЭ = CM.
Из справочных таблиц находим рК НСООН = 3,75, тогда:
рН = рКнсоон – lgchcooh /CHCOONa = 3,75 — lg 0,13/0,17 = 3,87 среда кислая
Пример 5. Вычислить рН буферной смеси СН3СООН + СНзСООNa, содержащей каждый компонент в концентрации 0,1 моль/дм 3 . Рассчитать, как изменится рН при добавлении к 1дм 3 смеси: а) 0,01 моль/дм 3 раствора НС1;
б) 0,01 моль/дм раствора NaOH;
в) при разбавлении смеси водой в 10 раз.
Решение.
Находят в справочных таблицах рКCH3СООН = 4,76, тогда:
рН = рКCH3СООН — lg СCH3СООН / CCH3COONa = 4,76 — lg 0,1/ 0,1 = 4,76 среда слабокислая
а) при добавлении НС1:
CH3COONa + HCI= СН3СООН + NaCI
При добавлении к 1 дм буферной смеси 0,01 моль/дм 3 раствора НС1 концентрация СН3СООН увеличится, а концентрация CH3COONa уменьшится на 0,01 моль и станут равными:
ССН3СООН = 0,11 моль/дм 3 , ССН3СООNа= 0,0900 моль/дм 3 .
рН= 4,76 — lg 0,11 / 0,09 = 4,76 — 0,09 = 4,67
б) при добавлении NaOH:
СН3СООН + NaOH= CH3COONa + H2O
При добавлении 0,01 моль/дм 
рН = 4,76- lg 0,09 : 0,11 = 4,76 + 0,1 = 4,86
в) при разбавлении буферного раствора водой в 10 раз получают:
рН= 4,76 — lg 0,01: 0,01 = 4,76
Как видно, буферный раствор во всех приведенных случаях поддерживает рН на одинаковом уровне.
Задачи:
1 Как изменится pH и степень диссоциации CH3COOH в 0,2М растворе, если к 100 мл этого раствора прибавили 30 мл 0,3М CH3COONa.
2 Вычислить pH раствора, если к 2 литрам воды прибавили 23г HCOOH и 21г HCOOK.
3 Какую среду (кислую, нейтральную или щелочную) имеют водные растворы солей (NH4)2CO3, Na3PO4, Al2(SO4)3, KCl ?
4 .К 20мл воды прибавили 5мл 3М раствора KNO2. Вычислить pH раствора и степень гидролиза соли.
5 Вычислить концентрацию ионов [H + ] и pH раствора полученного смешением 15мл 0,1М раствора HCOOH и 12мл 0,2М раствора HCOONa.
6 В 500мл раствора содержится 2,52г Na2CO3. Определить pH и степень гидролиза соли.
7 Рассчитать pH полученного раствора, если к 100мл 0,0375М CH3COOH прибавили 0,102г CH3COONa.
8 Вычислить рН смеси, содержащей равные объёмы 5%-ных растворов азотистой кислоты и её натриевой соли. (Ответ:3,23)
9 Вычислить рН буферной смеси, содержащей равные объёмы 5%-ных растворов аммиака и хлорида аммония. (Ответ:9,44)
10 Рассчитать рН аммиачной буферной системы, содержащей по 0,5 моль/дм 3 раствора аммиака и хлорида аммония. Как изменится рН при добавлении к 1дм этой смеси:
а) 0,1 моль/дм 3 раствора хлороводородной кислоты;
б) 0,1 моль/дм 3 раствора гидроксида натрия;
в) при разбавлении водой в 10 раз. (Ответ: 9,25; 9,12; 9,39, 9,25)
11 Вычислить рН буферной смеси, содержащей 0,01 моль/дм 3 раствор уксусной кислоты и 0,1 моль/дм 3 раствор ацетата натрия. (Ответ: 5,76)
Занятие 14.Титиметрические методы анализа.
Кислотно – основное титрование.
Контрольные вопросы.
1. Количественный анализ. Классификация методов. Роль и значение количественного анализа.
2. Сущность титриметрического метода анализа. Классификация методов. Требования к реакциям в титриметрических методах анализа.
3. Приготовление и стандартизация растворов. Титранты, рабочие растворы.
4. Способы титрования: прямое, обратное, заместительное. Сущность, примеры.
5. Кислотно-основное титрование. Сущность данного метода. Реакции, используемые в данном методе, требования к ним.
6. Точка эквивалентности в титровании, ее фиксация с помощью индикаторов.
7. Ациди-алкалиметрия в биологии и медицине.
8. Типовые расчеты в титриметрическом анализе (молярная концентрация, молярная концентрация эквивалента, титр, титриметрический фактор пересчета (титр по определяемому веществу), поправочный коэффициент).
9. Расчет массы и массовой доли определяемого вещества по результатам титрования.
Кислотно – основное титрование.
В основе кислотно-основного метода лежит реакция нейтрализации:
Этот метод применяется для количественного определения кислот и щелочей. При помощи метода нейтрализации проводят также ряд других титриметрических определений, связанных с реакцией нейтрализации, например определение некоторых солей, образованных сильными основаниями и слабыми кислотами (Na2CO3 , Na2B4O7), или солей аммония.
При количественном определении кислот — алкалиметрии—рабочим раствором является раствор щелочи NaOH или КОН. Приготовить титрованный раствор щелочи по навеске невозможно, так как щелочь не отвечает требованиям, предъявляемым к веществам, из которых можно готовить раствор точной концентрации по точно взятой навеске. Кроме того, при самом тщательном хранении растворы щелочей довольно быстро меняют свой титр. Поэтому титр этих рабочих растворов устанавливают. Исходным веществом для установки титра рабочего раствора щелочи может служить щавелевая кислота Н2С2О4 ·2Н2О или янтарная кислота Н С Н О . Часто в лабораторной практике в качестве исходного раствора употребляют 0,1 н. раствор кислоты, приготовленный из фиксанала.
При количественном определении щелочи—ацидиметрии—рабочим раствором является раствор сильной кислоты (обычно НСl или H2SO4). Приготовить титрованный раствор кислоты, исходя из концентрированной кислоты, невозможно. Как бы точно мы не взяли навеску концентрированной кислоты, мы не будем знать истинного ее количества, так как серная кислота гигроскопична, а концентрированная хлороводородная кислота выделяет хлороводород. Поэтому титр рабочих растворов кислот устанавливают. Исходным веществом для установки титра раствора кислоты служит бура Na2В4О4 · 10Н2О или х. ч. Сода Na2CO3. В некоторых случаях рабочий раствор кислоты готовят из фиксанала.
Титр раствора кислот не меняется довольно продолжительное время.
Кислотно-основной метод применяется в клинических лабораториях для определения кислотности желудочного сока. В санитарно-гигиенических лабораториях метод нейтрализации находит самое широкое применение. При помощи этого метода определяют карбонатную жесткость воды, кислотность молочных продуктов, квашеной капусты и безалкогольных напитков.
В фармацевтическом анализе кислотно-основной метод применяют для определения концентрации хлороводородной кислоты, количества гидрокарбоната, борной кислоты и др.
Если титровать раствор любой кислоты раствором щелочи, происходит связывание ионов Н + кислоты ионами ОН¯ и концентрация ионов Н + постепенно уменьшается, а рН раствора возрастает.
При определенном значении рН достигается точка эквивалентности и титрование должно быть закончено. При титровании раствора щелочи раствором кислоты связываются ионы ОН¯, и концентрация их в растворе уменьшается, а концентрация ионов Н+ увеличивается и рН раствора уменьшается. Однако значение рН в точке эквивалентности не во всех случаях имеет одно и то же значение, оно зависит от природы реагирующей кислоты и основания.
При нейтрализации сильной кислоты сильным основанием:
HCI + NaOH → NaCI + Н2О
образуется только один слабый электролит—вода. Реакция практически доходит до конца. Образующаяся при реакции соль гидролизу не подвергается и имеет нейтральную реакцию (рН = 7,0). Следовательно, при титровании сильной кислоты щелочью и, наоборот, в точке эквивалентности среда раствора нейтральна, рН раствора равен 7,0.
Если вместо сильной кислоты титровать щелочью слабую кислоту, например уксусную, то происходит реакция:
В растворе в точке эквивалентности будет присутствовать соль СНзСООNa, подвергающаяся гидролизу:
Следовательно, протекающая в данном случае при титровании реакция обратима и не будет доходить до конца. В точке эквивалентности в растворе будут присутствовать СН3СООН и NaOH. Слабая уксусная кислота находится в растворе в основном в виде недиссоциированных молекул, а NaOH диссоциирован почти полностью. Концентрация ионов ОН превышает концентрацию ионов Н + и титрование будет заканчиваться при рН>7,0.
При титровании слабых оснований сильными кислотами, например
образующаяся соль подвергается гидролизу. Реакция нейтрализации будет обратима и в точке эквивалентности концентрация ионов Н + превысит концентрацию ионов ОН¯. Титрование будет заканчиваться при рН + + Ind¯
Поскольку индикатор является слабой кислотой, при небольших значениях рН он будет находиться в растворе в недиссоциированном состоянии и иметь окраску, соответствующую цвету недиссоциированных молекул. Если прибавить к водному раствору индикатора немного сильного основания, например NaOH, ионы ОН¯ будут соединяться с ионами Н + индикатора, образуя молекулу воды. Вследствие изменения концентрации ионов Н+ равновесие диссоциации индикатора сдвигается вправо, в сторону образования свободных ионов. При добавлении некоторого количества щелочи концентрация недиссоциированных молекул Hind будет так мала, что их окраска станет незаметной, и раствор окрасится в другой цвет — цвет свободных ионов Ind¯.
Прибавление к полученному раствору кислоты приведет к повышению концентрации ионов Н + и сдвигу равновесия влево, в сторону образования недиссоциированных молекул. В связи с этим исчезнет окраска, свойственная ионам Ind¯, и появится окраска недиссоциированных молекул Hind.
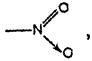
Хромофорная теория. В действительности механизм изменения окраски индикаторов более сложен, чем предполагал Оствальд. Позднейшие исследования ряда ученых показали, что окраска органических соединений (а индикаторы являются сложными органическими соединениями) обусловлена наличием в его молекуле определенных групп, называемых хромофорами. К хромофорным группам относятся
· Азогруппа —N=N—,
· нитрогруппа
· нитрозогруппа —N=О,
· хиноидная группировка 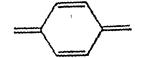
Кроме хромофоров, в окраске органических соединений грают важную роль ауксохромы. Это группы, присутствие которых в молекуле органического соединения усиливает его окраску. К ауксохромам относятся группы —NH,
Согласно хромофорной теории, окраска органических соединений зависит от строения молекулы. Вследствие внутримолекулярной перегруппировки изменяется строение молекулы индикатора, а, следовательно, меняется окраска соединения. Бензольная система переходит в хиноидную:

Азогруппа —N=N— в определенных условиях переходит в группу =N–NH– и т. Д. Эти перегруппировки внутри молекулы оказываются причиной изменения окраски индикатора.
Превращение таутомерных форм друг в друга у индикаторов является обратимым процессом. В растворе любого индикатора присутствуют различные его формы, находящиеся в равновесии друг с другом.
Изменение строения индикаторов происходит при добавлении к растворам кислот или щелочей, т. Е. при изменении концентрации ионов водорода в растворах. Это происходит потому, что хотя индикаторы не являются электролитами, как предполагал Оствальд, они могут диссоциировать с образованием ионов Н+ (или ОН¯),
Таким образом, в растворе индикатора, наряду с равновесием между таутомерными формами (1) существует равновесие диссоциации (2):
Радикалы R и R’ отличаются друг от друга внутренним строением, они содержат разные хромофорные группы и формы RH и R’H отличаются окраской. Причем окраска иона R’¯ такая же, как и молекулы HR’, так как при диссоциации внутреннее строение не изменяется.
Прибавление щелочи вызывает уменьшение концентрации ионов Н + . Вследствие этого происходит сдвиг равновесия слева направо и превращение формы RH в форму HR’, а, следовательно, изменение окраски.
Прибавление кислоты вызывает увеличение концентрации ионов Н + , равновесие сдвигается влево, происходит превращение формы HR’ в RH и изменение окраски.
В качестве примера приведем изменение строения и окраски индикаторов фенолфталеина:
и метилового оранжевого:
В растворе индикаторов, как указывалось выше, существует равновесие. В кислой среде в растворе находится таутомерная форма, которую мы назовем кислотной формой, а в щелочной — щелочная форма. Эти формы имеют различную окраску.
Интервал перехода окраски индикатора у разных индикаторов находится при разных концентрациях ионов водорода. Область значения рН раствора, в которой происходит заметное изменение окраски индикатора называется областью перехода индикатора. Например, область перехода индикатора метилового оранжевого находится в пределах рН от 3,1 до 4,4. При рН>4,4 метиловый оранжевый— желтый, при рН 6,2 — желтый.
В каждом случае титрование заканчивается в момент резкого изменения окраски индикатора. Значение рН, при котором происходит наиболее резкое изменение индикатора, называется показателем титрования. Следовательно, показатель титрования есть то значение рН, от которого мы титруем раствор с данным индикатором. Так, показатель титрования для фенолфталеина примерно равен 9,0, т. Е. при этом значении рН мы особенно четко замечаем изменение окраски и заканчиваем титрование. Показатель титрования метилового оранжевого равен 4,0.
Так как конец реакции определяется с помощью индикаторов, необходимо для каждого определения праильно выбрать индикатор, так чтобы его показатель титрования был как можно ближе к рН точки эквивалентности в данном определении. Необходимо помнить, что если определяют содержание какого-либо вещества по методу нейтрализации, титр рабочего раствора должен быть установлен с тем индикатором, с каким будет производиться определение.
Необходимо помнить также, что на показания индикаторов влияют ряд факторов:
1) температура—с увеличением температуры у индикатора меняется область перехода и может меняться интенсивность окраски, поэтому все определения по методу нейтрализации проводят при комнатной температуре:
2) посторонние примеси — заметное количество нейтральных солей, веществ, легко переходящих в коллоидное состояние, некоторых органических растворителей искажают результаты титрования;
3) количество индикатора — чем больше индикатора, тем труднее заметить изменение окраски.
📸 Видео
Применение теории растворов электролитов и закона действующих масс в аналитической химии.Скачать

Реакции ионного обмена. 9 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

Гидролиз солей. 9 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

4 1 Представления Дебая Хюккеля 4 1 Представления Дебая Хюккеля Содержание курса Analytical chemСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

сильные и слабые электролиты РАСЧЕТ рНСкачать

pH и буферные растворы | Медицинская химия | МедвузаСкачать