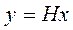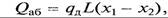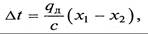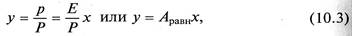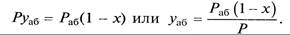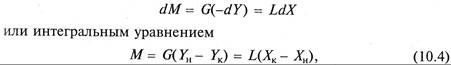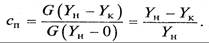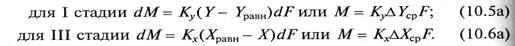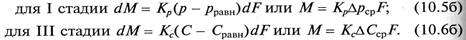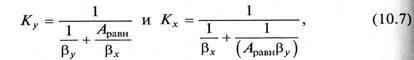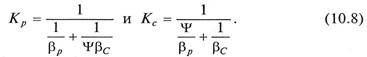План
1. Общие сведения.
2.1 Материальный баланс.
2.2 Рабочая линия процесса абсорбции.
2.3 Движущая сила процесса.
3.1 Материальный баланс.
3.2 Движущая сила процесса.
3.3 Типы адсорбентов
4. Аппараты для проведения процесса абсорбции адсорбции.
Общие сведения.
Абсорбция— процесс избирательного поглощения компонентов газовой (паровой) смеси жидким поглотителем.
Абсорбируемые компоненты газовой (паровой) смеси называют – абсорбтивом
Жидкий поглотитель – абсорбентом.
Неабсорбированная часть газовой (паровой) смеси называется – инертом.
Если поглощение абсорбтива осуществляется путем его растворения в абсорбенте, то такой процесс называется – физической абсорбцией.
Когда растворение абсорбтива сопровождается химической реакцией между ним и абсорбентом, то этот процесс называется – хемосорбцией.
Обратный процесс в сорбционных процессах называется – десорбцией.
Адсорбция — это поглощение поверхностью твердого тела того или другого компонента из газа или жидкости. Поглощающее вещество, называемое адсорбентом, должно иметь весьма большую поверхность. В качестве адсорбентов используются специально приготавливаемые угли, гель кремневой кислоты, глинозем и другие вещества. Поглощение газа поверхностью тела не сопровождается его конденсацией. Однако в капиллярах сорбента может происходить конденсация поглощаемого газа. Это явление называется капиллярной конденсацией.
Абсорбция.
— для насыщения воды, безалкогольных напитков, пива и некоторых сортов вин углекислым газом;
— для улавливания паров этилового спирта из газов, выделяемых при брожении в спиртовом и винодельческом производствах;
— для уменьшения влажности воздуха в хранилищах складских помещениях, лаб.оборудовании с использованием абсорбентов – конденсированных кислот.
Материальный баланс.
В производстве абсорбция осуществляется в противоточных аппаратах непрерывного действия, в которых газ и жидкость (сорбент) приводятся в тесный контакт. Схема такого аппарата (абсорбера) представлена на рис. 1. Инертный непоглощаемый газ (V в кмоль/ч) при входе в аппарат содержит некоторое количество поглощаемого компонента. Обозначим его концентрацию в кмоль/кмоль инертного газа через yн.
Рис. 1. Схема абсорбера.
При прохождении газовой смеси через абсорбер количество инертного газа не изменяется, а концентрация поглощаемого компонента уменьшается до ук кмоль/кмоль.
Жидкий сорбент поступает в абсорбер в количестве W кмоль/ч. Содержание поглощаемого компонента в жидкости: при ее поступлении в абсорбер Хн кмоль/кмоль чистого сорбента; при выходе из аппарата — Хк.
На основании закона сохранения вещества может быть составлено уравнение материального баланса абсорбционного процесса для поглощаемого компонента:

При составлении баланса мы пренебрегаем возможными потерями при проведении процесса. Из уравнения 1 имеем:

где G — количество компонента, переданного из одной фазы в другую, в кмоль/ч.
Из уравнения 2 вытекает, что
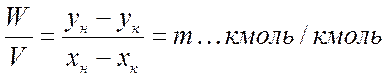
где m — удельный расход сорбента.
Рабочая линия процесса абсорбции
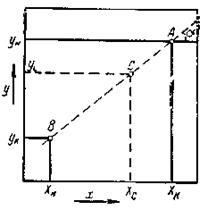
Уравнение 2 является уравнением прямой линии, построенной в координатах х — у. На рис. 2 эта линия обозначена А — В. Угловой коэффициент этой линии равен m, T. e. tg ά = m.
Линия А-В называется рабочей линией. При помощи этой линии устанавливается связь между составом жидкости и составом газа для любого сечения аппарата. Так, если в каком-то сечении аппарата содержание поглощаемого компонента в газе ус, то содержание этого компонента в жидкости будет равно хс см. рис. 2.
Рис.2 Рабочая линия абсорбера
Движущая сила процесса.
Рабочая линия, изображенная на рис. 2, позволяет установить условия, при которых процесс абсорбции станет возможным. Рассмотрим условия равновесия газа и сорбента. Применим для этого правило фаз. В рассматриваемом случае мы имеем две фазы (газ и жидкость) и три компонента (поглощаемый компонент, инертный газ и жидкость). Определяющими параметрами будут давление, температура и концентрации:
В нашем случае, когда поглощается один компонент газовой смеси,
где S — число степеней свободы;
К-число компонентов системы;
f — число фаз системы.
Этими тремя степенями свободы будут состав одной из фаз, давление и температура. Содержание поглощаемого компонента в другой фазе не может быть выбрано произвольно. Оно определяется выбранными тремя параметрами.
Для идеальных растворов, в которых силы взаимодействия между молекулами компонентов системы одинаковы, условия равновесия определяются законами Генри и Рауля. Закон Генри можно формулировать так:
где к — количество растворенного газа, отнесенное к поглощающей жидкости, в
Уравнение 4 называется законом Генри, который может быть сформулирован так: растворимость газа прямо пропорциональна парциальному давлению газа над жидкостью.
Известно также, что в газовой смеси парциальное давление компонента может быть выражено уравнением:
где у — моль-доля рассматриваемого компонента в газовой
Р — общее давление в смеси.
Приравнивая р из уравнений 4 и 5, получим
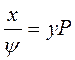
или
где 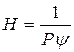
Уравнение 6 является уравнением фазового равновесия. Для идеальных растворов, для которых закон Генри точен, величина Н является постоянной и линия равновесия является прямой.
Так как при сильном разбавлении все растворы приближаются к идеальным, то в области низких концентраций линия равновесия является прямой.
Величина Н называется константой фазового равновесия.
В общем случае зависимость между у и х представляется кривой, которая называется кривой равновесия. Кривая равновесия обычно строится на основании экспериментальных данных. Мы можем заметить, что кривая эта (или прямая в частном случае) строится в тех же координатах, что и рабочая линия процесса абсорбции.
Очевидно, что для протекания процесса абсорбции линия равновесия должна проходить ниже рабочей линии рис. 3 На рис. линия OD представляет собой кривую равновесия, соответствующую уравнению у = Нх.
Рис. З. Рабочая линия и линия равновесия фаз.
Рассмотрим произвольное сечение аппарата, в котором жидкая фаза содержит ХА% поглощаемого компонента. Равновесное содержание этого компонента равно уА% Согласно рабочей линии в рассматриваемом сечении, в газовой фазе того же компонента содержится УА%. Очевидно, в данной точке действующей силой процесса будет величина (уА— У*а), изображаемая отрезком NP. Как видно из рис. 3, движущая сила будет меняться по высоте аппарата.
- АБСОРБЦИЯ
- Абсорбция
- 3. МАТЕРИАЛЬНЫЙ РАСЧЕТ АБСОРБЕРА
- 3.1. Плотность газовой смеси на входе в аппарат.
- 3.2. Массовый расход исходной смеси на входе в аппарат:
- 3.4. Расход распределяемого компонента и инертного вещества
- 3.5. Масса распределяемого компонента поглощенного водой
- 3.6. Относительная концентрация аммиака на входе и выходе:
- 3.7. Расход инертной фазы.
- 4.1. Скорость газа в абсорбере
- 4.2. Диаметр абсорбера:
- 4.4. Характеристика стандартной тарелки:
- 5. РАСЧЕТ ВЫСОТЫ АБСОРБЕРА
- 5.1. Высота светлого слоя жидкости:
- 5.2. Плотность орошения:
- 5.3. Газосодержание барботажного слоя:
- 5.4. Вязкость газовой смеси:
- 5.5. Коэффициенты диффузии
- 5.6. Коэффициент массоотдачи в жидкой фазе:
- 5.7. Коэффициент массоотдачи в газовой фазе:
- 5.8. Коэффициент массопередачи:
- 5.9. Движущая сила процесса массопередачи:
- 5.10. Число тарелок в абсорбере
- 5.11. Высота колонны:
- 6. ГИДРАВЛИЧЕСКИЙ РАСЧЕТ КОЛОННЫ
- 6.1. Гидравлическое сопротивление сухой тарелки
- 6.2. Гидравлическое сопротивление обусловленное силами поверхностного натяжения:
- 6.3. Гидравлическое сопротивление газожидкостного слоя:
- 6.4. Полное сопротивление тарелки:
- 6.5. Полное сопротивление колонны:
- 6.7. Подбор газодувки и насоса для подачи воды.
- 7.1 Толщина обечайки:
- 7.2. Днища.
- 7.3. Фланцы.
- 7.4. Штуцера.
- 💥 Видео
Видео:5.1. Адсорбция. Классификация адсорбцииСкачать

АБСОРБЦИЯ
Тема 3.3. Абсорбция 12ч., в т.ч. лаб. раб. и практ. занят 6ч.
Студент должен:
знать:
— физические основы и теорию процесса абсорбции (равновесие между фазами, принципы составления материального теплового баланса, уравнение рабочей линии);
— порядок расчета насадочного и барботажного абсорбера;
— сущность и методы проведения десорбции;
уметь:
— составлять материальный и тепловой баланс;
— определять расход поглотителя;
— строить равновесную и рабочую линию процесса;
— определять основные габаритные размеры абсорберов, пользуясь справочниками.
Назначение абсорбции. Абсорбция при разделении гомогенных газовых смесей и очистки газов. Выбор абсорбента. Физическая абсорбция и абсорбция, сопровождаемая химическим взаимодействием. Десорбция.
Равновесие между фазами при абсорбции. Влияние температуры и давления на растворимость газов в жидкостях. Материальный баланс процесса и уравнения рабочей линии при абсорбции и десорбции. Расход абсорбента. Тепловой баланс абсорбции. Отвод тепла при абсорбции.
Абсорбцией называют процесс избирательного поглощения компонентов из газовых или парогазовых смесей жидкими поглотителями – абсорбентами.
Принцип абсорбции основывается на различной растворимости компонентов газовых и парогазовых смесей в жидкостях при одних и тех же условиях. Поэтому выбор абсорбентов осуществляют в зависимости от растворимости в них поглощаемых компонентов, которая определяется:
· физическими и химическими свойствами газовой и жидкой фаз;
· температурой и давлением осуществления процесса;
· содержанием газа в смеси.
При выборе абсорбента необходимо учитывать такие его свойства, как селективность (избирательность) по отношению к поглощаемому компоненту, токсичность, пожароопасность, стоимость, доступность и др.
Различают физическую абсорбцию и химическую абсорбцию (хемосорбцию). При физической абсорбции поглощаемый компонент образует с абсорбентом только физические связи. Процесс этот в большинстве случаев является обратимым. На этом свойстве основано выделение поглощенного компонента из раствора – десорбция. Если поглощаемый компонент вступает в реакцию с абсорбентом и образует химическое соединение, то процесс называют хемосорбцией.
Процесс абсорбции обычно является экзотермическим, т. е. сопровождается выделением теплоты.
Абсорбция широко используется в промышленности для разделения углеводородных газов на нефтеперерабатывающих установках, получения соляной и серной кислот, аммиачной воды, очистки газовых выбросов от вредных примесей, выделения ценных компонентов из газов крекинга или пиролиза метана, из газов коксовых печей и т. д.
Равновесие в процессах абсорбции определяется правилом фаз Гиббса (В.4), представляющим обобщение условий гетерогенного равновесия:
Поскольку процесс абсорбции осуществляется в двухфазной (газ – жидкость) и трехкомпонентной (один распределяемый и два распределяющих компонента) системе, число степеней свободы – три.
Таким образом, равновесие в системе газ (пар) – жидкость может характеризоваться тремя параметрами, например температурой, давлением и составом одной из фаз.
Равновесие в системе газ – жидкость определяется законом растворимости Генри, согласно которому при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:
где р – парциальное давление газа над раствором; х – мольная концентрация газа в растворе; Е – коэффициент пропорциональности (коэффициент Генри).
Закон Генри распространяется в первую очередь на слаборастворимые газы, а также на растворы с низкими концентрациями хорошо растворимых газов при отсутствии химической реакции.
Коэффициент Е имеет размерность давления, совпадающую с размерностью р, и зависит от природы растворяющегося вещества и температуры. Установлено, что с увеличением температуры растворимость газа в жидкости уменьшается. Когда в равновесии с жидкостью находится смесь газов, закону Генри может следовать каждый из компонентов смеси в отдельности.
Поскольку тепловой эффект, сопровождающий процесс абсорбции, отрицательно сказывается на положении линии равновесия, он должен обязательно учитываться при расчетах. Количество теплоты, выделяющейся при абсорбции, может быть определено по зависимости
где qд — дифференциальная теплота растворения в пределах изменения концентрации х1 – х2; L – количество абсорбента.
Если абсорбция ведется без отвода теплоты, то можно допустить, что вся выделяющаяся теплота идет на нагревание жидкости, и температура последней повышается на величину
где с – теплоемкость раствора.
Для понижения температуры исходную газовую смесь и абсорбент охлаждают, отводя теплоту, выделяющуюся в процессе абсорбции, с помощью встроенных (внутренних) или наружных теплообменников.
Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть определено по закону Дальтона, согласно которому парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси, т. е.
где Р – общее давление газовой смеси; у – мольная концентрация распределяемого в смеси газа.
Сопоставляя уравнения (10.2) и (10.1), найдем
где Аравн = Е/Р – константа фазового равновесия, применимая для областей действия законов Генри и Дальтона.
Пусть Раб – давление паров чистого абсорбента в условиях абсорбции; раб – парциальное давление паров абсорбента в растворе; Р – общее давление; х – мольная доля абсорбируемого газа в растворе; у – мольная доля распределяемого газа в газовой фазе; уаб – мольная доля абсорбента в газовой фазе.
Согласно закону Рауля парциальное давление компонента в растворе равно давлению пара чистого компонента, умноженному на его мольную долю в растворе:
По закону Дальтона (10.2) парциальное давление абсорбента в газовой фазе равно
Анализ факторов, влияющих на равновесие в системах газ (пар) – жидкость, позволил установить, что к параметрам, улучшающим условия абсорбции, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, — пониженное давление, повышенная температура и введение в абсорбент добавок, уменьшающих растворимость газов в жидкостях.
Материальный баланс процесса абсорбции выражается дифференциальным уравнением
где G – поток газовой смеси (инертного газа), кмоль/с; L – поток абсорбента, кмоль/с; Yн и Yк – начальное и конечное содержание распределяемого вещества в газовой фазе, кмоль/кмоль инертного газа; Хк и Хн – начальное и конечное содержание распределяемого вещества в абсорбенте, кмоль/кмоль абсорбента; М – количество распределяемого вещества, перенесенного из фазы G в фазу L в единицу времени, кмоль/с.
Из уравнения материального баланса (10.9) можно определить необходимый общий расход абсорбента
Процесс абсорбции характеризуется также степенью извлечения (поглощения), представляющей отношение количества фактически поглощенного компонента к количеству, поглощаемому при полном его извлечении,
Кинетика процесса абсорбции характеризуется тремя основными стадиями, которые соответствуют схеме, представленной на рис. 9.4.
Первая стадия – перенос молекул абсорбируемого компонента из ядра потока газа (пара) к поверхности раздела фаз (поверхности жидкости).
Вторая стадия – диффундирование молекул абсорбируемого компонента через поверхностный слой жидкости (граница раздела фаз).
Третья стадия – переход молекул абсорбируемого вещества от поверхности раздела фаз в основную массу жидкости.
Кинетические закономерности абсорбции соответствуют общему уравнению массопередачи для двухфазных систем:
Экспериментально установлено, что вторая стадия процесса абсорбции идет с большей скоростью и не влияет на общую скорость процесса, ограниченную скоростью наиболее медленной стадии (первой или третьей).
Движущая сила процесса абсорбции для I и III стадий в уравнениях (10.5а) и (10.6а) может быть выражена через другие параметры:
В уравнениях (10.5б) и (10.6б) р – рабочее парциальное давление распределяемого газа в газовой смеси; рравн – равновесное давление газа над абсорбентом, соответствующее рабочей концентрации в жидкости; С – рабочая объемная мольная концентрация распределяемого газа в жидкости; Сравн – равновесная объемная мольная концентрация распределяемого газа в жидкости, соответствующая рабочему парциальному давлению его в газовой смеси.
При таком выражении движущей силы процесса абсорбции уравнение равновесной зависимости принимает вид
где Ψ – коэффициент пропорциональности, кмоль/(м 3 *Па).
Коэффициенты массопередачи выражаются для уравнений (10.5а) и (10.6а) в виде
для уравнений (10.5б) и (10.6б)
В уравнениях (10.7) и (10.8) βу, βр – коэффициенты массоотдачи от потока газа к поверхности контакта фаз; βх, βС — коэффициенты массоотдачи от поверхности контакта фаз к потоку жидкости.
Коэффициенты массоотдачи по газу и жидкости βу и βх могут быть определены из критериальных уравнений, имеющих вид:
для жидкой фазы Nuдиф х = f*(Re, Prдиф х).
Величина коэффициента Ψ оказывает существенное влияние на кинетику процесса абсорбции. Если Ψ имеет высокие значения (высокая растворимость компонента – диффузионное сопротивление сосредоточено в газовой фазе), то 1/(βc*Ψ)
Дата добавления: 2015-08-14 ; просмотров: 7368 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Практическое занятие по расчёту абсорбцииСкачать

Абсорбция
Для поглощения NH3 водой; V = 5000 нм3/ч; NH3 = 0,12 мас.%
Степень улавливания 96%. Температура 20° С.
Константа Генри 2070 мм рт. ст. = 0,276 МПа
Абсорбцией называют процесс поглощения газа или пара жидким поглотителем (абсорбентом). Поглощение газа может происходить либо за счет его растворения в абсорбенте, либо в результате его химического взаимодействия с абсорбентом. В первом случае процесс называют физической абсорбцией, а во втором случае – хемосорбцией. Возможно также сочетание обоих механизмов процесса.
В промышленности абсорбция широко применяется для выделения из газовых смесей ценных компонентов, для очистки технологических и горючих газов от вредных примесей, для санитарной очистки газов и т. д.
При переходе из газовой фазы в жидкую, энергия молекул распределяемого компонента уменьшается. Поэтому процесс абсорбции сопровождается выделением тепла и повышением температуры системы. Кроме того, объем системы в процессе абсорбции уменьшается за счет уменьшения объема газовой фазы. Следовательно, согласно принципу Ле-Шателье, растворимость газа в жидкости увеличивается при повышении давления и уменьшении температуры процесса. Статика процесса абсорбции описывается уравнением Генри, а кинетика – основными уравнениями массопередачи.
При абсорбции процесс массопередачи протекает на поверхности соприкосновения фаз. Поэтому в аппаратах для поглощения газов жидкостями (абсорберах) должна быть создана развитая поверхность соприкосновения между газом и жидкостью. По способу образования этой поверхности абсорбционные аппараты можно разделить на поверхностные, барботажные и распыливающие.
В абсорберах поверхностного типа поверхностью соприкосновения фаз является зеркало жидкости или поверхность стекающей пленки.
Насадочные колонны представляют собой колонны, загруженные насадкой — твердыми телами различной формы; при наличии насадки увеличивается поверхности соприкосновения газа и жидкости.
Эффективность работы насадочного абсорбера во многом зависит не только от гидродинамического режима, но и от типа выбранной насадки. Разнообразие применяемых насадок объясняется множеством предъявляемых к ним требований: большая удельная поверхность и свободный объем, малое гидравлическое сопротивление газовому потоку, равномерное распределение абсорбента, хорошая смачиваемость, коррозионная стойкость, малая насыпная плотность и низкая стоимость.
В барботажных абсорберах поверхность соприкосновения фаз развивается потоками газа, распределяющегося в жидкости в виде пузырьков и струек. Такое движение газа, называемое барботажем, осуществляется в тарельчатых колоннах с колпачкаовыми, ситчатыми или провальными тарелками. Особенностью тарельчатых колонн является ступенчатый характер проводимого в них процесса (в отличие от непрерывного процесса в наса-дочных колоннах) газ и жидкость последовательно соприкасаются на отдельных ступенях (тарелках) аппарата
В распыливающих абсорберах поверхность соприкосновения создается путем распыления жидкости в массе газа на мелкие капли. Такие абсорберы изготовляются обычно в виде колонн, в которых распыление жидкости производится сверху, а газ движется снизу вверх.
Все перечисленные типы абсорберов имеют свои достоинства и недостатки. Поверхностные абсорберы малоэффективны и имеют ограниченное применение, главным образом для абсорбции небольших количеств хорошо растворимых газов.
Преимуществом распылительных абсорберов является их простота и дешевизна, низкое гидравлическое сопротивление, а недостатками – дополнительные затраты энергии на распыление жидкости, большая плотность орошения и трудность регулирования подачи большого количества жидкости
Преимуществом барботажных абсорберов является хороший контакт между фазами и возможность работы при любом, в том числе и низком, расходе жидкости, кроме того в барботажных абсорберах легко осуществить отвод теплоты. Основной недостаток барботажных абсорберов сложность конструкции и высокое гидравлическое сопротивление.
Насадочные колонны – наиболее распространенный тип абсорберов. Преимуществом их является простота устройства, особенно важная при работе с агрессивными средами, так как в этом случае требуется защита от коррозии только корпуса колонны и поддерживающих насадку решеток, насадка же может быть выполнена из химически стойкого материала. Важным преимуществом насадочных колонн более низкое, чем в барботажных абсорберах, гидравлическое сопротивление. Однако насадочные колонны мало пригодны при работе с загрязненными жидкостями, при малых расходах жидкости и при больших тепловыделениях.
1. ТЕХНОЛОГИЧЕСКАЯ СХЕМА
Газовоздушная смесь с помощью газодувки ГД подается в барботажный абсорбер А с ситчатыми тарелками. В верхнюю часть абсорбера центробежным насосом Н подается вода. Вода стекает по насадке вниз, а навстречу ей движется газовоздушная смесь. При взаимодействии фаз аммиак растворяется в воде и воздух очищается. Вода насыщенная аммиаком самотеком поступает в приемную емкость ПЕ, а очищенный воздух выбрасывается в атмосферу.
2. ВЫБОР КОНСТРУКЦИОННОГО МАТЕРИАЛА
Так как водный раствор аммиака при температуре 20 С° является коррозионно активным веществом, то в качестве конструкционного материала для основных деталей выбираем нержавеющую сталь Х18Н10Т ГОСТ 5632-72, которая является стойкой в сильно агрессивных средах до температуры 600°С [4с59].
3. МАТЕРИАЛЬНЫЙ РАСЧЕТ АБСОРБЕРА
3.1. Плотность газовой смеси на входе в аппарат.
Мольная концентрация NH3 в газовой смеси на входе в аппарат:

где МВ = 17 – мол. масса NH3;
МА = 29 – мол. масса воздуха.
Молекулярная масса исходной смеси:
Мсм = МB 

При нормальных условиях:
r0Н = Мсм/ 22,4 = 26,72/22,4 = 1,19 кг/м3,
при рабочих условиях: t = 20° C; Р = 0,1 МПа:
rН = rОНТ0Р/(ТР0) = 1,19×273/293 = 1,11 кг/м3.
3.2. Массовый расход исходной смеси на входе в аппарат:
GН = VrН = 1,39×1,11 = 1,54 кг/с.
V = 5000/3600 = 1,39 м3/с.
3.4. Расход распределяемого компонента и инертного вещества
Gркн = GН
Gин = GН(1 – 
3.5. Масса распределяемого компонента поглощенного водой
М = Gркн0,96 = 0,185×0,96 = 0,178 кг/с
Масса распределяемого компонента в газовой фазе на выходе
Gркк = Gркн – М = 0,185 – 0,178 = 0,007 кг/с
Расход газовой фазы на выходе:
GК = Gн – М = 1,54– 0,178 = 1,362 кг/с.
3.6. Относительная концентрация аммиака на входе и выходе:


3.7. Расход инертной фазы.
С помощью уравнения Генри (1) строим диаграмму 

где Мвод = 18 – молярная масса воды,

0,136 = 17×0,276 

Решая это уравнение получим 
Через точку А ( 



mmin = tgamin = 
Действительный расход воды
m = 1,3mmin = 1,3×1,90 = 2,47 кг/кг,
тогда уравнение рабочей линии будет:

отсюда конечная концентрация аммиака в воде 
Через точки А и С (

 |
Рис.1 Зависимость между концентрацией аммиака в газовоздушной смеси 

Расход воды на входе:
Lин = mGин = 2,47×1,355= 3,347 кг/с.
Расход воды на выходе:
LK = Lин + М = 3,347 + 0,178 = 3,525 кг/с.
Средний расход воды:
Lср = 0,5(Lин + LK) = 0,5×(3,347 + 3,525) = 3,436 кг/с
4. ОПРЕДЕЛЕНИЕ ДИАМЕТРА АБСОБЕРА
4.1. Скорость газа в абсорбере
где ρж = 998 кг/м3 – плотность воды при 20 ºС [1c. 537];
ρг – плотность газовой фазы при средней концентрации.
Молярная концентрация на выходе из аппарата
yк = МВ

Средняя мольная концентрация:
у = 0,5(0,19+0,008) = 0,099.
Средняя молекулярная масса газовой смеси:
М = МАу+(1 – у)МВ = 17×0,099+29×0,901 = 27,81 кг/моль.
Средняя плотность газовой фазы при рабочих условиях:
rг = МТ0Р/(22,4ТР0) = 27,83×273∙0,1/(22,4×293∙01) = 1,16 кг/м3.
w = 0,05(998/1,16)0,5 = 1,47 м/с
4.2. Диаметр абсорбера:
d =
где Gср – средний расход газовой фазы:
Gср = 0,5(GH + GK) = 0,5×(1,54 + 1,362) = 1,451.
d = (4∙1,451/1,47∙π∙1,16)0,5 = 1,04 м.
Принимаем стандартный диаметр колонны 1,0 м, тогда действительное значение рабочей скорости газовой фазы:
wг = 1,47(1,04/1,0)2 = 1,59 м/с.
4.4. Характеристика стандартной тарелки:
Рабочее сечение тарелки – 0,713 м2;
Диаметр отверстий – 5 мм;
Шаг отверстий – 12 мм;
Относительное свободное сечение тарелки – 10%
Сечение перелива – 0,036 м2;
Периметр слива, Lc – 0,8 м;
Масса тарелки 41,5 кг.
5. РАСЧЕТ ВЫСОТЫ АБСОРБЕРА
5.1. Высота светлого слоя жидкости:
h0 = 0,787q0,2hпер0,56wгm[1 – 0,31exp(-0,11μx)]
где hпер = 0,04 м – высота переливной перегородки;
q – линейная плотность орошения;
μх = 1,0 мПа∙с – вязкость воды при 20 ºС [1c,537]
m = 0,05 – 4,6hпер = 0,05 – 4,6∙0,04 = -0,134
q = Q/Lc = 0,0034/0,8 = 0,0043 м3/м∙с
Q = L/ρж = 3,436/998 = 0,0034 м3/с – объемный расход воды
h0 = 0,787∙0,00430,2∙0,040,56∙1,59-0,134[1 – 0,31exp(-0,11∙1,0)] = 0,029 м
5.2. Плотность орошения:
где Sк = 0,785d2 – площадь колонны;
U = 3,436/998∙0,785∙1,02 = 0,0044 м3/м2∙с
5.3. Газосодержание барботажного слоя:
где Fr – критери Фруда:
Fr = w2/gh0 = 1,592/9,8∙0,029 = 8,9
ε = 8,90,5/(1+8,90,5) = 0,75
5.4. Вязкость газовой смеси:
Вязкость воздуха при 20° С

где m0 = 17,3×10-6 Па×с – вязкость воздуха при 0° С [1c. 513],
c = 124 – вспомогательный коэффициент.

Вязкость аммиака при 20° С
где m0 = 9,18×10-6 Па×с – вязкость воздуха при 0° С [1c. 513]
c = 626 – вспомогательный коэффициент

Вязкость газовой смеси найдем найдем из соотношения

27,81 / mсм = 17×0,099/9,98×10-6 + 29×0,901/18,3×10-6
откуда mг = 17,4×10-6 Па×с
5.5. Коэффициенты диффузии
Коэффициент диффузии аммиака в воздухе:

D0 = 17,0×10-6 м2/с – коэффициент диффузии при стандартных условиях.
Коэффициент диффузии аммиака в воде: Dж = 1,8×10-9 м2/с [1c. 540].
5.6. Коэффициент массоотдачи в жидкой фазе:
= 6,24∙105∙(1,8×10-9)0,5[0,0044/(1–0,75)]0.5∙0,029[17,4/(17,4+1000)]0,5 = 0,013 м/с
βжf = 0,0013∙ρж = 0,0013∙998 = 13,3 кг/м2∙с.
5.7. Коэффициент массоотдачи в газовой фазе:
= 6,24∙105∙(18,9×10-6)0,5(1,59/0,75)0.5∙0,029[17,4/(17,4+1000)]0,5 = 14,98 м/с
βгf = 14,98∙ρг = 14,98∙1,16 = 17,4 кг/м2∙с.
5.8. Коэффициент массопередачи:
Kyf = 1/(1/βгf + m/βжf) = 1/(1/17,4+1,97/13,3) = 4,86 кг/м2∙с
где m = 1,97 – коэффициент распределения, равный тангенсу угла на-
клона равновесной линии.
5.9. Движущая сила процесса массопередачи:
Δ

Δ


Δ




(0,032 – 0,005)/ln(0,032/0,005) = 0,0145 кг/кг
5.10. Число тарелок в абсорбере
Суммарная поверхность тарелок:
F = M/KyfΔ
Рабочая площадь тарелки:
f = φ0,785d2 = 0,1∙0,785∙1,02 = 0,0785 м2
где φ = 10% — доля рабочей площади тарелки.
Требуемое число тарелок:
n = F/f = 2,53/0,0785 = 32 шт
5.11. Высота колонны:
где Нт = 0,5 м – расстояние между тарелками;
Z1 = 1,6 м – высота сепарационного пространства;
Z2 = 2,8 м – высота кубового пространства.
Н = 0,5(32-1)+1,6+2,8 = 19,9 м
6. ГИДРАВЛИЧЕСКИЙ РАСЧЕТ КОЛОННЫ
6.1. Гидравлическое сопротивление сухой тарелки
где ζ = 1,5 – коэффициент сопротивления тарелки [2c.44];
φ = 0,1 – относительное свободное сечение колонны.
ΔРс = 1,5∙1,592∙1,16/2∙0,12 = 220 Па
6.2. Гидравлическое сопротивление обусловленное силами поверхностного натяжения:
ΔРσ = 4σ/dэ = 4∙0,07/0,005 = 56 Па
где σ = 0,07 Н/м – поверхностное натяжение воды;
dэ = 0,005 м – диаметр отверстий.
6.3. Гидравлическое сопротивление газожидкостного слоя:
ΔРсл = ρжgh0 = 998∙9,8∙0,029 = 284 Па
6.4. Полное сопротивление тарелки:
ΔРт = ΔРс+ΔРσ+ΔРсл = 220+56+284 = 560 Па.
6.5. Полное сопротивление колонны:
ΔР = 560∙32 = 17920 Па.
6.7. Подбор газодувки и насоса для подачи воды.
Объемный расход газовой смеси на входе в аппарат: V = 1,39 м/с.
По полному сопротивлению колонны и объемному расходу газовой смеси выбираем газодувку ТВ-80-1,2 [3c.42], для которой V=1,67 м3/с, а ΔР = 20000 Па.
Объемный расход воды и напор развиваемый насосом:
Q = Lин/ρж = 3,347/998 = 0,0034 м3/с.
Воду необходимо подать на высоту равную высоте колонны, следовательно Н > 20 м.
По объемному расходу и напору выбираем центробежный насос Х20/31 [3c.38], для которого Q = 0,0055 м3/с и Н=25 м.
7. КОНСТРУКТИВНЫЙ РАСЧЕТ
7.1 Толщина обечайки:

где sд = 138 МН/м2 – допускаемое напряжение [3c 394],
j = 0,8 – коэффициент ослабления из-за сварного шва,
Ск = 0,001 м – поправка на коррозию.
Согласно рекомендациям [4 c24] принимаем толщину обечайки d = 8 мм.
7.2. Днища.
Наибольшее распространение в химическом машиностроении получили эллиптические отбортованные днища по ГОСТ 6533 – 78 [3 c.25], толщина стенки днища d1 =d = 8 мм.
Масса днища mд = 74,3 кг.
Объем днища Vд = 0,162 м3.
7.3. Фланцы.
Соединение обечайки с днищами осуществляется с помощью плоских приварных фланцев по ОСТ 26–428–79 [4c36]:
7.4. Штуцера.
Принимаем скорость жидкости в штуцере w = 1 м/с, а для газовой смеси w = 25 м/с, тогда диаметр штуцера для входа и выхода воды:
d1,2 = (3,436/0,785×1×998)0,5 = 0,066 м,
принимаем d1,2 = 65 мм.
диаметр штуцера для входа и выхода газовой смеси:
d3,4 = (1,451/0,785×25×1,16)0,5 = 0,252 м,
принимаем d3,4 = 250 мм.
Все штуцера снабжаются плоскими приварными фланцами по ГОСТ , конструкция и размеры которых приводятся ниже:
💥 Видео
Рабочие линии Флегмовое числоСкачать

Работа 21. Изучение процесса абсорбцииСкачать

Запись лекции АбсорбцияСкачать

Массообменные процессы. Часть 1. Уровень: начальныйСкачать

❄️Семинар 13. Расчет водяного абсорбера для очистки рабочего газа от двуокиси углеродаСкачать

А - АбсорбцияСкачать

АдсорберыСкачать

Расчетная работа "Тарельчатая ректификационная колонна"Скачать

Перегонка и ректификацияСкачать

Процессы и аппараты. Материальный балансСкачать

Основы массорепедачи. Первая лекцияСкачать

Ректификационная колонна принцип работыСкачать

Чирцов А.С. "Бессильные линии". Уравнения Максвелла. Электромагнитные волны. Оператор. Производная.Скачать

❄️Семинар 5. Расчет ректификационных колонн. Вывод формул и расчет методом Мак-Кеба и ТилеСкачать

Оценка флегмовых чисел ректификационной колонны (минимального и оптимального)Скачать

Уравнение Бернулли гидравликаСкачать

Массообменные процессы. Часть 2. Уровень: начальныйСкачать

Лекция 2 МассопередачаСкачать