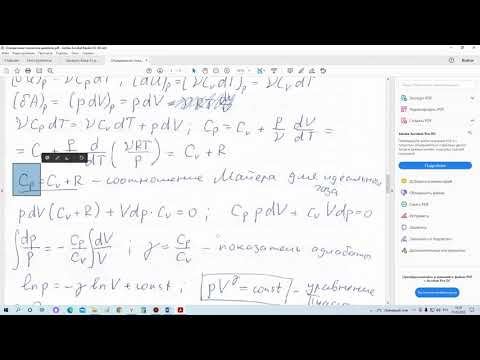
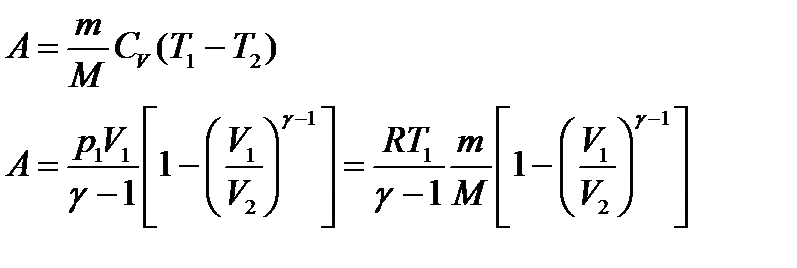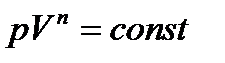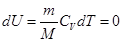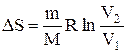Получим уравнение адиабатического процесса, протекающего в идеальном газе. Для этого запишем первое начало термодинамики (1.4). Так как в ходе адиабатического процесса газ не обменивается теплом с окружающей средой: 6Q = 0, будем иметь равенство
В соответствии с формулой (4.21) дифференциал внутренней энергии идеального газа
где теплоемкость газа при постоянном объеме Су будем для простоты считать постоянной величиной, определяемой формулой (4.19).
Используя формулу Майера (4.24), запишем уравнение состояния идеального газа (4.13) так:
Подстановка выражений (4.47) и (4.48) в уравнение (4.46) после несложных преобразований дает

где показатель адиабаты
Нетрудно проверить, что левая часть уравнения (4.49) является дифференциалом функции Для экспериментального определения значения показателя адиабаты 7 Клеман (1779 — 1842) и Дезорм (1777 1862) предложили следующий
метод. Баллон достаточно большой емкости наполняется исследуемым газом при атмосферном давлении Рп (рис. 4.8). При помощи насоса в баллон накачивается небольшая порция того же газа, после чего кран A’l закрывается. Когда температура газа в баллоне сравняется с температурой окружающей среды, измеряют давление Р в баллоне посредством присоединенного к нему манометра. После этого открывают кран К2 и выпускают часть газа из баллона в атмосферу. Этот кран закрывают, когда давление в баллоне станет равным атмосферному. Так как при открытом кране К2 давление в баллоне падает очень быстро, газ не успевает обменяться теплом с окружающей средой. Другими словами, происходит адиабатическое расширение газа и его температура при этом понижается. После закрытия крана К2 температура газа в баллоне начинает медленно повышаться до тех пор, пока не станет равной температуре окружающей среды. При этом давление в баллоне также увеличивается и достигает значения Рз > Р0.
Рис. Jr8. Схема установки для измерения показателя адиабаты у
Видео:29. Адиабатический процесс. Уравнение ПуассонаСкачать

Почему адиабата идет круче изотермы
Здесь легко и интересно общаться. Присоединяйся!
патамушта изотерма это при постоянной температуре а если газ расширяется значит он охлаждается а если изотерма то значит газ нагревается от стенок поэтому и не так круто спадает
давление идеального газа P
T/V и может уменьшаться или за счет роста объема или за счет понижения температуры. в изотермическом процессе действует только первая причина, а в адиабатическом обе одновременно, поэтому в нем давление падает круче.
 |
В адиабатном ( 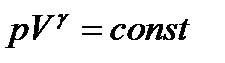
Работа газа в адиабатном процессе
Политропный процесс
Политропный процесс – процесс, в котором теплоемкость остается постоянной.
Уравнение и график политропного процесса
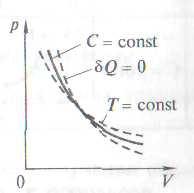
Политропа – график (гипербола) зависимости между параметрами
Состояния C = const.(n – показатель политропы, 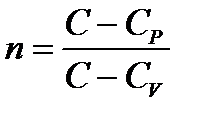
 |
Частные случаи политропного процесса
| С=0 | n=γ | pV γ =const | Уравнение адиабаты |
C= 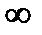 | n=1 | pV=const | Уравнение изотермы |
| C=Cp | n=0 | р=const | Уравнение изобары |
| C=CV | n=± 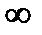 | V=const | Уравнение изохоры |
Дата добавления: 2016-12-16 ; просмотров: 8736 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Первое начало термодинамики
Это условие на практике неосуществимо. Оно выполняется только для быстро протекающих процессов.
Адиабатный процесс
Адиабатный и политропный процессы
Теплота
Внутренняя энергия
Все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил.
При Т=const внутренняя энергия идеального газа не изменяется.
Адиабатный процесс – процесс, при котором отсутствует теплообмен между системой и окружающей средой.
В случае адиабатного процесса система совершает работу за счет убыли внутренней энергии системы.
Уравнение адиабатного процесса (уравнение Пуассона)
Уравнения адиабатного процесса в переменных Т, V и р, Т
Показатель адиабаты (показатель Пуассона)
Для одноатомных газов i =3, ɣ = 1,67; для двухатомных – i = 5; ɣ = 1,4.
i – число степеней свободы; 
Адиабата – в координатах p,V – это гипербола.
 |
В адиабатном ( 
Дата добавления: 2017-01-14 ; Просмотров: 1235 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Видео:Основы теплотехники. Термодинамические процессы. Изохорный, изобарный, изотермический, адиабатный.Скачать

Адиабатический процесс. Политропный процесс.
Адиабатическим называется процесс, при котором отсутствует теплообмен (dQ=0) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстро протекающие процессы. Например, адиабатическим процессом можно считать процесс в двигателях внутреннего сгорания(расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т.д.
Из первого начала термодинамики (dQ=dU+dA) для адиабатического процесса следует, что
dА=-dU, (2.6.1)
т.е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражение для произвольной массы газа перепишем уравнение в виде
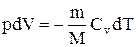
Продифференцировав уравнение состояния для идеального газа 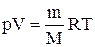
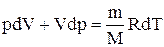
Исключим из (2.6.2) и (2.6.3) температуру Т:
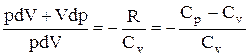
Разделив переменные и учитывая, что 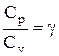
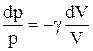
Интегрируя это уравнение в пределах от p1 до р2 и соответственно от V1 до V2, а затем потенцируя, придем к выражению
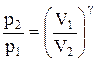
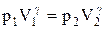
Так как состояния 1 и 2 выбраны произвольно, то можно записать
PV g =const. (2.6.4)
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
Для перехода к переменным Т, V или р, Т исключим из (2.6.4) с помощью уравнения Клапейрона-Менделеева:
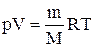
соответственно давление или объем:
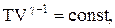
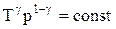
Эти выражения представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина
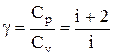
называется показателем адиабаты (или коэффициентом Пуассона). Для одноатомных газов (Ne, He и др.), достаточно хорошо удовлетворяющих условию идеальности, i=3, g =1,67. Для двухатомных газов (Н2, N2, О2 и др.) i=5, g =1,4. Значения вычисленные по формуле (2.6.7), хорошо подтверждаются экспериментом.
Диаграмма адиабатического процесса (адиабат а) в координатах р, V изображается гиперболой (рис. 2.6.1).
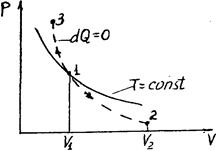 Рис. 2.6.1 Рис. 2.6.1 | На рисунке видно, что адиабата ( 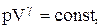 ) более крута, чем изотерма (pV=const). Это объясняется тем, что при адиабатическом сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. ) более крута, чем изотерма (pV=const). Это объясняется тем, что при адиабатическом сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. |
Вычислим работу, совершаемую газом в адиабатическом процессе.
Запишем уравнение в виде
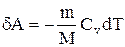
Если газ адиабатически расширяется от объема V1 до V2, то его температура уменьшается от T1 до Т2 и работа расширения идеального газа
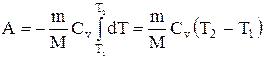
Применяя те же приемы, выражение (2.6.8) для работы при адиабатическом расширении можно преобразовать к виду
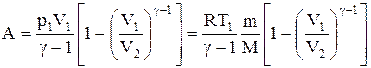
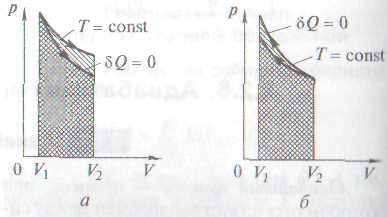
Работа, совершаемая газом при адиабатическом расширении 1-2 (определяется заштрихованной площадью, выполненной на рис. 61), меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны Сv и Сp, в изотермическом процессе (dT=0) теплоемкость равна ±¥, в адиабатическом (dQ=0) теплоемкость равна нулю. Процесс, в котором теплоемкость остается постоянной, называется политропным.
Исходя из первого начала термодинамики при условии постоянства теплоемкости (C=const), можно вывести уравнение политропы:
pV n =const, (2.6.9)
где 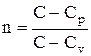
2.7 Круговой процесс (цикл).
Обратимые и необратимые процессы.
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (рис. 2.7.1).
Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1-2) и сжатия (2-1) газа. Работа расширения (определяется площадью фигуры 1а2V2V1) положительна (dV > 0), работа сжатия (определяется площадью фигуры 2blV1V22) отрицательна (dV 0 (цикл протекает по часовой стрелке), то он называется прямым (рис. 2.7.1,а), если за цикл совершается отрицательная работа 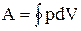
Выражения (2.8.3) и (2.8.4) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. Соотношения (2.8.3) и (2.8.4) можно представить в виде неравенства Клаузиуса
DS 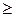
т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Если система совершает равновесный переход из состояния 1 в состояние 2, то, согласно (2.8.2), изменение энтропии
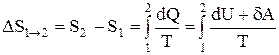
где подынтегральное выражение и пределы интегрирования надо выразить через величины, характеризующие исследуемый процесс. Формула (2.8.6) определяет энтропию лишь с точностью до аддитивной постоянной.
Физический смысл имеет не сама энтропия, а разность энтропии.
Исходя из выражения (2.8.6), найдем изменение энтропии в процессах идеального газа. Так как
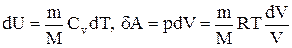
то 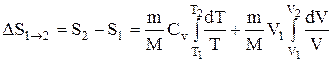
или 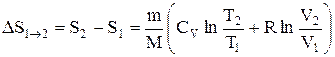
т.е. изменение энтропии 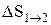
Так как для адиабатического процесса dQ=0, то DS=0 и, следовательно, S=const, т.е. адиабатический обратимый процесс протекает при постоянной энтропии. Из формулы (2.8.7) следует, что при изотермическом процессе (T1=T2)
при изохорном процессе (V1 =V2)
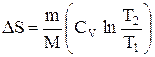
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропии тел, входящих в систему.
Более глубокий смысл энтропии вскрывается в статистической физике, энтропия связывается с термодинамической вероятностью состояния системы. Термодинамическая вероятность W состояния системы — это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние.
Согласно Больцману, энтропия S системы и термодинамическая вероятность связаны между собой следующим образом:
S=kInW, (2.8.8)
где k — постоянная Больцмана. Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние. Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Формула Больцмана позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы. В самом деле, чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия — наиболее вероятного состояния системы — число микросостояний максимально, при этом максимальна и энтропия.
Так как реальные процессы необратимы, то можно утверждать, что все
процессы в замкнутой системе ведут к увеличению ее энтропии — принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных к более вероятным.
Сопоставляя выражения (2.8.5) и (2.8.8), видим, что энтропия и термодинамическая вероятность состояний замкнутой системы могут либо возрастать (в случае необратимых процессов), либо оставаться постоянными (в случае обратимых процессов).
Отметим, однако, что эти утверждения имеют место для систем, состоящих из очень большого числа частиц, но могут нарушаться в системах с малым числом частиц. Для «малых» систем могут наблюдаться флуктуации, т.е. энтропия и термодинамическая вероятность состояний замкнутой системы на определенном отрезке времени могут убывать, а не возрастать, или оставаться постоянными.
🔍 Видео
Адиабатный процесс. 10 класс.Скачать

30. Политропические процессыСкачать

Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Термодинамика Л3.1. Политропический процесс. Термодинамические циклы и КПДСкачать

Физика. Термодинамика: Адиабатный процесс. Центр онлайн-обучения «Фоксфорд»Скачать

Физика 10 класс. Адиабатный процесс.Скачать

Политропный процессСкачать

Обобщение политропных процессовСкачать

Адиабатный процессСкачать

9. Уравнение ПуассонаСкачать

мкт ИЗОТЕРМИЧЕСКИЙ процесс ИЗОХОРНЫЙ процесс ИЗОБАРНЫЙ процессСкачать

Адиабатное расширениеСкачать

Селиверстов А. В. - Молекулярная физика - Семинар 20Скачать

Определение показателя адиабатыСкачать
Урок 178. Тепловые двигатели и их КПД. Цикл КарноСкачать

Термодинамика - Лекция 3Скачать

ЧК_МИФ_ФМЛ_30 _ 2_2_5_2. АДИАБАТИЧЕСКИЙ ПРОЦЕСССкачать

ЧК_МИФ ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИСкачать