Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
- Электролизер
- Электролиз расплава NaCl
- Электролиз водного раствора NaCl
- Процесс на катоде
- Процесс на аноде
- Электролиз солей — количественные аспекты
- 1 закон Фарадея
- 2 закон Фарадея
- Электролиз
- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- Электролиз растворов и расплавов солей (2 ч)
- 💡 Видео
Видео:электролиз хлорида натрияСкачать
Электролизер
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав или водный раствор соли. Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
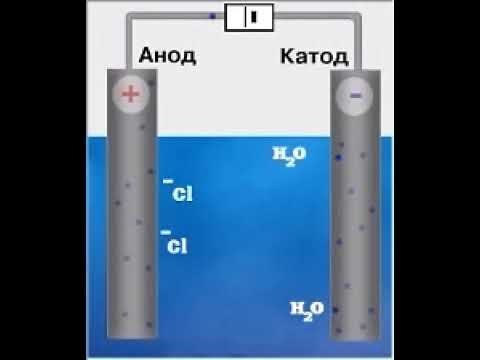
Электролиз расплава NaCl
При электролизе расплава NaCl на отрицательном электроде (катоде) происходит присоединение электронов ионом натрия Na + и его восстановление. При этом вблизи электрода концентрация ионов Na + уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na + .
Аналогично происходит миграция ионов Cl — к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2Na + + 2e — → 2Na 0 |
| 2Na + + 2Cl — → 2Na 0 + Cl2 0 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
Сложнее протекает электролиз водных растворов электролитов.
Электролиз водного раствора NaCl
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2H 2 O + 2e — → H2 0 +2OH — |
| 2H2O + 2Cl — → H2 0 + Cl2 0 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Видео:Электролиз водного раствора хлорида натрияСкачать

Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu 2+ , Hg2 2+ , Ag + , Hg 2+ , Pt 2+ до Pt 4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li + , Na + … до Al 3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn 2+ , Zn 2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu 2+ , Ag + , Zn 2+ сначала восстановится Ag + (E = +0,79 В), затем Cu 2+ (E = +0,337 В) и только потом Zn 2+ (E = +0,76 В).
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
- При электролизебескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl — -2e — = Cl2
- При электролизекислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e — = O2 + 4H +
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO3 2- + H2O -2e — = SO4 2- + 2H +
В таблице ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом | CuBr2 + H2O = Cu + Br2 + H2O K: Cu 2+ + 2e — = Cu | ||||||||||||||||||||||||||||||||
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом | K2SO4 + 2H2O = K2SO4 + 2H2 + O2 Т.е. происходит разложение воды | ||||||||||||||||||||||||||||||||
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом | KI + H2O = 2KOH + H2 + I2 | ||||||||||||||||||||||||||||||||
| Водный раствор соли малоактивного металла с анодом из того же металла | CuSO4 K: Cu 2+ + 2e — = Cu A: Cu — 2e — = Cu 2+ Видео:Электролиз растворов. 1 часть. 10 класс.Скачать  Электролиз солей — количественные аспектыСвязь между количеством вещества, выделившегося при электролизе соли и количеством прошедшего через него электричества отражена в законах Фарадея. 1 закон Фарадея
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества. 2 закон Фарадея
Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея. m – масса вещества, Э – электрохимический эквивалент, t – время электролиза. Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом. Задачи с решениями на составление уравнений электродных реакций, протекающих при электролизе, а также на применение законов Фарадея приведены в разделе Задачи к разделу Электролиз солей Видео:Электролиз раствора хлорида натрия | ЕГЭ по химииСкачать  ЭлектролизВидео:Электролиз NaClСкачать  ЭлектролизХимические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита. Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну . Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды . Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания. При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя. Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита . Видео:Электролиз. 10 класс.Скачать  Электролиз растворовРазличают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях. Катодные процессыВ растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений : Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю. Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + . При электролизе растворов солей на катоде наблюдаются следующие закономерности: 1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная: 2H2O +2ē → H2 + 2OH — Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды. 2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода: Me n+ + nē → Me 0 2 H + 2O +2ē → H2 0 + 2OH — Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород: Fe 2+ + 2ē → Fe 0 2 H + 2O +2ē → H2 0 + 2OH — 3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл: Me n+ + nē → Me 0 Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь: Cu 2+ + 2ē → Cu 0 4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода: 2H + + 2ē → H2 0 Анодные процессыПоложительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ). При электролизе растворов солей на аноде наблюдаются следующие закономерности: 1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0): неМе n- – nē = неМе 0 Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы: 2Cl — – 2ē = Cl2 0 Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы : 2H2 O -2 – 4ē → O2 0 + 4H + 2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода: 2H2 O -2 – 4ē → O2 0 + 4H + 3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода: 4 O -2 H – – 4ē → O2 0 + 2H2O 4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан. Например , при электролизе растворов ацетатов выделяется углекислый газ и этан: 2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3 Суммарные процессы электролизаРассмотрим электролиз растворов различных солей. Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди: Катод (–): Cu 2+ + 2ē → Cu 0 На аноде окисляются молекулы воды: Анод (+): 2H2 O -2 – 4ē → O2 + 4H + Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты: 2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0 Электролиз раствора хлорида натрия выглядит так: На катоде восстанавливается водород: Катод (–): 2 H + 2O +2ē → H2 0 + 2OH – На аноде окисляются хлорид-ионы: Анод (+): 2 Cl – – 2ē → Cl2 0 Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия : 2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0 Следующий пример : электролиз водного раствора карбоната калия. На катоде восстанавливается водород из воды: Катод (–): 2 H + 2O +2ē → H2 0 + 2OH – На аноде окисляются молекулы воды до молекулярного кислорода: Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H + Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды: 2 H2 + O -2 → 2 H2 0 + O2 0 Еще один пример : электролиз водного раствора хлорида меди (II). На катоде восстанавливается медь: Катод (–): Cu 2+ + 2ē → Cu 0 На аноде окисляются хлорид-ионы до молекулярного хлора: Анод (+): 2 Cl – – 2ē → Cl2 0 Таким образом, при электролизе раствора карбоната калия происходит электролиз воды: Cu 2+ Cl2 – → Cu 0 + Cl2 0 Еще несколько примеров: электролиз раствора гидроксида натрия. На катоде восстанавливается водород из воды: Катод (–): 2 H + 2O +2ē → H2 0 + 2OH – На аноде окисляются гидроксид-ионы до молекулярного кислорода: Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют: 2 H2 + O -2 → 2 H2 0 + O2 0 Видео:Задача на электролиз 2018. Для проведения электролиза взяли 312 г 15-ного раствора хлорида натрия.Скачать  Электролиз расплавовПри электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет. Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия: Катод (–): Na + + ē → Na 0 На аноде окисляются анионы хлора: Анод (+): 2 Cl – – 2ē → Cl2 0 Суммарное уравнение электролиза расплава хлорида натрия: 2 Na + Cl – → 2 Na 0 + Cl2 0 Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия: Катод (–): Na + + ē → Na 0 На аноде окисляются гидроксид-ионы: Анод (+): 4 OH – – 4ē → O2 0 + 2H2O Суммарное уравнение электролиза расплава гидроксида натрия: 4 Na + OH – → 4 Na 0 + O2 0 + 2H2O Многие металлы получают в промышленности электролизом расплавов. Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите. В растворе криолите оксид алюминия диссоциирует на ионы: На катоде восстанавливаются катионы алюминия: Катод (–): Al 3+ + 3ē → Al 0 На аноде окисляются алюминат-ионы: Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0 Общее уравнение электролиза раствора оксида алюминия в расплаве криолита: 2 Al 2 О 3 = 4 Al 0 + 3 О 2 0 В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде: C 0 + О2 0 = C +4 O2 -2 Видео:правильный электролизерСкачать  Электролиз с растворимыми электродамиЕсли материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода. Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами. На катоде разряжаются ионы меди из раствора: Катод (–): Cu 2+ + 2ē → Cu 0 На аноде окисляются частицы меди из электрода : Анод (+): Cu 0 – 2ē → Cu 2+ Видео:Металлы. Тема 39. Электролиз расплавов солей. Видеоопыт «Электролиз раствора хлорида меди»Скачать  Электролиз растворов |
| Вариант | Вопрос 1 | Вопрос 2 | Вопрос 3 | Вопрос 4 | Вопрос 5 |
| 1 | а | б | б | а | б |
| 2 | б | б | а | а | б |
| 3 | а | в | а | в | а |
| 4 | б | в | а | а | а |

1. Для защиты металлических изделий от коррозии на их поверхность наносят тончайший слой другого металла: хрома, серебра, золота, никеля и т.д. Иногда, чтобы не расходовать дорогие металлы, производят многослойное покрытие. Например, внешние детали автомобиля сначала покрывают тонким слоем меди, на медь наносят тонкий слой никеля, а на него – слой хрома.
При нанесении покрытий на металл электролизом они получаются ровными по толщине, прочными. Таким способом можно покрывать изделия любой формы. Эту отрасль прикладной электрохимии называют гальваностегией.
2. Кроме защиты от коррозии гальванические покрытия придают красивый декоративный вид изделиям.
3. Другая отрасль электрохимии, близкая по принципу к гальваностегии, названа гальванопластикой. Это процесс получения точных копий различных предметов. Для этого предмет покрывают воском и получают матрицу. Все углубления копируемого предмета на матрице будут выпуклостями. Поверхность восковой матрицы покрывают тонким слоем графита, делая ее проводящей электрический ток.
Полученный графитовый электрод опускают в ванну с раствором сульфата меди. Анодом служит медь. При электролизе медный анод растворяется, а на графитовом катоде осаждается медь. Таким образом получается точная медная копия.
С помощью гальванопластики изготавливают клише для печати, грампластинки, металлизируют различные предметы. Гальванопластика открыта русским ученым Б.С.Якоби (1838).
Изготовление штампов для грампластинок включает нанесение тончайшего серебряного покрытия на пластмассовую пластинку, чтобы она стала электропроводной. Затем на пластинку наносят электролитическое никелевое покрытие.
Чем следует сделать пластинку в электролитической ванне – анодом или катодом?
(О т в е т. Катодом.)
4. Электролиз используют для получения многих металлов: щелочных, щелочно-земельных, алюминия, лантаноидов и др.
5. Для очистки некоторых металлов от примесей металл с примесями подключают к аноду. Металл растворяется в процессе электролиза и выделяется на металлическом катоде, а примесь остается в растворе.
6. Электролиз находит широкое применение для получения сложных веществ (щелочей, кислородсодержащих кислот), галогенов.
 |
 |





 Na + + Cl – ;
Na + + Cl – ; .
. + O2
+ O2 
 (Cu) = 8/64 = 0,125 моль,
(Cu) = 8/64 = 0,125 моль, Ag
Ag 










