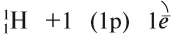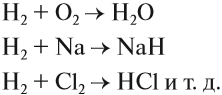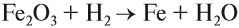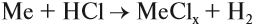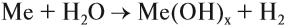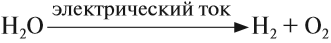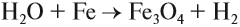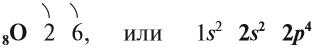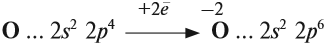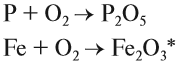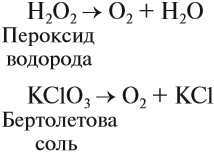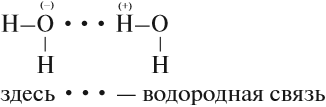- Синтез воды это
- Горение водорода в кислороде
- Определение содержания кислорода в воздухе
- Процедура электролиза воды, методики, для чего она, домашний эксперимент
- Реакция электролиза
- Полуклеточные реакции
- процесс
- методы
- Электролиз щелочной водой
- Электролиз с полимерной электролитической мембраной
- Электролиз с твердыми оксидами
- Какая польза от электролиза воды?
- Производство водорода и его использование
- Как метод отладки
- В качестве источника кислорода
- Домашний эксперимент
- Домашние переменные
- Урок 12. Водород и кислород
- Водород
- Кислород
- Выводы
- 🎥 Видео
Видео:Взаимодействие кислорода с водородомСкачать

Синтез воды это
Это химические реакции взаимодействия атомов кислорода с атомами водорода, причем в результате синтеза воды образуется большое количество энергии в виде взрыва.
Образование воды при горении водорода в кислороде (воздухе) послужило доказательством состава воды как сложного вещества, состоящего из двух химических элементов — водорода и кислорода.
Схема установки для синтеза воды из простых веществ изображена на рисунке 2.
Приступая к выполнению опыта в собранной установке, прежде всего убеждаются в чистоте водорода, после чего его поджигают на конце Г-образной трубки 1, подводя ее под воронку 2. Включают водоструйный насос 4, соединенный с предохранительной двугорлой склянкой 5. Через некоторое время в дугообразной трубке 3 собирается немного жидкости. Водоструйный насос останавливают и прекращают ток водорода.
Образовавшийся продукт реакции идентифицируют, внося в приемник небольшое количество безводного сульфата меди. Появление голубого окрашивания (образование медного купороса) свидетельствует о том, что полученная в опыте жидкость — вода.

Для опытов собирают установку согласно рисунку 3. В качестве реактора используют со суд без дна (рис. 3, а) из набора НПХ или универсальную го релку (рис. 3,6).
Горение водорода в кислороде
Водород из прибора для получения газов 1 проверяют начистоту. Заполняют реактор 2 кислородом из газометра 3. Проверяют наполнение реактора 2 кислородом, поднося к его отверстию тлеющую лучинку. Поджигают водород на конце газоотводной трубки, не прекращая подачи кислорода из газометра.

Рис. 3. Установка для сжигания водорода и кислорода друг в друге:
а —горение водорода в кислороде: 1 — прибор для получения газов, 2 — реактор, 3 — газометр; б — универсальная горелка; в — горение кислорода в водороде.
Если пламя кислорода внутри реактора 2 погасло, немедленно закрывают кран аппарата для получения водорода. Повторять опыт можно после остывания колокола-реактора.
Чтобы установить, в каких объемных отношениях водород и кислород взаимодействуют с образованием паров воды, берут для взрыва определенные объемы газов и после реакции устанавливают, какой газ остался неизрасходованным и какой он занимал объем. Опыт проводят в эвдиометре — толстостенной трубке с дном и впаянными электродами. В настоящее время промышленный эвдиометр не может быть использован в школе из-за отсутствия безопасного высоковольтного преобразователя, который сейчас разрабатывается.
В качестве индуктора может быть использован пьезоэлектрический высоковольтный преобразователь . Верхний конец этой трубки плотно закрыт резиновой пробкой через которую продеты две проволоки. Верхние концы их присоединены вилке для подключения к источник тока (в сеть), а нижние концы загнуты. В них продета и укреплена тон чайшая медная проволочка-волосок В нижний конец трубки вставлена ре зиновая пробка 5 с узким отверстием, чтобы уменьшить поток воды в трубку (после взрыва) и таким образом предотвратить возможность выброса верхней пробки. Пробка не должна доходить до дна чаши 6 на 4—5 мм.

Взрыв кислородно-водородной смеси можно осуществить с помощью пьезоэлектрического источника электрического тока, используя насадку для воспламенения газов.
Если для взрыва были взяты одинаковые объемы кислорода и водорода, то после реакции остался один объем кислорода, (это доказывается вспыхиванием тлеющей лучинки). Следовательно, объемы вступающих в реакцию газов — водорода и кислорода—относятся как 2:1. Принимают во внимание, что кислород в 16 раз тяжелее водорода (это видно из сравнения плотности 1,44:0,089=16:1) и что соотношение объемов кислорода и водорода 1:2. Делают вывод, что массовые отношения этих эле ментов в воде 16:2, или 8 : 1 (или 88,9% О и 11,1 % Н).
Рис. 4. Установка для синтеза воды в искровом разряде:
1 — трубка-реактор, 2 —электроды, 3 — трубка с зажимом, 4 — воронка.
Для этого опыта и для разложения метана в искровом разряде можно использовать установку, изображенную на рисунке 4. Реактор 1, разделенный на четыре равные по объему части, заполняют водой через воронку 4 до появления капель воды из трубки при открытом зажиме 3. Затем реактор 1 через верхнюю трубку с зажимом 3 заполнят сначала двумя объемами водорода (из аппарата Киппа), а затем двумя объемами кислорода (из газометра). Электроды присоединяют к источнику тока. Вместо выпрямителя ВС-24М (В-24) можно использовать батарейку КБС. Искра получается при повороте одного из электродов на 180° до замыкания и размыкания цепи. После взрыва наличие оставшегося кислорода доказывают по воспламенению тлеющей лучинки, поднесенной к отверстию трубки 3. Для вытеснения кислорода из реактора воронку поднимают вверх при открытом зажиме.
Меры предосторожности. Перед наполнением реактора водород проверяют на чистоту. Во избежание выплескивания при взрыве воды из воронки ее накрывают листом мокрой фильтровальной бумаги.
Определение содержания кислорода в воздухе
Эксперименты по определению состава воздуха сыграли важную роль в развитии химии как науки, что нашло отражение и в учебной литературе по химии. Разработаны в связи с этим многочисленные учебные опыты по определению состава воздуха. Все они основаны на том, что воздух состоит из двух основных компонентов: один из них легко вступает во многие химические реакции (кислород), тогда как второй компонент смеси (атмосферный азот)—вещество Значительно менее реакционноспособное. Для демонстрации малопригодны исторические опыты с использованием электрических разрядов и поглощением образовавшихся оксидов азота ввиду их сложности и длительности. В учебных опытах используют для связывания кислорода легкоокисляющееся вещество — фосфор.
Сжигание фосфора в закрытом пространстве (стеклянный колпак-колокол, склянка с отрезанным дном) — традиционный школьный опыт,для определения состава воздуха. Техника выполнения этого опыта приведена во многих руководствах по химическому эксперимент, а также в школьных учебниках по химии, Этим способом состав воздуха определяют приблизительно.
Содержание кислорода в воздухе можно определить, если вме сте фосфора использовать медь (рис. 30). Простейший опыт состоит в нагревании порошка меди, помещенного на дно пробирки 1, градуированной на 5 равных частей и плотно закрытой ре зиновой пробкой с газоотводной трубкой, опущенной в стакан с водой. При нагревании кислород, содержащийся в пробирке 1, соединяется с медью. После охлаждения пробирки при открытом кране 2 вода засасывается на 1 /5 часть ее вместимости. Более точные результаты могут быть получены при использовании усовершенствованной установки опыт проводят в двух градуированных цилиндрах 1, 5 объемом по 500 мл каждый. В трубке помещена «колбаска» из свеже-восстановленной медной сетки.
Левый цилиндр 1 заполонен воздухом, правый — подкрашенной водой и погружен вверх дном в чашу с водой. Делительную воронку 2 заполняют водой, а трубку с медной сеткой сильно нагревают. Выде ляющиеся пузырьки газа сразу не следует собирать в цилиндр. После того как выделение газа прекратилось, цилиндр помещают на газоотводную трубку. В левый цилиндр начинают приливать воду с такой скоростью, чтобы на вытес нение 500 мл воздуха потребовалось 10—15 мин. После приливания 500 мл воды кран воронки закрывают. В правом цилиндре 5 собирается только 4 /5 вытесненного объема воздуха.
Пробку с газоотводной трубкой 4 отделяют от реакционной трубки, после чего прекращают нагревание.
Заслуживают внимания опыты по определению состава воздуха с использованием медицинских шприцев. В настоящее время для учебных целей созданы специальные шприцы — стеклянные поршневые дозаторы. С их помощью могут быть выполнены многие количеств венные опыты, в том числе и по определению состава воздуха. Для наглядности их следует использовать при проецировании некоторых опытов на экран с помощью графопроектора .
Статья на тему Синтез воды
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

Процедура электролиза воды, методики, для чего она, домашний эксперимент
электролиз воды это разложение воды на ее элементарные составляющие под действием электрического тока. При этом водород и молекулярный кислород образуются на двух инертных поверхностях, H2 и O2. Эти две поверхности более известны под названием электродов.
Теоретически, объем Н2 образуется должен быть в два раза больше объема O2. Почему? Поскольку молекула воды имеет отношение H / O, равное 2, то есть два H для каждого кислорода. Это соотношение проверяется непосредственно с помощью его химической формулы H2О. Однако многие экспериментальные факторы влияют на полученные объемы.
Если электролиз проводят внутри труб, погруженных в воду (верхнее изображение), столб воды меньшей высоты соответствует водороду, поскольку на поверхности жидкости присутствует большее количество газа, оказывающего давление. Пузырьки окружают электроды и в конечном итоге поднимаются после истечения давления пара воды.
Обратите внимание, что трубки отделены друг от друга таким образом, что существует низкая миграция газов от одного электрода к другому. В низких масштабах это не представляет неизбежного риска; но в промышленных масштабах газовая смесь Н2 и O2 Это очень опасно и взрывоопасно.
По этой причине электрохимические ячейки, в которых проводится электролиз воды, очень дороги; им нужны конструкция и элементы, которые гарантируют, что газы никогда не смешиваются, выгодная подача тока, высокая концентрация электролитов, специальные электроды (электрокатализаторы) и механизмы для хранения H.2 произведенный.
Электрокатализаторы представляют собой трение и в то же время крылья для прибыльности электролиза воды. Некоторые состоят из оксидов благородных металлов, таких как платина и иридий, цены на которые очень высоки. Именно в этот момент исследователи объединяют усилия для разработки эффективных, стабильных и дешевых электродов..
Причиной этих усилий является ускорение образования О2, который дается на более низких скоростях по сравнению с H2. Это замедляется электродом, где образуется О2 как общее следствие, применение потенциала намного больше, чем необходимо (перенапряжение); что то же самое, чтобы снизить производительность и более высокие расходы.
- 1 Реакция электролиза
- 1.1 Полуклеточные реакции
- 2 Процедура
- 3 Техники
- 3.1 Электролиз щелочной водой
- 3.2 Электролиз с полимерной электролитической мембраной
- 3.3 Электролиз с твердыми оксидами
- 4 Какая польза от электролиза воды??
- 4.1 Производство водорода и его использование
- 4.2 Как метод отладки
- 4.3 Как поставка кислорода
- 5 Домашний эксперимент
- 5.1 Домашние переменные
- 6 Ссылки
Видео:🔥 ЭЛЕКТРОЛИЗ ВОДЫ. ЛУЧШИЕ ЭЛЕКТРОДЫ ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА И КИСЛОРОДА.Скачать

Реакция электролиза
Электролиз воды включает в себя много сложных аспектов. Однако в общих чертах его основа лежит в простой глобальной реакции:
Как видно из уравнения, вмешиваются две молекулы воды: одну обычно нужно уменьшить или получить электроны, а другую — окислить или потерять электроны..
H2 Это продукт восстановления воды, потому что усиление электронов способствует протонов H + может быть ковалентно связан, и кислород превращается в ОН — . Поэтому Н2 происходит на катоде, который является электродом, где происходит восстановление.
В то время как O2 происходит от окисления воды, потому что она теряет электроны, которые позволяют ей связываться с водородом, и, следовательно, высвобождает протоны H + . O2 происходит на аноде, электроде, где происходит окисление; и в отличие от другого электрода, pH вокруг анода является кислым, а не основным.
Полуклеточные реакции
Вышеизложенное можно обобщить следующими химическими уравнениями для полуклеточных реакций:
2H2O + 2e — => H2 + 2OH — (Катод, основной)
2H2O => O2 + 4H + + 4e — (Анод, кислота)
Однако вода не может потерять больше электронов (4e — ) из которых другая молекула воды побеждает на катоде (2e — ); следовательно, первое уравнение должно быть умножено на 2, а затем вычтено со вторым уравнением, чтобы получить чистое уравнение:
Но 4Н + и 4OH — они образуют 4H2Или, таким образом, они устраняют четыре из шести молекул H2Или оставив два; и в результате глобальная реакция только что изложил.
Реакции полуэлемента изменяются в зависимости от значений рН, методов, а также имеют потенциальные потенциалы восстановления или окисления, которые определяют, какой ток необходимо подавать, чтобы электролитический процесс воды происходил самопроизвольно..
Видео:Опыты по химии. Взрыв кислорода с водородомСкачать

процесс
На верхнем изображении показан вольтметр Хоффмана. Цилиндры заполняются водой и выделенными электролитами через среднее сопло. Роль этих электролитов заключается в повышении проводимости воды, потому что в нормальных условиях очень мало ионов H3О + и ОН — продукты вашего авто ионизации.
Два электрода обычно платиновые, хотя на изображении они были заменены угольными электродами. Оба связаны с батареей, с которой применена разность потенциалов (ΔV), которая способствует окислению воды (образование O).2).
Электроны перемещаются по всему контуру, пока вы не достигнете другого электрода, где вода выигрывает и становится Н2 и ОН — . На данный момент анод и катод уже определены, которые могут быть дифференцированы по высоте водяных столбов; тот, который имеет меньшую высоту, соответствует катоду, где образуется Н2.
В верхней части цилиндров есть несколько клавиш, позволяющих выпускать образующиеся газы. Вы можете тщательно проверить наличие H2 заставляя его реагировать с пламенем, сгорание которого дает газообразную воду.
Видео:Реакция водорода с кислородомСкачать

методы
Методы электролиза воды варьируются в зависимости от количества Н2 и O2 что предлагается генерировать. Оба газа очень опасны, если их смешивать друг с другом, и поэтому электролизеры имеют сложную конструкцию, чтобы минимизировать увеличение газовых давлений и их диффузию через водную среду..
Кроме того, методы колеблются в зависимости от элемента, электролита, добавляемого в воду, и самих электродов. С другой стороны, некоторые подразумевают, что реакция проводится при более высоких температурах, уменьшая потребление электроэнергии, а другие используют огромные давления для поддержания H.2 хранится.
Среди всех методов можно упомянуть следующие три:
Электролиз щелочной водой
Электролиз проводят с основными растворами щелочных металлов (КОН или NaOH). С помощью этой техники происходят реакции:
Как видно, как на катоде, так и на аноде вода имеет основной pH; и кроме того, ОН — мигрировать на анод, где они окисляются до O2.
Электролиз с полимерной электролитической мембраной
В этой технике используется твердый полимер, который служит проницаемой мембраной для H + , но водонепроницаемый для газов. Это гарантирует большую безопасность при электролизе.
Полуклеточные реакции для этого случая:
Ионы Н + они мигрируют от анода к катоду, где они уменьшаются, чтобы стать H2.
Электролиз с твердыми оксидами
Очень отличающийся от других методов, он использует оксиды в качестве электролитов, которые при высоких температурах (600-900ºC) функционируют в качестве среды переноса анионов. 2- .
Обратите внимание, что на этот раз оксидные анионы, или 2- , те, кто путешествует на анод.
Видео:Свойства и применение водорода. 8 класс.Скачать

Какая польза от электролиза воды?
Электролиз воды дает H2 (г) и О2 (G). Приблизительно 5% газообразного водорода, производимого в мире, образуется в результате электролиза воды..
H2 это побочный продукт электролиза водных растворов NaCl. Присутствие соли облегчает электролиз за счет увеличения электропроводности воды.
Глобальная реакция, которая имеет место:
Чтобы понять огромную важность этой реакции, будут упомянуты некоторые виды использования газообразных продуктов; потому что, в конце концов, именно они стимулируют разработку новых методов для достижения электролиза воды более эффективным и экологичным способом..
Из всех них наиболее желательным является использование ячеек, которые энергетически заменяют использование сжигания ископаемого топлива..
Производство водорода и его использование
-Водород, получаемый при электролизе, может быть использован в химической промышленности, действующей в реакциях зависимости, в процессах гидрирования или в качестве восстановителя в процессах восстановления..
-Кроме того, это важно в некоторых действиях, имеющих коммерческое значение, таких как: производство соляной кислоты, перекиси водорода, гидроксиламинов и т. Д. Участвует в синтезе аммиака по каталитической реакции с азотом.
-В сочетании с кислородом он производит пламя с высокой калорийностью, с температурами в диапазоне от 3000 до 3500 К. Эти температуры могут использоваться для резки и сварных швов в металлургической промышленности, для роста синтетических кристаллов, производства кварца и т. Д..
-Обработка воды: слишком высокое содержание нитратов в воде может быть уменьшено путем их удаления в биореакторах, в которых бактерии используют водород в качестве источника энергии
-Водород вмешивается в синтез пластмасс, полиэстера и нейлона. Кроме того, он является частью производства стекла, увеличивая сгорание во время выпекания.
-Реагирует с оксидами и хлоридом многих металлов, в том числе серебра, меди, свинца, висмута и ртути с образованием чистых металлов.
-И, кроме того, он используется в качестве топлива в хроматографических анализах с детектором пламени..
Как метод отладки
Электролиз растворов хлорида натрия используется для очистки воды бассейна. Во время электролиза водород образуется в катоде и хлоре (Cl2) на аноде. Говорят об электролизе в этом случае как хлоратор соли.
Хлор растворяется в воде с образованием хлорноватистой кислоты и гипохлорита натрия. Хлорноватистую кислоту и гипохлорит натрия стерилизуют водой.
В качестве источника кислорода
Электролиз воды также используется для генерации кислорода на Международной космической станции, которая служит для поддержания кислородной атмосферы на станции..
Водород можно использовать в топливном элементе, способе накопления энергии и использовать воду, которая генерируется в элементе для потребления астронавтами..
Видео:Создать воду из кислорода и водорода - 🔎миф или правда🔍Скачать

Домашний эксперимент
Эксперименты по электролизу воды проводились на лабораторных весах с помощью вольтметров Хоффмана или другой сборки, которая позволяет вместить все необходимые элементы электрохимической ячейки..
Из всех возможных сборок и оборудования самым простым может быть большой прозрачный контейнер для воды, который будет служить ячейкой. Кроме того, вы должны иметь под рукой любую металлическую или электропроводящую поверхность, которая будет выполнять функцию электродов; один для катода, а другой для анода.
Для этой цели могут быть полезны даже карандаши с острыми точками на обоих концах. И, наконец, небольшой аккумулятор и несколько кабелей, которые соединяют его с импровизированными электродами..
Если не сделать в прозрачном контейнере, образование пузырьков газа не может быть оценено.
Домашние переменные
Хотя электролиз воды является предметом, который содержит много интригующих и обнадеживающих аспектов для тех, кто ищет альтернативные источники энергии, домашний эксперимент может быть скучным для детей и других зрителей..
Следовательно, достаточное напряжение может быть приложено для формирования H-образования2 и O2 чередуя определенные переменные и отмечая изменения.
Первый — это изменение pH воды с использованием уксуса для подкисления воды или Na.2Колорадо3 немного подвести Изменение количества наблюдаемых пузырьков должно произойти.
Кроме того, тот же эксперимент можно повторить с холодной и горячей водой. Таким образом, влияние температуры на реакцию будет затем рассматриваться.
Наконец, чтобы сделать сбор данных немного менее бесцветным, вы можете прибегнуть к очень разбавленному раствору сока фиолетовой капусты. Этот сок является основным кислотным индикатором природного происхождения..
Добавляя его в емкость с введенными электродами, можно заметить, что на аноде вода станет розовой (кислотной), а на катоде окраска будет желтой (основной).
Видео:Водород. 8 класс.Скачать

Урок 12. Водород и кислород
Видео:Водород/химические свойства водорода/8 классСкачать

Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
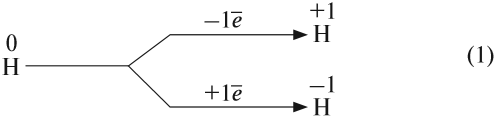
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
Природный водород состоит из трех изотопов: протий 1 Н, дейтерий 2 Н и тритий 3 Н.
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
а также при пропускании паров воды через раскалённые железные опилки:
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.
Видео:Свойства кислорода. 8 класс.Скачать

Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Видео:Водород - Самый ЛЕГКИЙ Газ во Вселенной!Скачать

Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
🎥 Видео
Решаем жгучий ПРОБНИК ЕГЭ ПО ХИМИИ 2024Скачать

Сколько грамм кислорода и водорода в воде? #факты #наукаСкачать

Про водород за 3 минуты.Скачать

Разложение воды на водород и кислород сигналом звуковой и ультразвуковой частоты. Ячейка Пухарича.Скачать

Получение водорода в домашних условияхСкачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Получение водорода и кислородаСкачать

Получение чистого водорода путем химической реакции алюминия со щелочамиСкачать