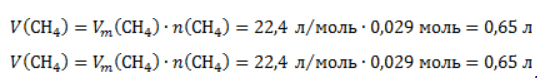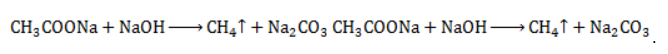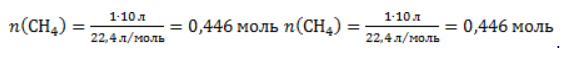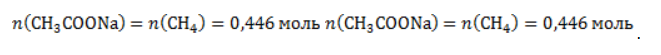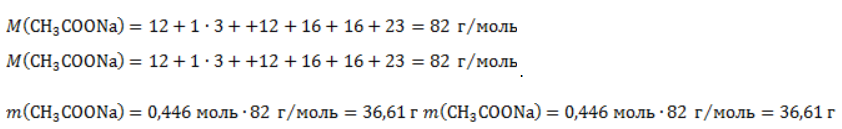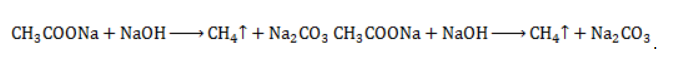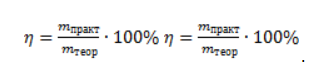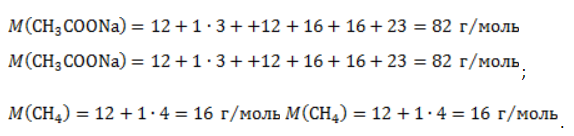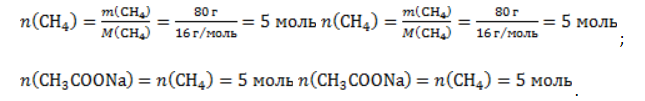Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Получение метана в лаборатории и промышленности
- Общая характеристика метана
- Физические свойства
- Получение метана
- Промышленные методы получения метана
- Очистка и переработка природного газа
- Переработка нефти и попутного газа
- Переработка каменного угля
- Лабораторный синтез метана
- Взаимодействие карбида алюминия с водой (метод Муассана)
- Взаимодействие ацетата натрия с щелочью (метод Дюма)
- Получение метана в домашних условиях
- Получение из органических отходов животноводства
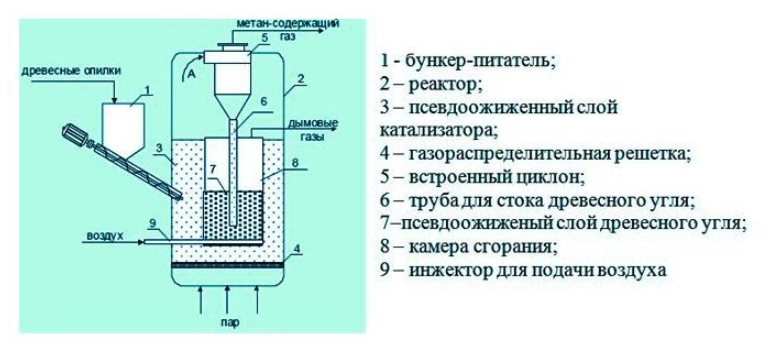
- Получение из древесины
- Эффективность синтеза биометана
- Метан в органическом синтезе
- Получение ацетилена из метана
- Получение метанола из метана
- Получение анилина из метана
- Заключение
- Примеры решения задач
- Метан — формула, строение и основные свойства природного газа
- Краткая характеристика
- Физические качества
- Химические свойства
- Получение в промышленности и лаборатории
- Применение метана
- Парниковый эффект
- Влияние на организм человека
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

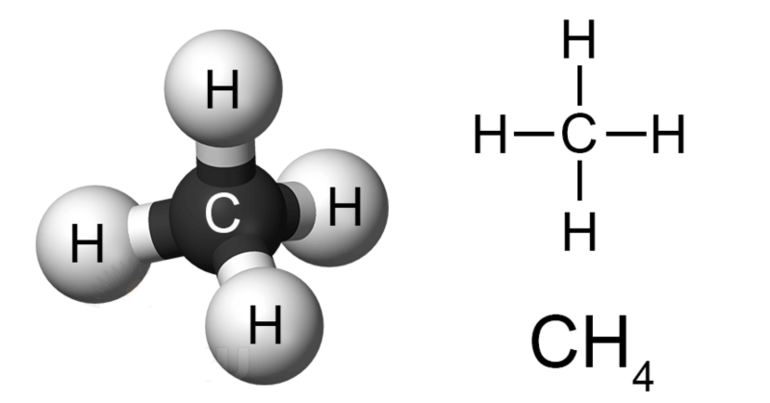
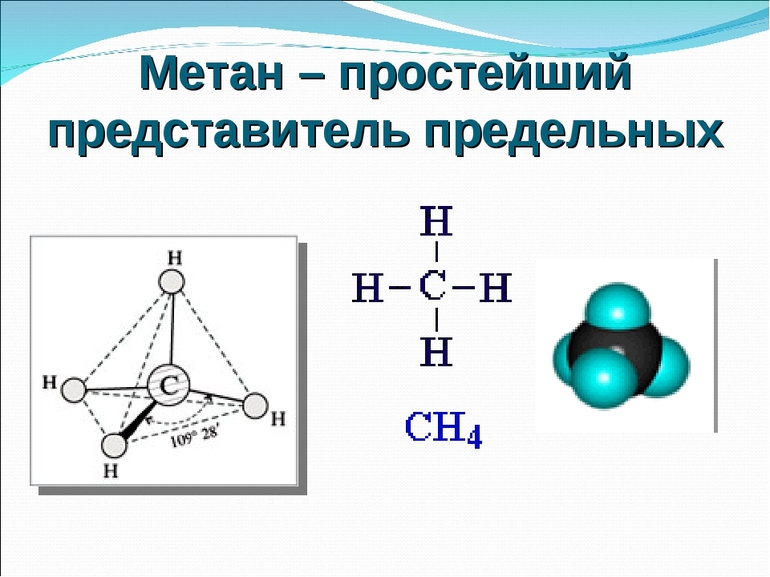
Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Получение метанаСкачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Реакция Дюма. Получение метанаСкачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
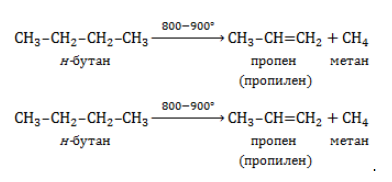
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:1.2. Алканы: Способы получения. Подготовка к ЕГЭ по химииСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Видео:Получение и изучение свойств метана. Опыт 1Скачать  Получение метанаВидео:Структурные формулы неорганических веществ.Скачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:Классификация неорганических веществСкачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:Получение метанаСкачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Получение метана в лаборатории и промышленностиПростейшее углеводородное соединение – метан – используется в промышленности, на транспорте, в быту, находя широкое применение и как сырье для органического синтеза, и в качестве конечного продукта. Потребность в метане испытывают многие отрасли хозяйства, и его производство постоянно расширяется. Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать  Общая характеристика метанаМетан представляет собой легкий бесцветный горючий газ без запаха. Распространен в природе как основной компонент природного газа и попутных нефтяных газов. Химическая формула – В атмосферу метан поступает в составе вулканических газов, а также является продуктом жизнедеятельности ряда микроорганизмов. В форме газогидратов в значительных количествах содержится на дне океанов и в многолетней мерзлоте. Является одним из важнейших парниковых газов. Как представитель ряда предельных углеводородов проявляет низкую химическую активность. Вследствие малой растворимости в воде и химической инертности метан считается малотоксичным веществом (класс опасности – IV), но при высокой концентрации в воздухе (4,4 — 17%) взрывоопасен, а дальнейшее повышение содержания метана приводит к удушью от недостатка кислорода. Физические свойстваОсновные физические характеристики метана при нормальном атмосферном давлении приведены в таблице. Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Получение метанаПромышленное производство и получение метана в лаборатории проводятся разными методами. Существуют также способы получения газа в домашних условиях, например, в частном хозяйстве для удовлетворения потребности в топливе. Промышленные методы получения метанаПоскольку газ в больших количествах поступает при добыче нефтегазового сырья, способы его производства нацелены не на искусственный синтез, а на выделение в процессах переработки нефти и газа. Кроме того, метан может быть получен при технологической обработке каменноугольного сырья. Очистка и переработка природного газаМетан – главный компонент такого важного вида горючих полезных ископаемых, как природный газ. Содержание метана в газе различных месторождений составляет 70-98%. После очистки от твердых частиц и примесей (сероводород, азот, углекислый газ, гелий) и осушки (отделения водяных паров) природный газ подвергается низкотемпературному фракционированию. Более тяжелые углеводородные компоненты газа – этан, пропан и бутан – переходят в жидкую фазу при более высоких температурах, чем метан, и последовательно отделяются от него в конденсационной колонне. Переработка нефти и попутного газаВ процессах термического разложения (пиролиза) высокомолекулярных алканов, входящих в состав нефти, в числе продуктов получают метан: Метан входит в состав газа, отделяемого от сырой нефти в процессе крекинга (разложения при высоком давлении и температурах около 450 — 550 ℃ либо с использованием катализатора). Кроме того, метан составляет значительную долю попутных газов, от которых его отделяют методом сепарации. Переработка каменного угля
Лабораторный синтез метанаВ лабораторной практике используются два основных способа получения метана:
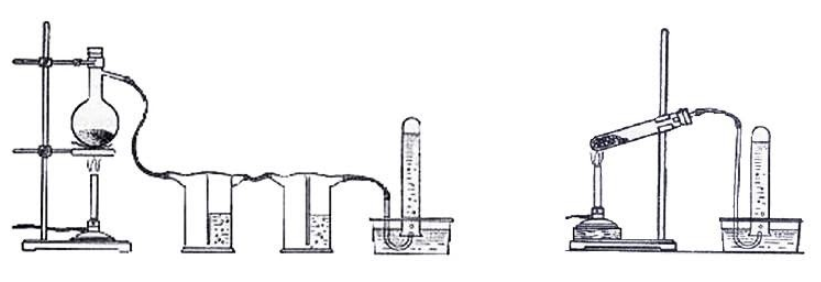
Взаимодействие карбида алюминия с водой (метод Муассана)Неорганическое бинарное соединение Реакция необратима и служит простым и удобным способом получения газа в лабораторных условиях. Взаимодействие ацетата натрия с щелочью (метод Дюма)Еще один простой лабораторный способ получения метана – прокаливание натриевой соли уксусной кислоты Подробное рассмотрение лабораторного процесса показывает, как с помощью щелочи получить метан из ацетата натрия. Присутствие воды препятствует этой реакции, поэтому уксуснокислый натрий должен быть обезвожен, а гигроскопичный гидроксид натрия – смешан с негашеной известью (оксидом кальция). Такая смесь носит название натронной извести. В реакционной смеси она должна присутствовать с избытком 1:3, чтобы обеспечить полное использование ацетата натрия. Порошки реагентов хорошо перемешиваются и помещаются в колбу с отводной трубкой или в пробирку. Выделяющийся газ собирают по методу вытеснения воды в пробирку. При нагревании колбы на пламени горелки используется асбестовая сетка. Пробирку нагревают на открытом пламени. Для улавливания примесей может использоваться промывная склянка с раствором щелочи. Для проверки результата опыта газ в пробирке поджигается. Варианты сборки прибора для получения метана в лаборатории изображены на рисунке. Получение метана в домашних условияхМетан можно получать и как продукт биологических процессов. Он выделяется в ходе обмена веществ особыми анаэробными микроорганизмами – бактериями-метаногенами. Они широко распространены в органических отходах животного и растительного происхождения. Поскольку метан может применяться в качестве горючего для водонагревательных установок, печей и кухонного оборудования, в частных хозяйствах, располагающих большим количеством отходов, становится выгодным самостоятельное получение из них метана и его использование. Получение из органических отходов животноводстваМетаногены обитают в кишечном тракте позвоночных и принимают участие в пищеварительном процессе. Поэтому в хозяйствах, занимающихся разведением крупного рогатого скота, свиней или домашней птицы, отходы жизнедеятельности животных могут быть переработаны с помощью биогазовых установок. Неразложимый остаток служит органическим удобрением. Технология получения биогенного метана состоит из нескольких этапов:
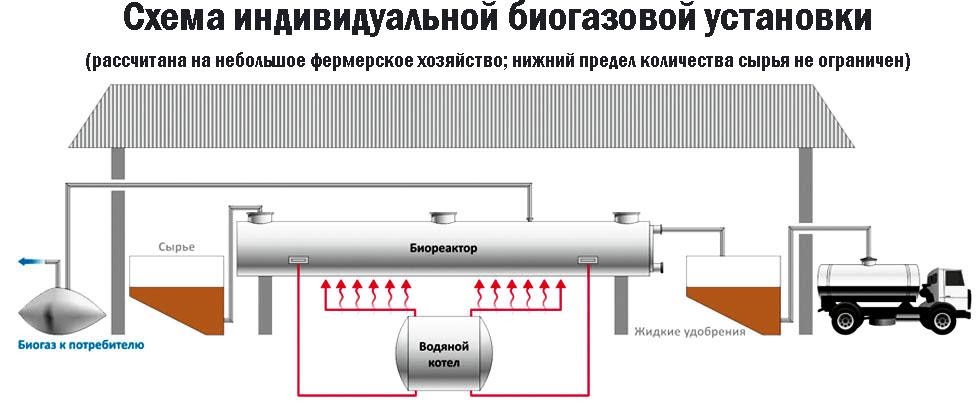
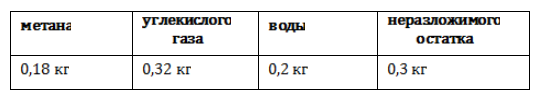
В некоторых установках предусмотрена система очистки биогаза от примесей – углекислого газа и сероводорода. Получение из древесиныВ качестве сырья для биогазовой технологии могут использоваться и растительные отходы, такие как древесная щепа. Пригодна для использования в биореакторе некондиционная древесина (например, пораженная вредителями или пострадавшая от пожаров), а также отходы лесозаготовок – ветки, кора и пр. Так как древесина содержит смолы, в установках по ее переработке нужно применять катализаторы для очистки газа. В качестве катализатора подходят шлаки металлургических производств, особенно эффективны мартеновские шлаки. Эффективность синтеза биометанаВ среднем переработка 1 кг биомассы, разложимой на 70%, дает: Эффективность выработки биогаза зависит от поддержания нужной температуры ферментации, поэтому в холодных регионах работа биогазовой установки потребует дополнительных затрат на подогрев и устройство надежной теплоизоляции. Большую роль играет биохимическое равновесие: выход газа снижается при возрастании кислотности. В этом случае требуется добавление нейтрализующего агента. Крупные фермерские хозяйства могут позволить себе привлечение специалистов, установку полностью автоматизированных биореакторов с большим выходом газа и получать дополнительный доход от его продажи. Для эффективной работы установки необходимо бесперебойное поступление сырья, поэтому хозяйствам с малым количеством животных невыгодно заниматься производством биометана. Если количество биомассы позволяет наладить синтез газа в небольшом хозяйстве, мини-установку для его производства можно сделать собственными силами. Следует помнить, что ее сооружение потребует серьезных вложений, составления технологической схемы, оформления документации, согласования с СЭС, пожарной и газовой инспекциями. Если хозяйство имеет возможность установить биогазовый реактор, оно получает существенные выгоды:
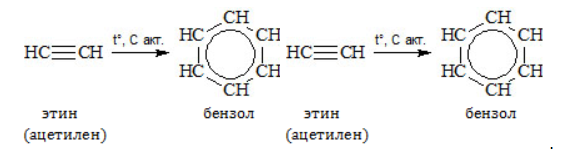
Видео:Составление формул органических соединений по названиюСкачать  Метан в органическом синтезеМетан широко используется для получения многих востребованных соединений, таких как ацетилен, метанол или анилин. Получение ацетилена из метанаВ лабораторной практике проводится дегидрирование метана. Реакция требует сильного нагревания: В промышленности используются такие методы, как:
В этой реакции используется теплота частичного сгорания сырья, благодаря которой реакционная смесь разогревается до 1600 ℃ . Получение метанола из метанаМетиловый спирт может быть получен:
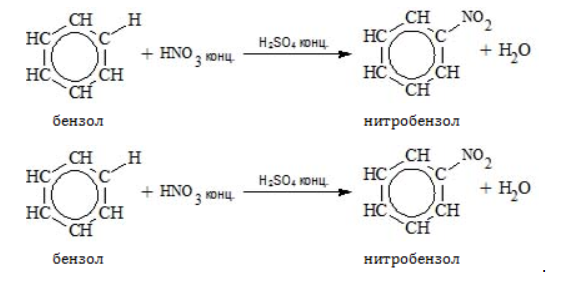
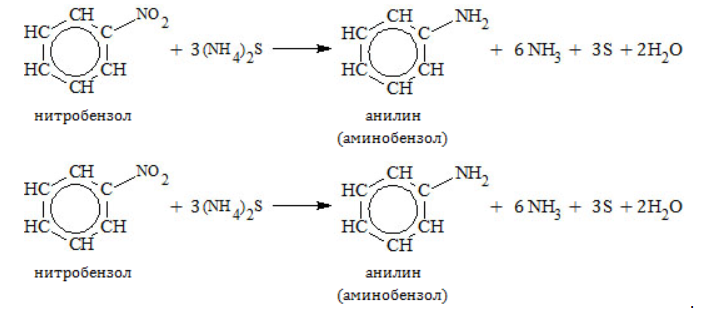
Получение анилина из метанаАроматическое соединение анилин получают в несколько стадий:
Видео:Проклятая химическая реакция 😜 #shortsСкачать  ЗаключениеМетан востребован во многих областях. Росту объемов его производства для различных нужд способствует достаточно высокая распространенность в природе. Однако метан производится не только на крупных промышленных предприятиях. Простота его получения с использованием биологических отходов стимулирует производство индивидуальными хозяйствами, что идет на пользу экологической обстановке, снижая бесконтрольное гниение отходов и выброс ценного продукта в атмосферу. Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать  Примеры решения задач1. Каков объем метана, выделяющегося при гидролизе карбида алюминия массой 12.5 г.? Запишем уравнение реакции: Найдем количество карбида алюминия, вступающего в реакцию, по формуле Из уравнения реакции видно, что Молярный объем газа Vm при нормальных условиях составляет 2. Какова масса ацетата натрия, необходимого для получения 10 л метана? Запишем уравнение реакции: Используя знание молярного объема газа, составим пропорцию: Вычислим количество получаемого метана: Из него следует, что количество ацетата натрия равно количеству метана: Рассчитаем массу ацетата натрия по формуле m=nM. 3. Сколько граммов ацетата натрия затрачено на получение 60 г метана при выходе продукта реакции 75%? Запишем уравнение реакции: Выход продукта равен отношению массы вещества, полученной на практике, к массе, рассчитанной по уравнению: Вычислим расчетную массу метана: Рассчитаем молярные массы ацетата натрия и метана: Уравнение показывает, что количества вещества ацетата натрия и метана равны. Вычислим их: Вычислим массу ацетата натрия: Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать  Метан — формула, строение и основные свойства природного газаКраткая характеристикаПриродный метан образуется при гниении останков живых организмов. В переводе с английского «methane» означает «болотный газ», так как чаще всего его обнаруживают в болотах и каменноугольных шахтах. Почти 95% реагента появляется в результате биологических процессов. Пятая часть годовых выбросов газа в атмосферу приходится на коз и коров, в желудках которых живут бактерии, вырабатывающие метан. В атмосферу он попадает, когда рогатый скот выводит из организма продукты своей жизнедеятельности. Другими источниками вещества являются:
Поскольку вещество обычно связано с живыми организмами, то учёные полагают, что его присутствие на планете указывает на наличие жизни. Так, когда этот газ был обнаружен в атмосферах Марса, специалисты начали тщательное изучение планеты именно на предмет существования живых организмов. Но дальнейшие исследования показали, что на удалённых планетах Солнечной системы метана значительно больше, хотя там он появился в результате химических реакций.
Физические качестваМетан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет. Кроме того, к физическим свойствам метана относятся:
Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2. При соприкосновении с источником тепла метан воспламеняется с небольшой задержкой. Это свойство вещества применяется при изготовлении предохранительных взрывчатых веществ и электрооборудования, безопасного при взрывах. На всех объектах, где существует опасность выброса метана, действуют правила техники безопасности «газовый режим». Химические свойстваВ химии формула метана — CH4. Соединение плохо вступает в химические связи. В обычных условиях оно не реагирует со следующими веществами:
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:
Получение в промышленности и лабораторииВ промышленных условиях вещество получают посредством нагревания углерода и водорода или синтеза водяного газа. Для того чтобы реакция протекала успешно, используют катализатор, обычно в этом качестве применяется никель. В США для добычи простейшего углеводорода используется специальная система, способная извлекать соединение из природного угля. Но также метан выделяется в виде подобного продукта при термической переработке нефти и нефтепродуктов, коксовании и гидрировании каменного угля. В лаборатории для получения вещества применяются следующие методы:
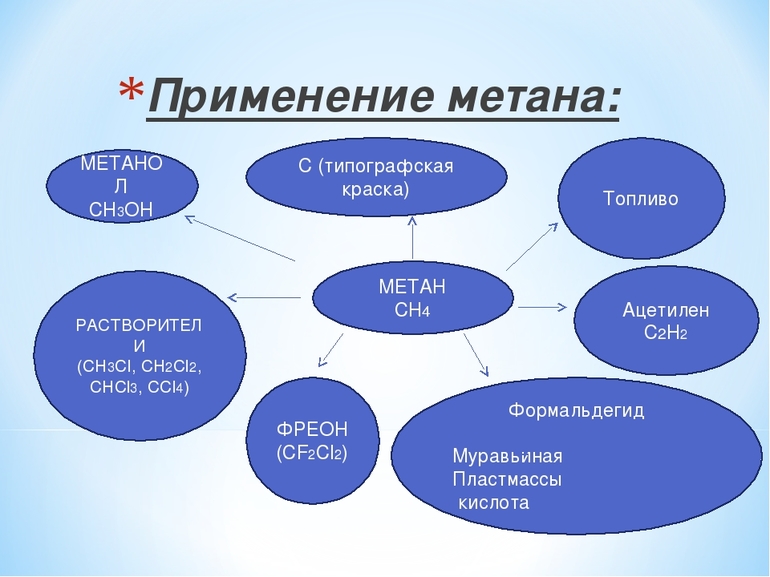
Применение метанаБолотный газ самый термически устойчивый углеводород, а потому он широко применяется и в быту, и в промышленности. Хлорирование вещества даёт возможность получения метилхлорида, метиленхлорида, хлороформа, четырёххлористого углерода. Результатом его неполного сгорания является сажа, Если метан каталитически окисляется, то получается формальдегид. А его реакция с серой приводит к образованию сероуглерода. К важным методам получения ацетилена из простейшего углеводорода относятся:
Газ также применяется для производства синильной кислоты. Кроме того, он даёт водород, необходимый для выработки водяного газа, который, в свою очередь, применяется для создания углеводородов, альдегидов и тому подобного. Кроме того, метан необходим при производстве нитрометана. В настоящее время газ стал часто использоваться в качестве автомобильного топлива. Но его плотность в 1000 раз меньше плотности бензина, а потому, чтобы заправить автомобиль метаном на тот же объём, что и бензином, при равном давлении необходим соответствующий бак. В таком случае для обычной поездки потребовалось бы возить прицеп с топливом. Учёные решили эту проблему, увеличив плотность газа до 200−250 атмосфер. Сжатое вещество закачивается в специальные баллоны, установленные на автомобилях особой конструкции. Парниковый эффектМетан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия. Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника. Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла. Влияние на организм человекаЧеловек может отравиться, надышавшись метаном при аварии на производстве или из-за неправильного обращения с приборами, работающими на этом газе. Возможна такая ситуация и при длительном нахождении на болоте, в шахте. Если концентрация вещества в воздухе составляет 20 и более процентов, то отравление может быть очень тяжёлым, вплоть до летального исхода. Работники химических производств, рудников и шахт подвержены другому способу отравления углеводородом. Зачастую эти люди на протяжении длительного времени регулярно вдыхают небольшие дозы вещества. Кроме того, хроническая интоксикация может наступить из-за заболеваний кишечника, например, дисбактериоза. В таких случаях в организме больного метан образуется в повышенном количестве. Этот газ не станет причиной серьёзной интоксикации, но всё же он может вызвать в организме разные нарушения, привести к желудочно-кишечному дискомфорту и общему ухудшению самочувствия. Отличить острое отравление метаном можно по следующим признакам:
Если отравление тяжёлое, то человек теряет сознание, у него начинаются судороги, за которыми следует кома. А также возможна остановка дыхания и сердцебиения. Если отравление метаном является хроническим, то пострадавший страдает от частых головных болей, общего недомогания, низкого артериального давления и снижения работоспособности. Человек становится бледным и вялым, испытывает упадок сил. Гипотония может вызывать обмороки. И также возможно истощение нервной системы, которое выражается в повышенной раздражительности, нервозности и тому подобном. Метан известен, как один из самых опасных газов. Он токсичен, горюч и взрывоопасен. Вещество не имеет ни цвета, ни запаха, а потому обнаружить его в воздухе крайне сложно. Чтобы не подвергать своё здоровье и жизнь опасности, следует внимательно относится к технике безопасности и соблюдать осторожность при работе или бытовом использовании метана. |
















 .
.

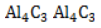 с кристаллической структурой в реакции с водой разлагается с образованием метана и нерастворимого гидроксида алюминия:
с кристаллической структурой в реакции с водой разлагается с образованием метана и нерастворимого гидроксида алюминия: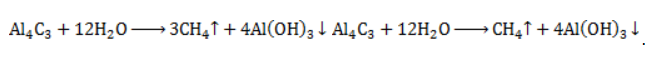
 с едким натром
с едким натром  :
: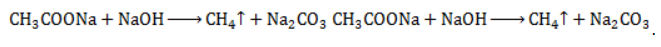
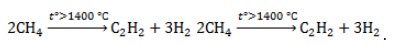


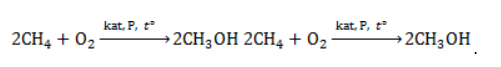
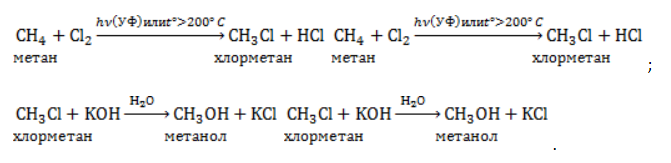
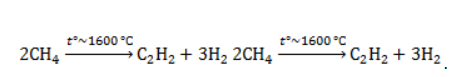

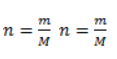 , где – n количество вещества, m– масса, M – молярная масса.
, где – n количество вещества, m– масса, M – молярная масса.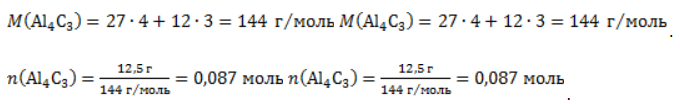
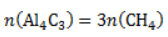 . Следовательно, количество метана равно:
. Следовательно, количество метана равно: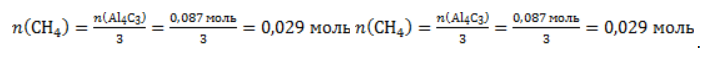
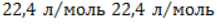 . Следовательно, объем метана будет равен:
. Следовательно, объем метана будет равен: