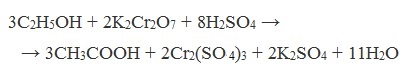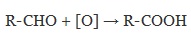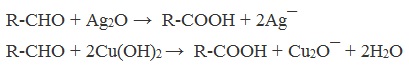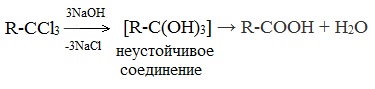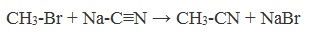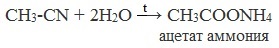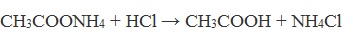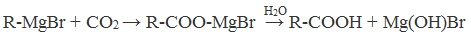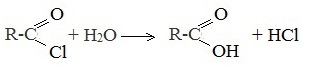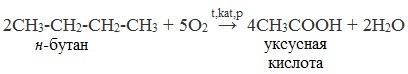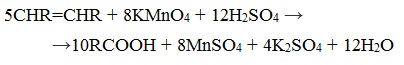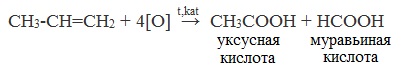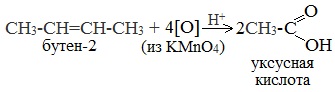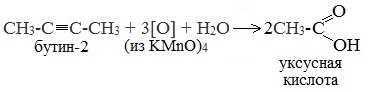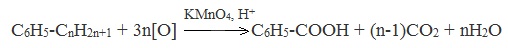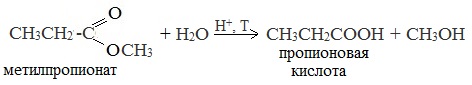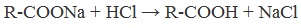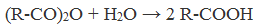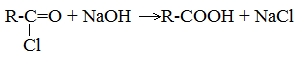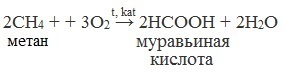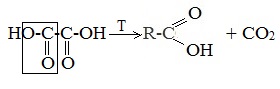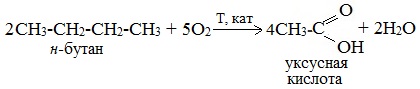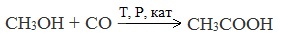Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
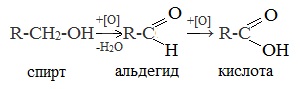
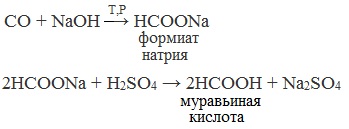
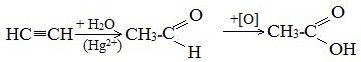
Видео:11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать  Химические свойства бутанола и бутаналяЗадача 59. а) Реакции бутаналя1. Альдегиды легко окисляются до соответствующих карбоновых кислот под действием разнообразных окислителей. Поэтому бутаналь легко окислится хромовой смесью до бутановой кислоты: 2. Реактив Фелинга — это раствор сульфата меди CuSО4 и тартрата калия-натрия KNa(C4H406) в 10%-м водном растворе гидроксида натрия NaOH. При действии реактивом Фелинга на пропаналь образуется бутановая кислота и выпадет красный осадок Cu2O — реакция «медного зеркала»: 3. При присоединении первой молекулы спирта образуются полуацетали. Реакция катализируется кислотами или основаниями: Присоединение второй молекулы спирта приводит к образованию ацеталей. Образование ацеталей катализируется только в кислой среде: Ацетали устойчивы в нейтральной и щелочной среде, поэтому могут быть использованы для временной защиты альдегидных групп. Ацетали широко распространены в природе. 4. Реактив Гриньяра (R-Mg-Х, здесь R – алкильный или арильный радикал; Х – это галоген.) получается при реакции металлического магния с соответствующими органическими галогенидами. Одно из наиболее важных использований реактивов Гриньяра — реакция с альдегидами и кетонами, приводящая к спиртам. Из пропаналя и метилмагнийбромида получаются вторичные спирт пентанол-2: б) Реакции бутанола1. Первичные спирты Первичные и вторичные спирты легко окисляются хромовым ангидридом или бихроматом в водном растворе серной кислоты. Образовавшийся при окислении спирта альдегид окисляется до карбоновой кислоты. Общая схема реакции окисления спирта: 2. Реактив Фелинга не вступает в реакцию с первичными спиртами 3. Спирты могут вступать в реакцию межмолекулярной дегидратации, так при при нагревании пропанола с этанолом в присутствии серной кислоты образуется этилбутират: Этот способ неприемлем для получение несимметричных эфиров из двух спиртов, так как при этом образуется смесь трех возможных продуктов ROR, R’OR, R’OR’, в данном случае — 4. Реактивы Гриньяра с высокой скоростью и необратимо реагируют со всеми группами (OH-), что находит применение для количественного определения подвижного водорода в органических соединениях по объему выделившегося метана (метод Чугаева–Церевитинова): Видео:Как не допустить ЗАСТОЯ в ЖЕЛЧНОМ пузыре. Продукты для РАЗЖИЖЕНИЯ желчи.Скачать  Превращения алллилового спиртаЗадача 60. аллиловый спирт + Cl2 → A + 2NaOH(водный) → B + CH3-COOH(H + , t°) → C + 2CH3COOH(H + , t°) → Д 2. При омылении дихлорпропилового спирта получают глицерин: 3. Реакция глицерина с кислотами При действии на глицерин разбавленным раствором уксусной кислотой в присутствии серной кислоты и при нагревании образуется моноацетат глицерина: 4. При реакции моноацетата глицерина с уксусной кислотой образуется триацетат глицерина: А — 2,3-дихлорпропанол-1 — CH2Cl-CHCl-CH2OH; Алани́н (2-аминопропановая кислота) — алифатическая аминокислотаЗадача 61. Уравнение реакции имеет вид: Из уравнения реакций вытекает, что при взаимодействии 1 моль Na2CO3 и 2 моль аланина выделяется 1 моль СО2 и 2моль соли, т.е. n(CO2) = n(Na2CO3) = 2n(NС3H6О2Na). 1. Рассчитаем количества веществ, получим: 2. Рассчитаем массу соли, получим: 3. Рассчитаем массу оставшейся соли Na2CO3, получим: 4. Определение массовых долей веществ в образовавшемся растворе, получим: Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Уравнение получения бутановой кислоты из бутаналяНекоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот Общие способы получения карбоновых кислот1. Окисление первичных спиртов и альдегидов под действием различных окислителей В качестве окислителей применяют KMnO4 и K2Cr2O7. Например: Для окисления альдегидов используются те же реагенты, что и для спиртов. При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора. При окислении дихроматом калия — цвет меняется с оранжевого на зеленый. А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов: 2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты: 3. Получение карбоновых кислот из цианидов (нитрилов) Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия: Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония: При подкислении раствора выделяется кислота: 4. Использование реактива Гриньяра (по схеме) 5. Гидролиз галогенангидридов кислот С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту: В промышленности1. Выделяют из природных продуктов (жиров, восков, эфирных и растительных масел) 2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением) Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота: 3. Окисление алкенов и алкинов При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи: При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты: 4. Окисление гомологов бензола (получение бензойной кислоты) Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия: В лаборатории1. Гидролиз сложных эфиров При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации): 2. Из солей карбоновых кислот 3. Гидролиз ангидридов кислот При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты: 4. Щелочной гидролиз галоген производных карбоновых кислот Специфические способы получения важнейших кислотСпособы получения НСООН 1. Взаимодействие оксида углерода (II) с гидроксидом натрия Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой: 2. Каталитическое окисление метана 3. Декарбоксилирование щавелевой кислоты Муравьиную кислоту можно получить при нагревании щавелевой кислоты: Способы получения СН3СООН Получение уксусной кислоты для химических целей 1. Синтез из ацетилена Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана): 2. Каталитическое окисление бутана Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха: Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект. 3. Каталитическое карбонилирование метанола Получение уксусной кислоты для пищевых целей 4. Уксуснокислое брожение этанола Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво): 💡 Видео83. Что такое карбоновые кислоты (систематическая номенклатура предельных одноосновных карб к-т)Скачать  Химические свойства бутана| Получение бутана | Даниил Разуваев | ЭкзаменариумСкачать  ПОЛНЫЙ разбор ВАРИАНТА №4 из сборника Добротина! | Химия ЕГЭ УМСКУЛСкачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать  Решение демоверсии ЕГЭ по химии 2016-2017 | Задание А18. [Подготовка к ЕГЭ (RuEGE.ru)]Скачать ![Решение демоверсии ЕГЭ по химии 2016-2017 | Задание А18. [Подготовка к ЕГЭ (RuEGE.ru)]](https://i.ytimg.com/vi/kKwApsthkEY/0.jpg) Все о получении карбоновых кислот за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать  Органическая химия с нуля | Химия ЕГЭ 2023 | УмскулСкачать  10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  Карбоновые кислотыСкачать  Карбоновые кислоты. Строение, классификация, номенклатура кислот и их солей | ХимияСкачать  13.2. Сложные эфиры: Способы полученияСкачать  Карбоновые кислотыСкачать  47. Простые и сложные эфиры (часть 1)Скачать  Лекция 10. Карбоновые кислотыСкачать  ХИМИЯ 10 класс: Карбоновые кислоты. Номенклатура и изомерия.Скачать  Хлороводородный фонтан, получение соляной кислоты. (химия)Скачать  |