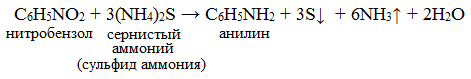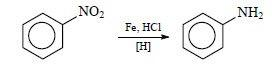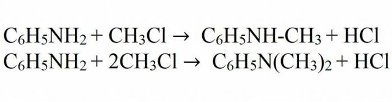Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком О. Унфердорбеном и назвал его «кристалликом».
В 1834 году Ф. Ф. Pyнгe обнаружил анилин в каменноугольной смоле и назвал его «кианолом».
В 1841 году Ю.Ф. Фрицше получил анилин нагреванием индиго с раствором едкого кали KOH и назвал его «анилином».
В 1842 году Н.Н. Зинин получил анилин восстановлением нитробензола сульфидом аммония и назвал его «бензидамом».
В 1843 году А. В. Гофман установил идентичность всех перечисленных соединений.
Восстановление нитросоединений (реакция Зинина)
Основной способ получения анилина – восстановление нитробензола.
Анилин и другие первичные ароматические амины получают с помощью рtакции, открытой русским химиком Н.Н. Зининым. В качестве восстановителя Н.Н. Зинин применял сульфид аммония:
Впоследствии в качестве восстановителя стали применять водород.
- Промышленный способ
- Лабораторный способ
- Уравнение получения анилина из нитробензола
- Электронное строение
- Физические свойства
- Химические свойства
- Способы получения
- Анилин — структурная формула и свойства органического соединения
- Анилин (фениламин) — понятие, строение, физические свойства
- Получение анилина
- Химические свойства анилина
- Применение анилина
- 💡 Видео
Промышленный способ
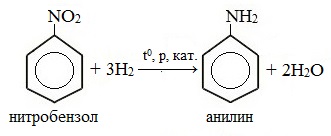
1. Каталитическое восстановление нитробензола (восстановление нитробензола молекулярным водородом)
В настоящее время этот способ восстановления нитробензола с целью получения анилина в промышленности является основным.
Смесь паров нитробензола и водорода пропускают над катализатором при температуре 300 0 С и повышенном давлении:
Лабораторный способ
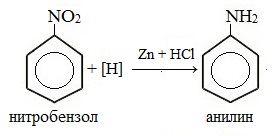
1. Восстановление нитробензола атомарным водородом
В лаборатории для этой цели используют цинк в кислой среде:
Восстановителем в этой реакции является атомарный водород, который получается в момент его выделения.
Видео:Получение НИТРОБЕНЗОЛАСкачать

Уравнение получения анилина из нитробензола
Электронное строение
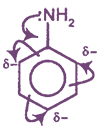
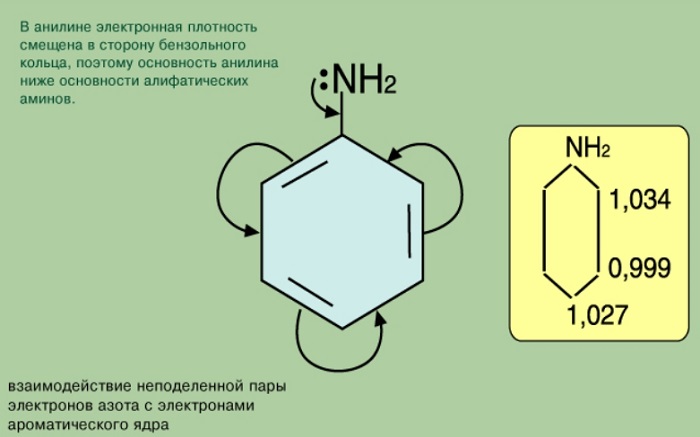
Неподеленная пара электронов атома азота участвует в сопряжении с π-системой бензольного ядра (р,π-сопряжение). Поэтому ее способность к образованию донорно-акцепторной связи ослаблена. В связи с этим основные свойства анилина выражены в значительно меньшей степени, чем у алифатических аминов.
Являясь заместителем 1 рода, аминогруппа повышает электронную плотность в орто- и пара-положениях бензольного ядра (аналогия с фенолом).
Физические свойства
Анилин — бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде, тяжелее воды, ядовит.
Химические свойства
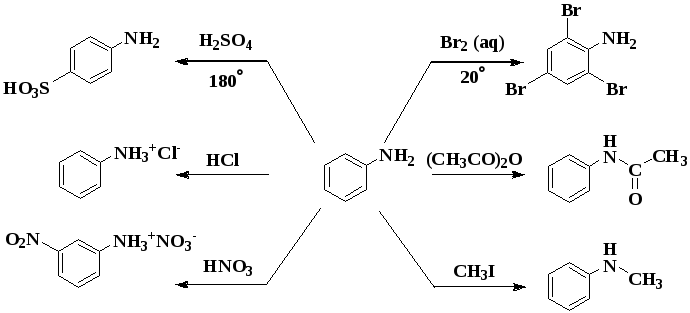
I. Реакции с участием аминогруппы
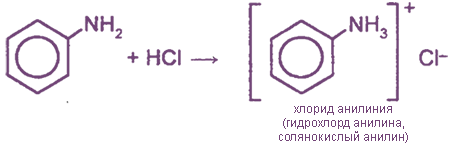
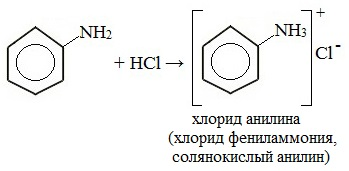
Взаимодействие с кислотами (образование солей)
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
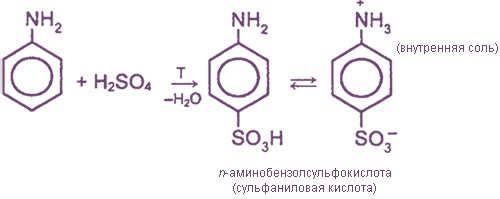
II. Реакции с участием бензольного ядра
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
Способы получения
Анилин получают из нитробензола восстановлением нитрогруппы -NO2 в аминогруппу -NH2. Эту реакцию открыл русский химик Н. Н. Зинин
. Восстановление нитробензола он производил сульфидом аммония:
Восстановление можно производить и в кислой среде атомарным водородом, который образуется при взаимодействии металлов с кислотами:
а также газообразным Н2 при высоком давлении в присутствии катализатора:
Видео:12. В-О Получение анилинаСкачать

Анилин — структурная формула и свойства органического соединения
Анилин – это соединение, которое относят к органическим веществам. Принадлежит к классу аминов. Чтобы понять, что такое амины, можно представить формулу аммиака, затем один атом водорода или все заменить углеводородным радикалом.
Видео:12.4. Анилин: Строение, химические свойства, способы получения. ЕГЭ по химииСкачать

Анилин (фениламин) — понятие, строение, физические свойства
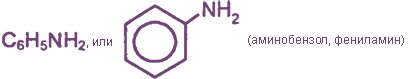
Если в формуле аммиака только один водородный атом заменить фенил радикалом, получится анилин (фениламин). Поэтому его можно считать производным аммиака. Вещество называют также аминобензол.
Можно иначе представить это соединение. Если в формуле бензола вместо одного водорода поставить аминогруппу, получается анилин. Значит это производная бензола, где атом водорода замещается на аминогруппу.
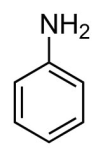
Эмпирическая (молекулярная) формула фениламина C6H5 NH2. Его записывают с помощью структурной формулы:
Аминобензол содержит две группы атомов: аминогруппу и фенил радикал. Они оказывают влияние на свойства вещества.
Аминогруппа NH2– состоит из атома азота и двух атомов водорода. У азота на внешнем энергетическом уровне содержится 5 электронов. Два электрона образуют химическую связь с атомами углерода, один электрон образует связь с углеродом фенил радикала. У него еще остаётся два электрона. Они образуют свободную пару электронов.
Аминогруппа в составе анилина может присоединять протон водорода. Поэтому соединение проявляет свойства оснований. Так как по определению, вещества, присоединяющие протон водорода, принято считать основаниями.
Фенил радикал C6H5 – имеет в своём составе бензольное кольцо. Благодаря этому фениламин должен вступать в реакции, характерные для бензола.
Так как 2 группы атомов находятся в одном соединении, они оказывают влияние друг на друга.
Фенил радикал, влияя на функциональную группу, вовлекает свободную пару электронов в π — электронную систему. Такое смещение плотности влияет на проявление свойств соединения как основания. В результате фениламин не вступает во взаимодействие с водой. Аммиак, таким образом, более сильное основание.
Функциональная группа влияет на π — систему. Нарушается равномерное распределение электронной плотности. Она повышается у атомов 2,4,6 (в орто — и пара — положениях). Именно здесь будет идти замена водорода на другие атомы в химических реакциях.
Фениламин — это жидкость, маслянистая и ограниченно растворяющаяся в воде. Растворяется в органических соединениях.
Кипит при температуре 184 0 С, замерзает при температуре –6 0 С. При окислении окрашивается в красно-бурый цвет. Молярная масса 93 г/моль. Плотность вещества при 20 0 С составляет 1,02173 г/см 3 .
Вещество ядовито. Его относят ко второму классу опасности. При контакте с кожей может вызвать аллергию. При попадании в организм вызывает отравление. Есть информация о том, что оно может вызвать генетические мутации, возникает риск возникновения раковых заболеваний. Его называют ядом крови, так как вызывает кислородное голодание.
Видео:№ 161. Органическая химия. Тема 24. Анилин. Часть 2. Получение анилинаСкачать

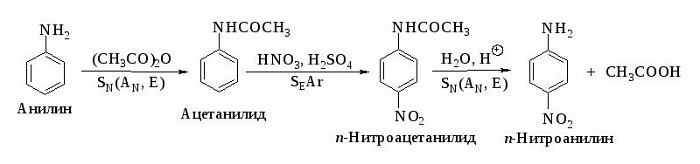
Получение анилина
Фениламин получают из нитробензола. Данный способ был предложен русским учёным Н. Н. Зининым. Поэтому получил название «реакция Зинина».
Проводят взаимодействие железа с нитробензолом в присутствии соляной кислоты.
Идёт восстановление нитробензола до анилина. Синтез можно представить уравнениями реакций:
Fe + 2HCl = FeCl2 + 2H
При взаимодействии анилина с галогеналканами и спиртами получают смесь вторичных, а также третичных аминов. Такое превращение носит название алкилирование.
Видео:Восстановление нитробензола.Скачать

Химические свойства анилина
Для вещества характерны две группы свойств.
Реакции, идущие за счет функциональной группы.
Фениламин взаимодействует с кислотами. В результате образуются соли. При взаимодействии анилина с хлороводородной кислотой получается хлорид фениламмония, или анилин солянокислый:
Свойства, идущие за счёт фенил радикала.
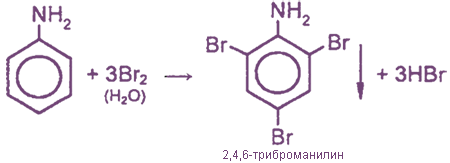
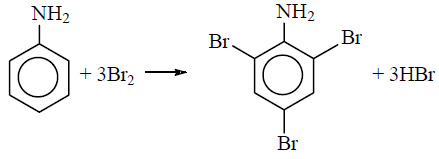
Для фениламина характерна реакция замещения, например бромирование. В результате получают 2,4,6 триброманилин. Образуется осадок белого цвета, поэтому реакцию считают качественной на обнаружение данного вещества.
Уравнение реакции с бромом выглядит следующим образом:
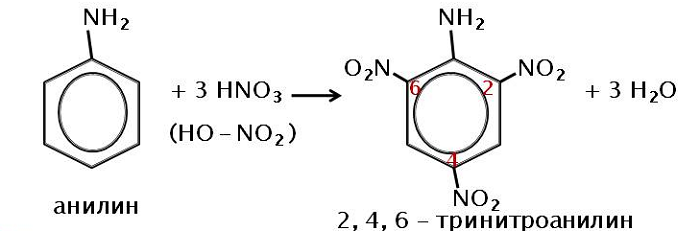
Нитрование, при котором происходит замещение в кольце ароматических аминов:
Вступает во взаимодействие с азотной кислотой, образуя тринитроанилин.
Видео:Анилин. Его свойства и применение | Химия 10 класс #43 | ИнфоурокСкачать

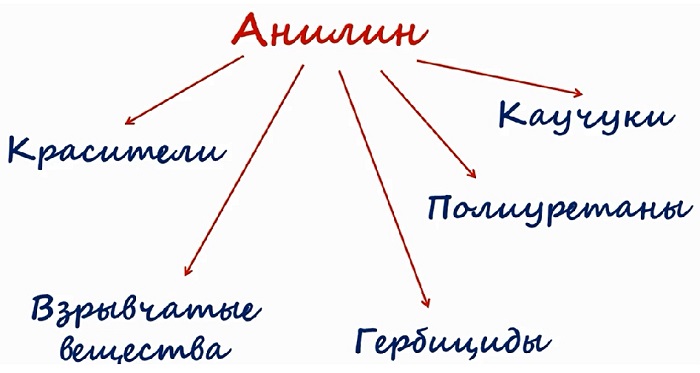
Применение анилина
Большая часть фениламина идёт для синтеза красителей. Его используют в получении типографской краски и синтетических красителей для текстильной промышленности.
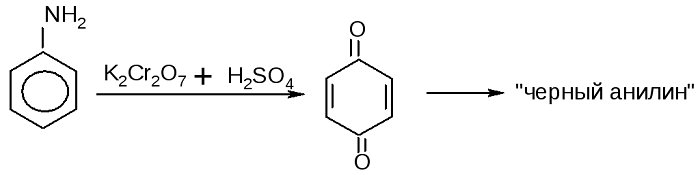
Так в кислой среде анилин окисляется дихроматом калия, в результате получается чёрный краситель. Эта реакция также рассматривается как качественная на фениламин:
Вещество является исходным для получения лекарственных препаратов. Сульфаниламидные соединения, получаемые на основе анилина, используют в медицине в качестве лекарств. Это производные анилина. К ним относятся: парацетамол, фенацетин и другие.
Также на основе соединения производят химические средства защиты растений, различные смолы, крем для обуви, взрывчатые вещества.
💡 Видео
Анилин и способы получения аминовСкачать

Опыты по химии. Нитрование бензолаСкачать

Ароматические аминыСкачать

Амины. Анилин. Урок 27. Химия 10 классСкачать

Амины. АнилинСкачать

АнилинСкачать

Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

Резонансные структуры молекулы нитробензолаСкачать

Габриелян химия 11 кл решение задачи 8 стр 192Скачать

Видеоурок. Амины. АнилинСкачать

11й класс; Химия; "Анилин"Скачать

Все об азотсодержащих соединениях | Химия ЕГЭ 2023 | УмскулСкачать

Химия, 10 класс: АнилинСкачать

НитросоединенияСкачать