- Соли алюминия
- Нитрат и сульфат алюминия
- Комплексные соли алюминия
- Гидролиз солей алюминия
- Алюминаты
- Сульфат алюминия
- Применение сульфата алюминия
- Вред сульфата алюминия
- Первая помощь при отравлении сульфатом алюминия
- Хранение сульфата алюминия
- Сульфат алюминия
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Применение
- 💡 Видео
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например , тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al 3+ + H2O = AlOH 2+ + H +
II ступень: AlOH 2+ + H2O = Al(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия :
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
Видео:Взаимодействие сульфата алюминия с раствором гидроксида натрия Al2(SO4)3 + NaOHСкачать

Сульфат алюминия

Сульфат алюминия растворим в воде и, в основном, используется в качестве флокулянта для очистки питьевой и технической воды станциями очистки сточных вод, а также в производстве бумаги.
Сульфат алюминия иногда упоминается как серная кислота, квасцы алюмоаммиачные или пищевая добавка Е 523. Безводная форма встречается в природе как редкий минерал Миллозевичит, содержащийся в вулканических средах, а также получается при сжигании угольных отходов. Сульфат алюминия образует множество различных гидратов, в числе которых кристаллогидрат Al2(SO4)3*16H2O и октадекагидрат Al2(SO4)3*18H2O.
Сульфат алюминия обладает способностью поглощать и удерживать молекулы воды из окружающей атмосферы.
Получение сульфата алюминия технического возможно путем добавления гидроксида алюминия Al(OH)3 в серную кислоту H2SO 4.
Также возможно получение сульфата алюминия из тетрагидроксоалюмината натрия.
Сульфат алюминия – это белое или почти белое кристаллической формы или в виде порошка соединение без запаха. Он растворим в воде, не летуч и легковоспламеняем. Сульфат алюминия обладает чрезвычайно кислым вкусом.
Видео:Отримання Сульфату алюмінію Al2(SO4)3Скачать

Применение сульфата алюминия
Раствор сульфата алюминия используется для очистки воды и как краситель в обработке текстиля. В процессе очистки воды раствор сульфата алюминия приводит к коагулированию, нежелательные примеси и загрязненные частицы оседают на дно сосуда и легко отфильтровываются.
При растворении в большом количестве нейтральной или слегка щелочной воды, раствор сульфата алюминия образует студенистый осадок гидроксида алюминия Al(OH)3, который используется при печати и окрашивании тканей, так как является нерастворимым пигментом.
Сульфат алюминия иногда используется для снижения pH почвы сада, что в свою очередь приводит при выращивании некоторых видов цветов (Гортензии) к их повторному цветению.
Сульфат алюминия является активным ингредиентом некоторых антиперспирантов.
В строительстве он используется в качестве гидроизолятора и ускорителя в производстве бетона.
Сульфат алюминия может быть использован в борьбе с моллюсками, насекомыми и слизняками.

В медицине сульфат алюминия входит в состав лекарств, облегчающих боль и дискомфорт, вызванные укусами насекомых. Он помогает разрушить токсичные химические вещества, содержащиеся в укусах, и помогает уменьшить их воздействие на кожу. Эти препараты выпускается в виде спреев, которые наносятся непосредственно на пораженные участки кожи и эффективнее помогают, если будут использованы сразу же после укуса.
Видео:Number of Ions in Al2(SO4)3 : Aluminum sulfateСкачать

Вред сульфата алюминия
Сульфат алюминия вреден при проглатывании или вдыхании. Вдыхание паров сульфата алюминия вызывает кашель и, возможно, одышку.
При контакте с кожей или глазами сульфат алюминия вызывает раздражение, покраснение, зуд и боль. Употребление сульфата алюминия внутрь приводит к сильному раздражению кишечника и желудка, сопровождаемое рвотой, тошнотой и диареей.
Это соединение может вызывать сильные ожоги, если контактирует с открытыми участками кожи.
Видео:How to Find the Percent Composition by Mass for Al2(SO4)3 (Aluminum sulfate)Скачать

Первая помощь при отравлении сульфатом алюминия
При попадании сульфата алюминия на кожу или в глаза необходимо промыть пораженный участок водой. В случае вдыхания паров необходимо выйти из токсичной области и медленно отдышаться. Если сульфат алюминия был применен внутрь, необходимо выпить стакан молока, а затем спровоцировать рвоту.
При отравлении сульфатом алюминия ни в коем случае нельзя использовать бикарбонаты, так как такое сочетание в буквальном смысле является взрывным.
Видео:How to balance BaCl2 + Al2(SO4)3 - BaSO4 + AlCl3Скачать

Хранение сульфата алюминия
Сульфат алюминия необходимо хранить в прохладном, сухом месте в плотно закрытой таре, не смешивая с другими веществами.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Видео:Взаимный гидролизСкачать

Сульфат алюминия
| Сульфат алюминия | |
|---|---|
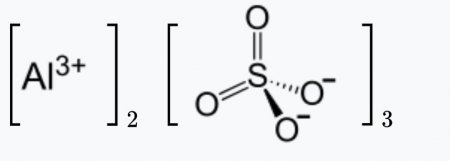 | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES | |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Видео:What happens when aluminum sulfate (Al2(SO4)3) react with lead nitrate Pb(NO3)2 | Al2(SO4)3+Pb(NO3)2Скачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
Видео:SALT ANALYSIS 4:- Al2(SO4)3. Link in the Description Below.Скачать

Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см 3 , удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см 3 . При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Видео:How to balance: BaCl2 + Al2(SO4)3 = BaSO4 + AlCl3Скачать

Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Видео:How to balance Al2(SO4)3+NaOH=Al(OH)3+Na2SO4|Chemical equation Al2(SO4)3+NaOH=Al(OH)3+Na2SO4Скачать

Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
💡 Видео
What happens when Aluminum sulfate (Al2(SO4)3) reacts with Sodium carbonate (Na2CO3)?Скачать

What type of reaction is Aluminium sulfate (Al2(SO4)3) and Potassium hydroxide (KOH) | KOH+Al2(SO4)3Скачать

Определение массовых долей элементов в соединениях. 8 класс.Скачать

What happens when aluminum sulfate (Al2(SO4)3) react with silver nitrate (AgNO3)? | Al2(SO4)3+AgNO3Скачать

Balance the equation Al2(SO4)3 + NaOH ---》Al(OH)3 + Na2SO4Скачать

How to balance BaCl2 + Al2(SO4)3 → BaSO4 + AlCl3Скачать

Reaction of aluminum sulfate (Al2(SO4)3) and ammonium hydroxide (NH4OH) | Al2(SO4)3+NH4OHСкачать

How to name Al2(SO4)3Скачать

Double Displacement Aluminium Sulphate (Al2(SO4)3) & Barium Hydroxide (Ba(OH)2) | Ba(OH)2+Al2(SO4)3Скачать





