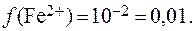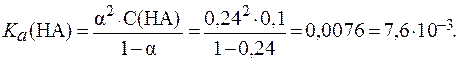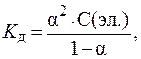Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + . Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н + ):
Константа диссоциации по первой ступени:
Вторая ступень диссоциации (отщепление иона водорода Н + от сложного иона НСО3 — ):
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н + (Н3О + ).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — .
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН — ):
Вторая ступень диссоциации (отщепляется гидроксид-ион ОН — от сложного катиона FeOH + ):
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН — .
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н + или ОН — от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н + и гидроксид-анионы ОН — , т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н + и анионы ОН — .
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.
Сложный анион НСО3 — (гидрокарбонат-ион) частично диссоциирует по уравнению:
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН — .
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Сложный катион частично диссоциирует по уравнениям:
Для обеих ступеней диссоциации Fe(OH)2 + .
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Гидролиз сульфата алюминия
Al2(SO4)3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Al 3+ + 3SO4 2- + 2HOH ⇄ 2AlOH 2+ + 2SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Al 3+ + HOH ⇄ AlOH 2+ + H +
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2AlOH 2+ + 2SO4 2- + 2HOH ⇄ 2Al(OH)2 + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
AlOH 2+ + HOH ⇄ Al(OH)2 + + H +
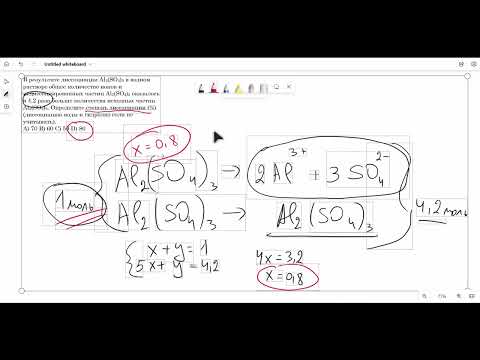
Видео:В результате диссоциации Al2(SO4)3 в водном растворе общее количество ионов и недиссоциированныхСкачать

Третья стадия (ступень) гидролиза
Полное ионное уравнение
2Al(OH)2 + + SO4 2- + 2HOH ⇄ 2Al(OH)3 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Al(OH)2 + + HOH ⇄ Al(OH)3 + H +
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Среда и pH раствора сульфата алюминия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Эталоны решения задач
1. Написать уравнение электролитической диссоциации Al2(SO4)3 в воде.
Сульфат алюминия является сильным электролитом и в водном растворе подвергается полному распаду на ионы. Уравнение диссоциации:

или (без учета процесса гидратации ионов):

2. Чем является ион HCO3 — с позиций теории Бренстеда-Лоури?
В зависимости от условий ион HCO3 – может как отдавать протоны:

так и присоединять протоны:

Таким образом, в первом случае ион HCO3 — является кислотой, во втором — основанием, т. е. является амфолитом.
3. Определить, чем с позиций теории Льюиса является ион Ag + в реакции:

В процессе образования химических связей, который протекает по донорно-акцепторному механизму, ион Ag + , имея свободную орбиталь, является акцептором электронных пар, и, таким образом, проявляет свойства кислоты Льюиса.
4. Определить ионную силу раствора в одном литре которого находятся 0,1 моль KCl и 0,1 моль Na2SO4.
Диссоциация представленных электролитов протекает в соответствии с уравнениями:


Отсюда: С(K + ) = С(Cl — ) = С(KCl) = 0,1 моль/л;
Ионную силу раствора вычисляем по формуле:
5. Определить концентрацию CuSO4 в растворе данного электролита с I = 0,6 моль/л.
Диссоциация CuSO4 протекает по уравнению:

Примем С(CuSO4) за x моль/л, тогда, в соответствии с уравнением реакции, С(Cu 2+ ) = С(SO4 2 — ) = x моль/л. В данном случае выражение для расчета ионной силы будет иметь вид:
6. Определить коэффициент активности иона K + в водном растворе KCl с С(KCl) = 0,001 моль/л.
Коэффициент активности можно рассчитать, используя предельный закон Дебая-Хюккеля:

который в данном случае примет вид:

Ионную силу раствора найдем по формуле:
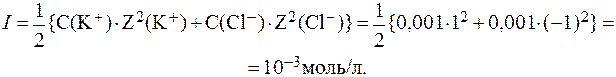


7. Определить коэффициент активности иона Fe 2+ в водном растворе, ионная сила которого равна 1.
В соответствии с законом Дебая-Хюккеля:
8. Определить константу диссоциации кислоты HA, если в растворе этой кислоты с концентрацией 0,1 моль/л a = 24%.
По величине степени диссоциации можно определить, что данная кислота является электролитом средней силы. Следовательно, для расчета константы диссоциации кислоты используем закон разведения Оствальда в его полной форме:
9. Определить концентрацию электролита, если a = 10%, Kд = 10 — 4 .
Из закона разведения Оствальда:
10. Степень диссоциации одноосновной кислоты HA не превышает 1%. 
По величине степени диссоциации можно определить, что данная кислота является слабым электролитом. Это позволяет использовать приближенную формулу закона разведения Оствальда:
11. Степень диссоциации электролита в его растворе с кон-центрацией 0,001 моль/л равна 0,009. Определить константу диссоциации этого электролита.
Из условия задачи видно, что данный электролит является слабым (a = 0,9%). Поэтому:
12. 
Рассчитаем 
Так как 
Коэффициенты активности ионов K + рассчитаем, используя закон Дебая-Хюккеля:
Коэффициент активности f — это мера отклонения в поведении раствора электролита данной концентрации от его поведения при бесконечном разведении раствора.
Так как f1 = 0,316 сильнее отклоняется от 1, чем f2 = 0,891, то в растворе с большей ионной силой наблюдается большее отклонение в поведении раствора KCl от его поведения при бесконечном разведении.
Вопросы для самоконтроля
1. Что такое электролитическая диссоциация?
2. Какие вещества называют электролитами и неэлектролитами? Приведите примеры.
3. Что такое степень диссоциации?
4. От каких факторов зависит степень диссоциации?
5. Какие электролиты считаются сильными? Какие средней силы? Какие слабыми? Приведите примеры.
6. Что такое константа диссоциации? От чего зависит и от чего не зависит константа диссоциации?
7. Как связаны между собой константа и степень диссоциации в бинарных растворах средних и слабых электролитов?
8. Почему растворы сильных электролитов в своем поведении обнаруживают отклонения от идеальности?
9. В чем заключается суть термина «кажущаяся степень диссоциации»?
10. Что такое активность иона? Что такое коэффициент актив-ности?
11. Как изменяется величина коэффициента активности с разбавлением (концентрированием) раствора сильного электролита? Каково предельное значение коэффициента активности при бесконечном разведении раствора?
12. Что такое ионная сила раствора?
13. Как вычисляют коэффициент активности? Сформулируйте закон Дебая-Хюккеля.
14. В чем суть ионной теории кислот и оснований (теории Аррениуса)?
15. В чем состоит принципиальное отличие протолитической теории кислот и оснований (теории Бренстеда и Лоури) от теории Аррениуса?
16. Как трактует электронная теория (теория Льюиса) понятие «кислота» и «основание»? Приведите примеры.
Варианты задач для самостоятельного решения
Вариант №1
1. Написать уравнение электролитической диссоциации Fe2(SO4)3.
2. Определить, чем с позиций теории Бренстеда является молекула H2O в реакции:
3. Рассчитать величину 
Вариант №2
1. Написать уравнение электролитической диссоциации CuCl2.
2. Определить, чем с позиций теории Льюиса является ион S 2 — в реакции:
2Ag + + S 2 — ⇄ Ag2S.
3. Вычислить молярную концентрацию электролита в растворе, если a = 0,75%, а 
Вариант №3
1. Написать уравнение электролитической диссоциации Na2SO4.
2. Определить, чем с позиций теории Льюиса является ион CN — в реакции:
Fe 3 + + 6CN — ⇄ [Fe(CN)6] 3 — .
3. Ионная сила раствора CaCl2 равна 0,3 моль/л. Рассчитать С(CaCl2).
Вариант №4
1. Написать уравнение электролитической диссоциации Ca(OH)2.
2. Определить, чем с позиций теории Бренстеда является молекула H2O в реакции:
3. Ионная сила раствора K2SO4 составляет 1,2 моль/л. Рассчитать С(K2SO4).
Вариант №5
1. Написать уравнение электролитической диссоциации K2SO3.
2. Определить, чем с позиций теории Бренстеда является ион NH4 + в реакции:
3. 
Вариант №6
1. Написать уравнение электролитической диссоциации K2S.
2. Определить, чем с позиций теории Льюиса является молекула AlBr3 в реакции:
3. Рассчитать ионную силу раствора, в 1 л которого содержится 0,5 моль NaNO3 и 0,5 моль CaCl2.
Вариант №7
1. Написать уравнение электролитической диссоциации Fe(NO3)2.
2. Определить, чем с позиций теории Льюиса является ион Cl — в реакции:
3. Рассчитать ионную силу раствора, в 1 л которого содержится 0,1 моль NH4NO3 и 0,1 моль Al2(SO4)3.
Вариант №8
1. Написать уравнение электролитической диссоциации K2MnO4.
2. Определить, чем с позиций теории Бренстеда является ион HSO3 — в реакции:
3. Рассчитать значения коэффициентов активности всех ионов в растворе, содержащем KNO3, LiCl и NaBr, при условии, что концентрации всех электролитов одинаковы и составляют 0,2 моль/л.
Вариант №9
1. Написать уравнение электролитической диссоциации Al2(SO4)3.
2. Определить, чем с позиций теории Льюиса является ион Co 3+ в реакции:
3. В 1 л раствора содержится 0,348 г K2SO4 и 0,17 г NaNO3. Определить ионную силу этого раствора.
Вариант №10
1. Написать уравнение электролитической диссоциации Ca(NO3)2.
2. Определить, чем с позиций теории Бренстеда является молекула H2O в реакции:
3. Вычислить концентрацию электролита в растворе, если a = 5%, а 
Вариант №11
1. Написать уравнение электролитической диссоциации KMnO4.
2. Определить, чем с позиций теории Льюиса является ион Cu 2+ в реакции:
3. Вычислить коэффициент активности иона Cu 2+ в растворе CuSO4 c С(CuSO4) = 0,016 моль/л.
Вариант №12
1. Написать уравнение электролитической диссоциации Na2CO3.
2. Определить, чем с позиций теории Бренстеда является молекула H2O в реакции:
3. Имеются два раствора NaCl, содержащие и другие электролиты. Значения ионной силы этих растворов соответственно равны: I1 = 0,1 моль/л, I2 = 0,01 моль/л. Сравнить коэффициенты активности f(Na + ) в данных растворах.
Вариант №13
1. Написать уравнение электролитической диссоциации Al(NO3)3.
2. Определить, чем с позиций теории Льюиса является молекула RNH2 в реакции:
3. Сравнить коэффициенты активности катионов в растворе, содержащем FeSO4 и KNO3, при условии, что концентрации электролитов составляют, соответственно, 0,3 и 0,1 моль/л.
Вариант №14
1. Написать уравнение электролитической диссоциации K3PO4.
2. Определить, чем с позиций теории Бренстеда является ион H3O + в реакции:
3. Рассчитать значения коэффициентов активности всех ионов в растворе, содержащем CuSO4 и KCl, при условии, что концентрации электролитов одинаковы и составляют 0,01 моль/л.
Вариант №15
1. Написать уравнение электролитической диссоциации K2SO4.
2. Определить, чем с позиций теории Льюиса является Pb(OH)2 в реакции:
3. Рассчитать ионную силу раствора, в 1 л которого содержится 0,2 моль Cu(NO3)2 и 0,2 моль FeCl3.
Вариант №16
1. Написать уравнение электролитической диссоциации Ni(NO3)2.
2. Определить, чем с позиций теории Бренстеда является ион гидроксония (H3O + ) в реакции:
3. Ионная сила раствора, содержащего только Na3PO4, равна 1,2 моль/л. Определить концентрацию Na3PO4.
Вариант №17
1. Написать уравнение электролитической диссоциации (NH4)2SO4.
2. Определить, чем с позиций теории Бренстеда является ион NH4 + в реакции:
3. Ионная сила раствора, содержащего одновременно KI и Na2SO4, равна 0,4 моль/л. С(KI) = 0,1 моль/л. Определить концен-трацию Na2SO4.
Вариант №18
1. Написать уравнение электролитической диссоциации Cr2(SO4)3.
2. Определить, чем с позиций теории Бренстеда является молекула белка в реакции:
3. Рассчитать ионную силу раствора, в 1 л которого содержится 0,1 моль KCl и 0,2 моль Na2S.
🔍 Видео
В результате диссоциации Al2(SO4)3 в водном растворе общее количество ионов и недиссоциированныхСкачать
Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Взаимодействие сульфата алюминия с раствором гидроксида натрия Al2(SO4)3 + NaOHСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

9 класс. Электролитическая диссоциация. Образование ионов.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Is Al2(SO4)3 Soluble or Insoluble in Water?Скачать

Электролиз. 10 класс.Скачать

Основные положения теории электролитической диссоциации | Химия 8 класс #41 | ИнфоурокСкачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Механизм электролитической диссоциации. 9 класс.Скачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать