- энергетика простыми словами
- Основные термодинамические процессы
- Изохорный процесс
- Изобарный процесс
- Изотермический процесс
- Адиабатный процесс
- Политропный процесс
- Политропный процесс | 20+ важных часто задаваемых вопросов и числовых значений
- Content
- Политропный процесс
- Определение политропный процесс
- Политропное уравнение | Политропное уравнение состояния
- Политропный индекс
- Политропный против изэнтропического процесса
- Политропный процесс против адиабатического процесса
- Политропная эффективность
- Политропная голова
- Политропный процесс для воздуха | Политропный процесс для идеального газа
- Примеры политропных процессов
- 1. Рассмотрим политропный процесс с индексом политропы. п = (1.1). Начальные условия: P1 = 0, В1 = 0 и заканчивается на P2= 600 кПа, В2 = 0.01 м 3 . Оцените проделанную работу и теплоотдачу.
- 2. Поршневой цилиндр содержит кислород при 200 кПа объемом 0.1 м. 3 и при 200 ° С. Масса добавляется так, чтобы газ сжимался с PV. 1.2 = постоянная до конечной температуры 400 ° C. Подсчитайте проделанную работу.
- 3. Рассмотрим аргон при 600 кПа, 30 ° C, сжатый до 90 ° C в политропном процессе с n = 1.33. Найдите проделанную работу на Газе.
- 4. Предположим, что масса 10 кг ксенона хранится в баллоне при 500 К, 2 МПа, расширение представляет собой политропный процесс (n = 1.28) с конечным давлением 100 кПа. Посчитайте проделанную работу. Учтите, что система имеет постоянную удельную теплоемкость.
- 5. Рассмотрим цилиндр-поршень с начальным объемом 0.3, содержащий 5 кг газообразного метана при давлении 200 кПа. Газ сжимают политропно (n = 1.32) до давления 1 МПа и объема 0.005. Рассчитайте теплопередачу во время процесса.
- 6. Примите во внимание цилиндр-поршень, содержащий 1 кг метана при 500 кПа, 20 ° C. Газ политропно сжимают до давления 800 кПа. Рассчитайте теплопередачу с показателем n = 1.15.
- 7. 1 кг гелия хранится в системе поршень-цилиндр при 303 К, 200 кПа сжимается до 400 К в обратимом политропном процессе с показателем степени n = 1.24. Гелий является идеальным газом, поэтому удельная теплоемкость будет фиксированной. Найдите работу и теплопередачу.
- 8. Предположите, что воздух хранится в баллоне объемом 0.3 литра при 3 МПа, 2000 К. Воздух расширяется в соответствии с обратимым политропным процессом с показателем степени n = 1.7, объемное соотношение в этом случае составляет 8: 1. Рассчитайте политропную работу для процесса и сравните ее с адиабатической работой, если процесс расширения следует за обратимым адиабатическим расширением.
- 9. В закрытом контейнере содержится 200 л газа при 35 ° C, 120 кПа. Газ сжимается в политропном процессе до температуры 200 ° C, 800 кПа. Найти политропную работу, совершаемую воздухом для n = 1.29.
- 10. Масса 12 кг газообразного метана при 150 ° C, 700 кПа подвергается политропному расширению с n = 1.1 до конечной температуры 30 ° C. Найти теплопередачу?
- 11. Узел цилиндр-поршень содержит R-134a при 10 ° C; объем 5 литров. Охлаждающая жидкость сжимается до 100 ° C, 3 МПа в соответствии с обратимым политропным процессом. рассчитать проделанную работу и теплоотдачу?
- 12. Является ли политропный процесс изотермическим по своей природе?
- 13. Обратим ли политропный процесс?
- 14. Адиабатический политропный процесс?
- 14. Что такое политропная эффективность?
- 15. Что такое гамма в политропном процессе?
- 16. что такое политропный процесс?
- 17. Какие выводы можно сделать для политропного процесса с n = 1?
- 18. Что такое неполитропный процесс?
- 21. В политропном процессе, когда PV n = константа, температура тоже постоянна?
- Политропный процесс
- Политропный процесс
Видео:Адиабатный процесс. 10 класс.Скачать

энергетика простыми словами
Видео:Политропный процессСкачать

Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Видео:30. Политропические процессыСкачать

Политропный процесс | 20+ важных часто задаваемых вопросов и числовых значений
Видео:Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Content
Видео:Физика. МКТ: Графики газовых процессов. Центр онлайн-обучения «Фоксфорд»Скачать

Политропный процесс
Видео:Основы теплотехники. Термодинамические процессы. Изохорный, изобарный, изотермический, адиабатный.Скачать

Определение политропный процесс
Видео:Термодинамика Л3.1. Политропический процесс. Термодинамические циклы и КПДСкачать

Политропное уравнение | Политропное уравнение состояния
Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Это метод постоянной удельной теплоемкости, при котором учитывается поглощение тепла газом из-за повышения температуры на единицу.
Видео:О.Я. Савченко 5.6.28* | Вывод уравнения политропыСкачать

Политропный индекс
- п nd закон термодинамики. Эти частные случаи используются в тепловом взаимодействии для астрофизики и химической энергии.
- п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
- n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
- 1 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
- γ st закон термодинамики,
Видео:ЧК_МИФ_ФМЛ_30 _ 2_2_5_3. ПОЛИТРОПНЫЕ ПРОЦЕССЫСкачать

Политропный против изэнтропического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Изэнтропический процесс, также известный как обратимый адиабатический процесс, представляет собой идеальный процесс, в котором не происходит передача энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу. Т.к. теплопередача равна нулю. дQ = 0
Согласно первому закону термодинамики,
Видео:Polytropic process in ThermodynamicsСкачать

Политропный процесс против адиабатического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Адиабатический процесс — это особое и специфическое состояние политропного процесса, при котором.
Подобно изэнтропическому процессу, в этом процессе также не происходит передачи энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу.
Видео:Выпуск 78. Политропный процесс. Решение задач по термодинамике.Скачать

Политропная эффективность
«Политропический КПД, точно определяемый как отношение идеальной работы сжатия для изменения перепада давления в многоступенчатом компрессоре к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре».
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
Видео:Термодинамика Л3. 2022. Изопроцессы. Политропический процесс. Вращательные степени свободыСкачать

Политропная голова
Политропный напор можно определить как напор, создаваемый центробежным компрессором при политропном сжатии газа или воздуха. Величина развиваемого давления зависит от плотности сжатого газа, и это зависит от изменения плотности газа.
γ = индекс адиабаты
zсредний = Средний коэффициент сжимаемости
η = политропная эффективность
Pd = Давление нагнетания
Ps = Давление всасывания
S = удельный вес газа
Ts = Температура всасывания
Видео:Урок 163. Задачи на графики процессов в газахСкачать

Политропный процесс для воздуха | Политропный процесс для идеального газа
Считается, что воздух является идеальным газом, и поэтому законы идеального газа применимы к воздуху.
………………………. Соотношение между давлением [P] и объемом [V]
………………………. Связь между объемом [В] и температурой [Т]
………………………. Связь между давлением [P] и температурой [T]
Видео:Урок 157. Изопроцессы и их графики. Частные газовые законыСкачать

Примеры политропных процессов
Видео:Селиверстов А. В. - Молекулярная физика - Семинар 20Скачать

1. Рассмотрим политропный процесс с индексом политропы. п = (1.1). Начальные условия: P1 = 0, В1 = 0 и заканчивается на P2= 600 кПа, В2 = 0.01 м 3 . Оцените проделанную работу и теплоотдачу.
Ответ: Работы, выполненные политропным процессом, предоставлены
Теплопередача определяется выражением
Видео:Выпуск 76. Продолжение выпуска 75. Адиабатный и политропный процессы.Скачать

2. Поршневой цилиндр содержит кислород при 200 кПа объемом 0.1 м. 3 и при 200 ° С. Масса добавляется так, чтобы газ сжимался с PV. 1.2 = постоянная до конечной температуры 400 ° C. Подсчитайте проделанную работу.
Ответ: Выполненная политропная работа определяется
Видео:Урок 162. Построение графиков изопроцессов в различных координатахСкачать
3. Рассмотрим аргон при 600 кПа, 30 ° C, сжатый до 90 ° C в политропном процессе с n = 1.33. Найдите проделанную работу на Газе.
Ответ: Выполненная политропная работа определяется
для аргона при 30 ° C составляет 208.1 Дж / кг. K
Принимая m = 1 кг
Видео:Polytropic process #thermodynamics #physics #jee2023 #neet2023Скачать

4. Предположим, что масса 10 кг ксенона хранится в баллоне при 500 К, 2 МПа, расширение представляет собой политропный процесс (n = 1.28) с конечным давлением 100 кПа. Посчитайте проделанную работу. Учтите, что система имеет постоянную удельную теплоемкость.
Ответ: Выполненная политропная работа определяется
для ксенона при 30 ° C — 63.33 Дж / кг. K
Принимая m = 10 кг
Видео:Лекция №1 "Основные понятия молекулярной физики"Скачать

5. Рассмотрим цилиндр-поршень с начальным объемом 0.3, содержащий 5 кг газообразного метана при давлении 200 кПа. Газ сжимают политропно (n = 1.32) до давления 1 МПа и объема 0.005. Рассчитайте теплопередачу во время процесса.
Ответ: Политропная теплопередача определяется
Видео:Консультация по термодинамике. Часть 1Скачать

6. Примите во внимание цилиндр-поршень, содержащий 1 кг метана при 500 кПа, 20 ° C. Газ политропно сжимают до давления 800 кПа. Рассчитайте теплопередачу с показателем n = 1.15.
Ответ: Политропная теплопередача определяется
Мы знаем, что R для метана = 518.2 Дж / кг. K
7. 1 кг гелия хранится в системе поршень-цилиндр при 303 К, 200 кПа сжимается до 400 К в обратимом политропном процессе с показателем степени n = 1.24. Гелий является идеальным газом, поэтому удельная теплоемкость будет фиксированной. Найдите работу и теплопередачу.
Ответ: Выполненная политропная работа определяется
R для гелия составляет 2077.1 Дж / кг.
Политропная теплопередача определяется выражением
8. Предположите, что воздух хранится в баллоне объемом 0.3 литра при 3 МПа, 2000 К. Воздух расширяется в соответствии с обратимым политропным процессом с показателем степени n = 1.7, объемное соотношение в этом случае составляет 8: 1. Рассчитайте политропную работу для процесса и сравните ее с адиабатической работой, если процесс расширения следует за обратимым адиабатическим расширением.
Ответ: Нам дается
Соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
Проделанная адиабатическая работа определяется выражением
Для процесса расширения Работа, выполняемая посредством обратимого адиабатического процесса, больше, чем Работа, выполняемая посредством обратимого политропного процесса.
9. В закрытом контейнере содержится 200 л газа при 35 ° C, 120 кПа. Газ сжимается в политропном процессе до температуры 200 ° C, 800 кПа. Найти политропную работу, совершаемую воздухом для n = 1.29.
Ответ: соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
10. Масса 12 кг газообразного метана при 150 ° C, 700 кПа подвергается политропному расширению с n = 1.1 до конечной температуры 30 ° C. Найти теплопередачу?
Ответ: Мы знаем, что R для метана = 518.2 Дж / кг. K
Политропная теплопередача определяется выражением
11. Узел цилиндр-поршень содержит R-134a при 10 ° C; объем 5 литров. Охлаждающая жидкость сжимается до 100 ° C, 3 МПа в соответствии с обратимым политропным процессом. рассчитать проделанную работу и теплоотдачу?
Ответ: Мы знаем, что R для R-134a = 81.49 Дж / кг. K
Выполненная политропная работа определяется выражением
Политропная теплопередача определяется выражением
12. Является ли политропный процесс изотермическим по своей природе?
Ответ: Когда n становится 1 для политропного процесса: согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
13. Обратим ли политропный процесс?
Ответ: политропные процессы внутренне обратимы. Вот несколько примеров:
п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV γ = C представляет собой постоянную температуру или изотермический процесс.
п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
n = Бесконечность: Представляет собой изохорный процесс или процесс постоянного объема.
14. Адиабатический политропный процесс?
Ответ: когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
14. Что такое политропная эффективность?
Ответ: Политропический КПД можно определить как отношение идеальной работы сжатия к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре. Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
15. Что такое гамма в политропном процессе?
Ответ: В политропном процессе, когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
16. что такое политропный процесс?
Ответ: Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Его также называют процессом с постоянной удельной теплотой, при котором тепло, поглощаемое газом, учитываемое из-за повышения температуры на единицу, является постоянным.
17. Какие выводы можно сделать для политропного процесса с n = 1?
Ответ: когда п = 1: PV n = C : Согласно предположению об идеальном газе, закон становится PV = C представляет собой постоянную температуру или изотермический процесс.
18. Что такое неполитропный процесс?
Ответ: Политропный процесс можно определить уравнением PV n = C показатель степени n называется индексом политропы. Когда,
- п 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа PV γ = C представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
- γn0). Как и в циклах сжатия пара, тепло теряется в горячее окружение. Изменение температуры происходит из-за изменения внутренней энергии, а не подводимого тепла. Произведенная работа превышает количество поданного или добавленного тепла. Таким образом, даже если при политропном расширении добавляется тепло, температура газа снижается.
21. В политропном процессе, когда PV n = константа, температура тоже постоянна?
Ответ: В политропном процессе, когда PV n = постоянная, температура остается постоянной только при показателе политропы n = 1. Для n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
Политропный процесс
Политропный процесс
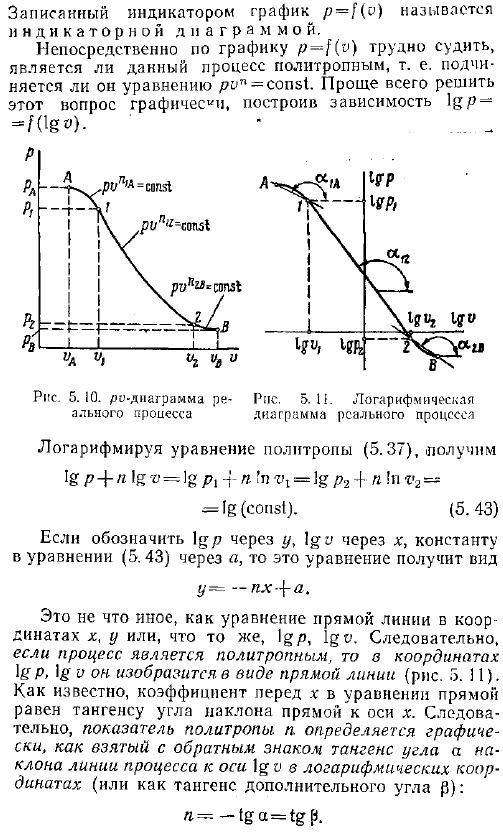
- Обычно фактический процесс работы теплового двигателя происходит при наличии теплообмена, р, в, Т изменений. То есть он не является теплоизолирующим, изобарическим, изобарическим или изотермическим. Для расчета такого процесса соотношение между давлением и объемом обычно выражается уравнениями вида ФВ plvlj p1v Конст. 5. 37. Процесс в соответствии с этим уравнением называется. Политолог. Показатель степени уравнения p НИИ называется политропным indicator. В некоторых процессах величина n постоянна, но в разных процессах политропный показатель может принимать любое число.
Для идеального газа по уравнению pv-rt можно найти уравнение политропного процесса, соединив параметры t, t и t, p. Для этого нужно заменить давление или объем в уравнении 5. 37 соответственно и выразить их с помощью уравнения Клапейрона. После преобразования получены следующие уравнения политропного процесса tv — — t — t2v — const 5. 38 5. 39 ТП т п t2p2. Уравнение 5. 37 5. 38 5. 39 поэтому связь между параметрами в начале и конце политропного процесса может быть легко получена. −1 5.
Поскольку уравнение (16-7) должно быть справедливо также и для воздуха, то одновременно с потоком частиц пара должен существовать и поток частиц воздуха, но в обратном направлении. Людмила Фирмаль
Сорок два. При изучении фактического процесса необходимо установить, является ли процесс политропой, и определить значение индекса политропы. Обычно при изучении работы тепловых машин двигателей, компрессоров и др. , давление и объем рабочей жидкости измеряются в процессе расширения и сжатия. По результатам таких измерений можно построить зависимость p f v рис. 5. 10.
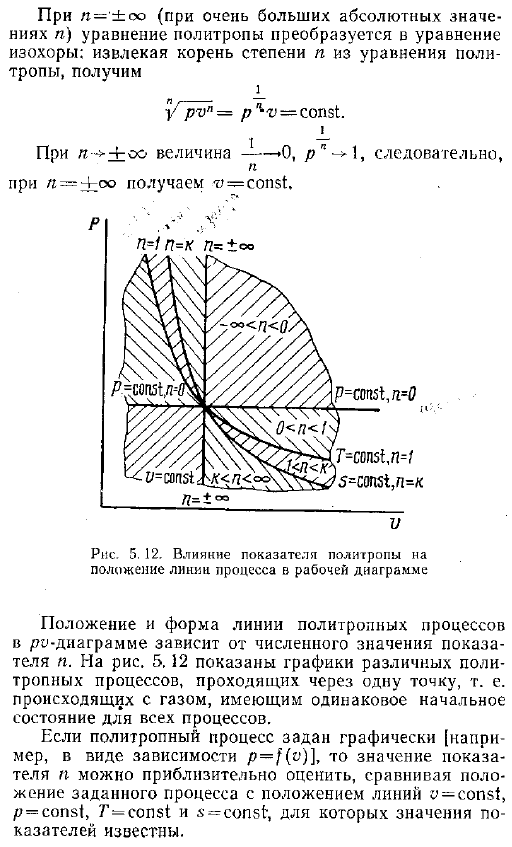
При исследовании работы поршневой машины двигателя внутреннего сгорания, компрессора и др. , такой график рисуют приборы так называемые индикаторы, которые автоматически измеряют изменения давления и объема. Графика р о описывается индикатор называется индикаторной диаграммы. Из графика p-f v трудно непосредственно определить, является ли этот процесс политропой, то есть следует уравнению pon const. Проще всего решить эту проблему графически, построив зависимость lg fog —. — Логарифм уравнения политропа 5. 37, ig p 4-n log-o g pi-i- to r 1 ig p2 4-n in v2— ИГ константа. 5. 43 Если igp обозначается через y, а igo-через x, а константа уравнения 5.
Через a, то это уравнение принимает вид В j -зл-Н. Это то же самое, что и линейные уравнения координат x, y или igp, lgv. So, если процесс представляет собой политропу, то она рисуется в виде прямой линии, с координатами igp, ig рис. 5. 11. Как известно, коэффициент x в уравнении прямой линии равен касательной наклона линии к оси x-axis. As в результате политропный индекс n определяется как тангенс угла a от противоположного знака в логарифмических координатах и как наклон технологической линии к оси МПО или как тангенс дополнительного угла Как будет определено. Обратите внимание, что не все процессы являются политропами.
Например, вы можете видеть, что только процесс at 5. 11, раздел 1-2 процесса at2b, можно считать политропой с равными показателями. Л12 — tga12. Если в координатах лгп фактический процесс МПО не представлен прямой линией, то он разбивается на короткие отрезки, в которых линия практически заменяется прямой segment. In примерный рисунок, раздел 5. 11, al n 2b, также можно считать политропой с индексами n, равными n a — tg u1a и 2b — tg g2b. — Если известно, что процесс является политропным, то значение показателя n можно определить по формуле 2 из значения параметра газа в любой точке этого процесса 5. 43.
Выражает давление по объему из Формулы 3. 2, формулы 5. 37. Эта формула такая же по форме, как и соответствующая формула для процесса термоизоляции, отличающаяся только обозначением индекса теплопроводности. Volume. So, в результате интегрирования вы получите формулу, аналогичную форме 5. Сорок семь Из уравнения состояния pioi этих выражений можно заменить на rt. Выполнив такую замену в выражении 5.
- Мы получим другое выражение, для которого работает политропный процесс. 4 — Г2. 5. 48. Теплотворная способность политропного процесса определяется по следующей формуле 5. 49 Вот, Джей Кг-град — это теплоемкость газа в политропном процессе, то есть процессе, в котором n является постоянной величиной. Теплоемкость газа политропного процесса определяется по общей формуле 4. 3. Для этого необходимо подставить отношение изменения объема к изменению температуры в политропном процессе. Эта зависимость получается путем дифференцирования уравнения 5. 41 политропного процесса переменной Г, о. После логарифма формулы 5.
Отсюда л-т л-1. Подставляя это выражение в выражение 4. 3, вы получаете Если привести их к общему знаменателю с круглыми скобками, то получится формула для теплоемкости газа в политропном процессе. Из этой формулы видно, что было решено учитывать удельную теплоту независимо от температуры удельная теплота идеального газа в политропном процессе будет постоянной. В отличие от теплоемкости cp и c, теплоемкость газа в политропном процессе может быть отрицательной. Это тот случай, когда значение индекса политропа n больше 1 и меньше k, то есть k n.
Так как массосодержание водяного пара иц и воздуха составляют в сумме единицу, градиент массосодержания пара соответствует градиенту маососодержания воздуха. Людмила Фирмаль
Отрицательная теплоемкость означает, что, несмотря на подвод тепла к газу, температура снижается, а при отводе тепла, наоборот, он становится горячим. Это, казалось бы, аномальное поведение температуры объясняется тем, что политропный процесс 1 l, а следовательно, cn 0, получается сильным расширением с небольшим запасом heat. In кроме того, это ln qn, и изменение внутренней энергии отрицательно. Л Несмотря на то, что тепло подается 1 0, когда внутренняя энергия газа уменьшается, температура уменьшается.
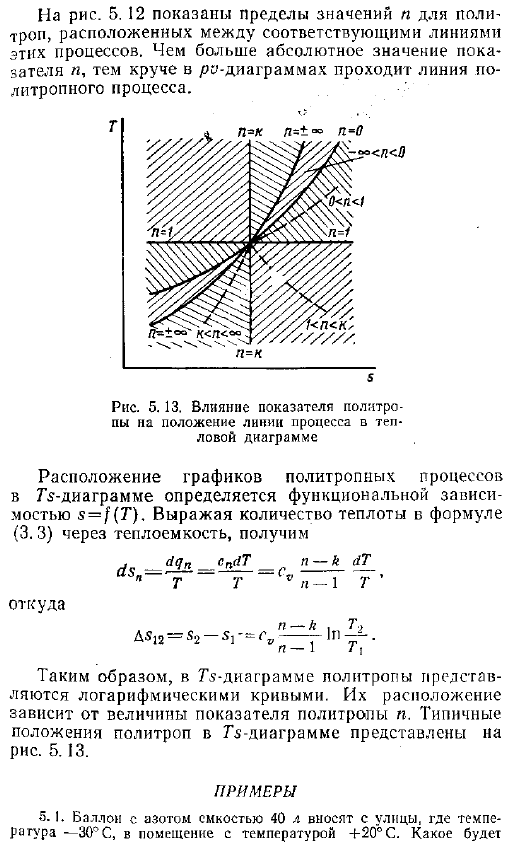
В процессе сжатия, если из рабочего тела удаляется меньше тепла, чем выполняется работа, то есть и В случае n избыточная энергия — qn увеличивает внутреннюю энергию газа, и температура повышается. Тепло удаляется н 0. Подставляя давление, выраженное в объеме по уравнению 3. 14 5. 37, показано, что работа газа, имеющаяся в политропном процессе, в n раз больше работы расширения в этом процессе, как это было сделано в адиабатическом процессе 5. 51 Рассмотренные ранее процессы изометрический, изобарный, изотермический, адиабатический-это частный случай политропного процесса. Каждое уравнение может быть представлено в виде swarm const со своим значением индикатора.
Фактически, в n-0 уравнение политропа принимает следующий вид pr 0 p-1 const или p const изобарный процесс. Если l 1, то политропное уравнение представляет собой изотермический процесс. Рv const и если l a, то политропы соответствуют адиабату. Роль const. В случае n- co где абсолютное значение n очень велико политропное уравнение преобразуется в однородное уравнение. Извлечение корней Порядка n из политропного уравнения дает ПВН Р v пост. Для n — oo значение равно −0 например — — — Лоо, вы получите.
Процесс работы диаграммы расположение и форма линии RO-диаграммы политропного процесса зависит от порядкового номера изделия .На рисунке 5 .12 показан график различных политропных процессов, проходящих через 1 точку .То есть все процессы протекают в одном и том же начальном состоянии газа .Если политропный процесс задан графически например, в виде зависимости p f o, то значение показателя N аппроксимируется путем сравнения положения данного процесса с положениями линий y const, p const, T const и s const .Значение индикатора известно .На рисунке 5 .12 показано ограничение на значение N в политропы между соответствующими линиями этих процессов .Чем выше абсолютное значение показателя, тем круче линия политропного процесса .Рис .
Влияние индекса политропа на расположение технологической линии на диаграмме горячей проволоки Положение графика политропного процесса на диаграмме G определяется зависимостью функции s T .Если величина теплоты уравнения 3 .3 выражается в терминах удельной теплоты, то она выглядит следующим образом Откуда AS12 С2-с — сі, — г п г — Таким образом, в схеме ТС, политроп представлены логарифмические кривые .Их расположение зависит от величины политропного показателя n .на рисунке показано типичное положение политроп на диаграмме G .5 .13 .Пример 5 .1 .Возьмите баллон с емкостью 40 литров азота с улицы, где температура составляет −3 C, в помещение с температурой 20 C .Давление в баке и температура азота равны давлению в баке 98 dir Тепло, и равное cv 742 Дж Кг-град .Решение .О нагревании шара .- Меняйся, Трейс .— 297 Дж кг град- 2 .7 найти 9810S-0 .04 М ря, 7а-Д 5 .45-742 .10-1 293-243 −202 кДж .




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института