Задание А 11 ЕГЭ по химии —
Характерные химические свойства солей: средних, кислых, оснoвных, комплексных
Темы, которые нужно знать:
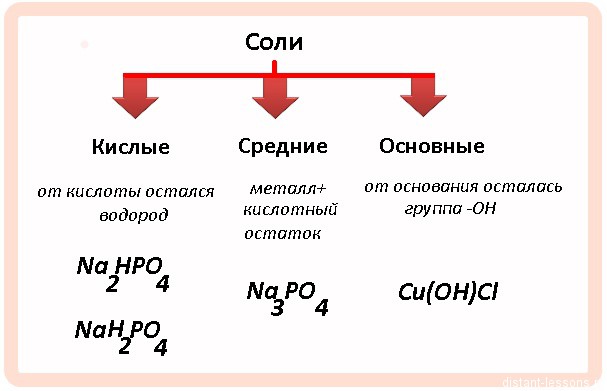
Сначала давайте рассмотрим классификацию солей:
Сначала рассмотрим общие химические свойства солей, затем разберем особенности кислых и основных.
1. Взаимодействие с металлами : реакция будет идти, если металл стоит в ряду напряжений левее катиона соли:
Na + AgCl = NaCl + Ag↓
2. Взаимодействие с основаниями: идет в том случае, если выделяется осадок, газ или малодиссоциирующее вещество:
3. Взаимодействие с кислотами : то же условие — выделение осадка, газа или малодиссоциирующего вещества:
4. Cоли могут взаимодействовать между собой на тех же условиях: осадок, газ, малодиссоциирующее вещество:
В химические свойства солей также входит диссоциация.
Диссоциация солей
В воде соли полностью (теоретически) или частично диссоциируют на ионы.
- Диссоциация средних солей : XA → X + + A —
Na2SO4 → 2Na + + SO4 2- - Диссоциация кислых солей: ХHA → X + + HA — — первая ступень, вторая ступень: HA — = H + + A 2-
NaHSO4 → Na + + HSO4 — HSO4 — = SO4 2- + H + - Диссоциация основных солей: Х(OH)A → X(OH) + + A — — первая ступень, вторая ступень: X(OH) + = X 2+ + OH —
MgOHCl → MgOH + +Cl —
MgOH + → Mg 2+ + OH —
Получение кислой соли из средней: средняя соль + соответствующая кислота: Na2CO3 + H2CO3 = 2NaHCO3
Получение основной соли из средней: средняя соль + соответствующее основание: CuCl2 + Cu(OH)2 = 2Cu(OH)Cl
Получение средней соли из основной: основная соль + соответствующая кислота: Cu(OH)Cl + HCl = CuCl2 + H2O
Получение средней соли из кислой: кислая соль + соответствуящее основание: NaHCO3 + NaOH = Na2CO3 + H2O
Химические свойства солей — гидролиз
Гидролиз средних солей мы уже рассматривали раньше (см. лекцию)
Химические свойства двойных солей
У двойных солей есть небольшая особенность — в реакцию всегда вступают оба катиона:
Кстати, давайте разберем наш вопрос: с чем будет реагировать карбонат бария BaCO3
1) H2SO4 + NaOH — осадообразуется только с сульфат-ионом;
2) NaCl и CuSO4 — осадообразуется только с сульфат-ионом;
в обоих реакциях — выделение газа;
4) NaHCO3 и HNO3 — газ выделется только при взаимодействии с кислотой
Ответ: 3) HCl и СH3COOH
- Напишите уравнения реакций перевода кислых и основных солей, в средние соли?
- Бывает ли у Be(OH)2 + HCl кислая и средняя и основная соль если можно и реакцию напишите за ранее спасибо?
- Назвать по международной номенклатуре следующие соли и написать уравнения перевода кислых и основных солей в средние?
- Напишите уравнения реакций, с помощью которых, исходя из калия, серы, кислорода и водорода, можно получить три средние соли, три кислые соли и три кислоты?
- По уравнению реакции получить среднюю, кислую и основную соли, дать названия всем веществам Ca(OH)2 + H2SO3?
- Нужна помощь задание следующие : Напишите уравнения реакций перевода кислых и основных солей, в средние соли?
- С многоосновными кислотами аммиак образует не только средние, но и кислые соли?
- При нейтрализации фосфорной кислоты могут образоваться кислые соли?
- Напишите образование кислых, средних и основных солей образованных серной кислотой и гидроксидом бария?
- Дописать уравнения реакций (получить среднюю, кислую, основную соли) :KOH + H2CO3 =Zn(OH)2 + HCl = Пожалуйста с разьяснением и указанием вида соли?
- Напишите 2 уравнения основной оксид + кислая соль = соль + вода?
- Химические свойства и способы получения солей
- Классификация солей
- Получение солей
- Химические свойства солей
- 📸 Видео
Видео:СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Напишите уравнения реакций перевода кислых и основных солей, в средние соли?
Химия | 10 — 11 классы
Напишите уравнения реакций перевода кислых и основных солей, в средние соли.
Видео:Соли. 8 класс.Скачать

Бывает ли у Be(OH)2 + HCl кислая и средняя и основная соль если можно и реакцию напишите за ранее спасибо?
Бывает ли у Be(OH)2 + HCl кислая и средняя и основная соль если можно и реакцию напишите за ранее спасибо.
Видео:Полный Гайд по Химии для начинающих — Соли, Кислые СолиСкачать

Назвать по международной номенклатуре следующие соли и написать уравнения перевода кислых и основных солей в средние?
Назвать по международной номенклатуре следующие соли и написать уравнения перевода кислых и основных солей в средние.
Спасибо за ранее!
Видео:Основные солиСкачать

Напишите уравнения реакций, с помощью которых, исходя из калия, серы, кислорода и водорода, можно получить три средние соли, три кислые соли и три кислоты?
Напишите уравнения реакций, с помощью которых, исходя из калия, серы, кислорода и водорода, можно получить три средние соли, три кислые соли и три кислоты.
Видео:44. Кислые и основные солиСкачать

По уравнению реакции получить среднюю, кислую и основную соли, дать названия всем веществам Ca(OH)2 + H2SO3?
По уравнению реакции получить среднюю, кислую и основную соли, дать названия всем веществам Ca(OH)2 + H2SO3.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Нужна помощь задание следующие : Напишите уравнения реакций перевода кислых и основных солей, в средние соли?
Нужна помощь задание следующие : Напишите уравнения реакций перевода кислых и основных солей, в средние соли.
CaOHN0_3 (Нитрат кальция).
Видео:Кислые и основные соли | ЕГЭ по химии | Екатерина СтрогановаСкачать

С многоосновными кислотами аммиак образует не только средние, но и кислые соли?
С многоосновными кислотами аммиак образует не только средние, но и кислые соли.
Напишите формулы кислых солей, которые он может дать при взаимодействии с фосфорной кислотой.
Назовите их и напишите уравнения диссоциации этих солей.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

При нейтрализации фосфорной кислоты могут образоваться кислые соли?
При нейтрализации фосфорной кислоты могут образоваться кислые соли.
Напишите уравнение реакции , в результате которых образуются средние и кислые соли фосфорной кислоты.
Видео:Кислые солиСкачать

Напишите образование кислых, средних и основных солей образованных серной кислотой и гидроксидом бария?
Напишите образование кислых, средних и основных солей образованных серной кислотой и гидроксидом бария.
Дайте названия данным солям.
Видео:Кислые соли. Простое объяснениеСкачать

Дописать уравнения реакций (получить среднюю, кислую, основную соли) :KOH + H2CO3 =Zn(OH)2 + HCl = Пожалуйста с разьяснением и указанием вида соли?
Дописать уравнения реакций (получить среднюю, кислую, основную соли) :
Zn(OH)2 + HCl = Пожалуйста с разьяснением и указанием вида соли.
Видео:Кислые соли. Получение солейСкачать

Напишите 2 уравнения основной оксид + кислая соль = соль + вода?
Напишите 2 уравнения основной оксид + кислая соль = соль + вода.
Основной оксид + кислая соль = соли + вода.
На этой странице находится вопрос Напишите уравнения реакций перевода кислых и основных солей, в средние соли?, относящийся к категории Химия. По уровню сложности данный вопрос соответствует знаниям учащихся 10 — 11 классов. Здесь вы найдете правильный ответ, сможете обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С помощью автоматического поиска на этой же странице можно найти похожие вопросы и ответы на них в категории Химия. Если ответы вызывают сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
1) NaOH + H2 2) ZnS 3) ZnO 4) ZnCl2 + H2 5) ZnCl2 + Fe 6) Mg(OH)2 + H2 7) Mg3P2 8) — 9) MgCl2 10) — 11) MgSO4 + Ni 12) AlBr3 13) Al2(SO4)3 + Fe 14) AlI3 + H2.
FeO + P = Fe + P2O5 1)восстановитель Fe (в степени — 2) – 2е = Fe (в нулевой степени) 2)окислитель Р (в нулевой степени) + 5е = P (в степени + 5).
Химия используется при уборке в доме , мытьё посуды . В сельской хозяйственности для орошения полей от вредителей . В медецине для создания лекарств .
Ba — металлическая BaBr2 — ионная HBr — ковалентная полярная Br2 — ковалентная не полярная.
Ba — металлическая HBr — Ковалентная полярная Br2 — ковалентная не полярная BaBr2 — ионная.
Ми знаємо формулу знаходження масової частки елемента в речовині і у цю формулу підставляємо значення, знаходимо скількі атомів Оксигена у формулі .
В этих местах останутся желтые пятна, а потом они станут оранжевые.
2Al(OH)3 = Al2O3 + 3H2O H2CO3 = CO2 + H2O CACO3 = CAO + CO2( газ) CU(OH)2 = CUO + H2O Zn + 2HCl = ZnCl2 + H°2(газ) Ca° + H2SO4 = CaSO4 + H°2(газ) 3Mg° + 2H3PO4 = Mg3(PO4)2 + H°2(газ) 2Al° + Fe2O3 = Al2O3 + 2Fe° Cu(No3) + NaOH = Cu(OH) (осадок) + NaNo..
2Al(OH)3 — — >Al2O3 + 3H2O H2CO3 — — >CO2 + H2O CaCO3 — — >CaO + CO2 Cu(OH)2 — — >CuO + H2O Zn + 2HCL — — >ZnCL2 + H2 Ca + H2SO4 — — >CaSO4 + H2 3Mg + 2H3PO4 — — >Mg3(PO4)2 + 3H2 2Al + Fe2O3 — — >2Fe + Al2O3 Cu(NO3)2 + 2NaOH — — >Cu(OH)2 + 2NaNO3 HNO..
Вещества : вода, медь Тела : льдина , ваза, труба, гвоздь, сосулька.
Видео:Химические свойства кислых солей и их образованиеСкачать

Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Классификация солей
Видео:29. Гидролиз средних и кислых солей. Почему у кислых солей может быть щелочная среда?Скачать

Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Видео:Кислые соли | Химия ОГЭ 2022 | УмскулСкачать

Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
- Галогениды серебра (кроме AgF):
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
📸 Видео
Гидролиз солей. 9 класс.Скачать

Классификация солей | 8-11 классыСкачать

6. Классификация солей: средние, кислые, основные, двойные, смешанные и комплексные солиСкачать

Кислые соли простое объяснениеСкачать

8 класс. Кислоты и соли. Составление формул солей по валентности.Скачать