| Законы идеальных газов |   |
| В XVII – XIX веках были сформулированы опытные законы идеальных газов. Кратко напомним их. Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным. 1. Изохорический процесс. Закон Шарля. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const. График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ— и VT-диаграммах (рис. 1.6). Уравнение изохоры:
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const. График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV— и РT-диаграммах (рис. 1.8).
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const. График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT— и РT-диаграммах (рис. 1.10).
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой. 5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов. 6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·10 23 молекул (число Авогадро). 7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
При
В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа Видео:Урок 133. Закон Бернулли. Уравнение БернуллиСкачать  Уравнение p p1 p2 pn представляет собойУравнение Менделеева-Клапейрона — уравнение состояния для идеального газа, отнесенное к 1 молю газа. В 1874 г. Д. И. Менделеев на основе уравнения Клапейрона объединив его с законом Авогадро, используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа: pV = RT , где R — универсальная газовая постоянная, R = 8,31 Дж/(моль . К) Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа. Для произвольной массы газа М, молярная масса которого m: pV = (М/m) . RT. или pV = NАkT, где NА — число Авогадро, k — постоянная Больцмана. С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров — давление, объем или температура — остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа. Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа. Изотермический процесс — процесс изменения состояния системы при постоянной температуре. Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон Бойля — Мариотта. Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой — термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему: P1V1=P2V2=const. Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы. Изобарный процесс — процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это закон Гей-Люссака. Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре: V/T=const. Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов. Изохорный процесс — процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля. Согласно закону Шарля, давление газа прямо пропорционально его температуре: P/T=const. Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов. Итак, из закона pV = (М/m) . RT выводятся следующие законы: p = const => V/T = const — закон Гей — Люссака . V= const => p/T = const — закон Шарля Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. Парциальное давление — это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси. Некоторых, возможно, интересует вопрос, каким образом удалось определить постоянную Авогадро NA = 6,02·10 23 ? Значение числа Авогадро было экспериментально установлено только в конце XIX – начале XX века. Опишем один из таких экспериментов. В откачанный до глубокого вакуума сосуд объемом V = 30 мл поместили навеску элемента радия массой 0,5 г и выдержали там в течение одного года. Было известно, что за секунду 1 г радия испускает 3,7·10 10 альфа-частиц. Эти частицы представляют собой ядра гелия, которые тут же принимают электроны из стенок сосуда и превращаются в атомы гелия. За год давление в сосуде выросло до 7,95·10 -4 атм (при температуре 27 о С). Изменением массы радия за год можно пренебречь. Итак, чему равна NA? Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов: N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов. Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда: NA = NRT = 5,83 . 10 17 . 0,0821 . 300 = 6,02 . 10 23 PV 7,95 . 10 -4 . 3 . 10 -2 В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время. Видео:Задание 10 ЕГЭ ПрофильСкачать  Опытные законы идеального газаВ молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что: 1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда; 2) между молекулами газа отсутствуют силы взаимодействия; 3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. Относительное число атомов или молекул в теле характеризуется особой физической величиной, называемой количеством вещества. Она равна отношению числа молекул в данном теле к числу атомов NА в 12 г углерода. Количество вещества выражают в молях. Моль – это количество вещества, содержащего столько же молекул, сколько атомов содержится в углероде массой 12 г. Na = 6,022 × 10 23 моль –1 называют постоянной Авогадро [А. Авогадро (1776–1856) – итальянский физик и химик]. Рассмотрим законы, описывающие поведение идеальных газов. рV = const при T = const, m = const. Кривая, изображающая зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рисунок 1). Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах р, t (рисунок 3) он изображается прямой, называемой изохорой. В уравнениях (1.3) и (1.4) t – температура по шкале Цельсия, р0 и V0 – давление и объем при Если в формулы (1.3) и (1.4) подставить данный коэффициент, то они, соответственно, примут вид Учитывая формулу (1.1), можно перейти к термодинамической температуре Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41 × 10 –3 м 3 /моль. Парциальное давление – давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре. 1.5 Уравнение Клапейрона – Менделеева Состояние некоторой массы газа можно определить тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением где каждая из переменных является функцией двух других. В соответствии с законами Бойля – Мариотта (1) и Гей-Люссака (5) запишем Выражение (7) является уравнением Клапейрона, в котором В – газовая постоянная, различ-ная для разных газов. Русский ученый Д.И. Менделеев (1834–1907) объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (7) к одному молю, использовав молярный объем Vm. Согласно закону Авогадро при одинаковых p и T моли всех газов занимают одинаковый молярный объем Vm, поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной. Уравнению удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клапейрона – Менделеева. Числовое значение молярной газовой постоянной определим из формулы (8), полагая, что моль газа находится при нормальных условиях (р0 = 1,013 × 10 5 Па, T0 = 273,15 К, Vm = 22,41 ´ От уравнения (8) для моля газа можно перейти к уравнению Клапейрона – Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем Vm, то при тех же условиях масса m газа займет объем V = (m/M)Vm, где М – молярная масса (масса одного моля вещества). Единица молярной массы – килограмм на моль (кг/моль). Уравнение Клапейрона – Менделеевадля массы m газа где v = m/M – количество вещества; р, V, Т – термодинамические параметры данного состояния; R – универсальная газовая постоянная; М – молярная масса газа. Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана: Исходя из этого, уравнение состояния (8) запишем в виде следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1 м 3 газа при нормальных условиях, называется числом Лошмидта [И. Лошмидт (1821–1895) – австрийский химик и физик]: 🌟 ВидеоУрок 134. Применения уравнения Бернулли (ч.1)Скачать  Что такое параметр? Уравнения и неравенства с параметром. 7-11 класс. Вебинар | МатематикаСкачать  Вебинар 7. Физика. ЕГЭ 2019. Тепловое равновесие. Уравнение состояния. ИзопроцессыСкачать  Уравнения с параметром. Алгебра, 8 классСкачать  Математика в физике | Решение уравнений, неравенств | ЕГЭ 2023 по физикеСкачать  Математика | Параметр. Система уравнений с параметромСкачать  8 класс, 39 урок, Задачи с параметрамиСкачать  Урок 127 (осн). Задачи на уравнение теплового баланса - 1Скачать  Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать  Уравнение равномерного движения. Решение задач по теме.Скачать 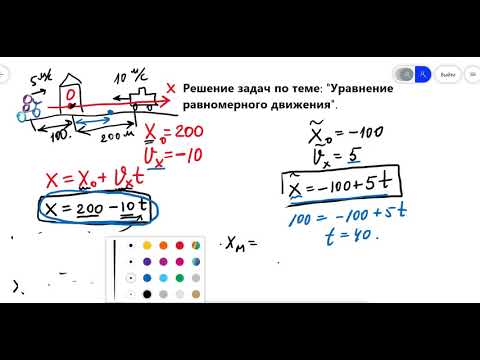 Уравнения метадинамикиСкачать  ЕГЭ 10 номер. Разбор задачи про уменьшение объема газаСкачать  Урок 146. Основное уравнение МКТ идеального газа - 2Скачать  Решение задач на уравнение теплового баланса. Физика 8 классСкачать  Задание 10. Типовые задания. Показательные уравнения и неравенства.Скачать  Урок 132. Основные понятия гидродинамики. Уравнение непрерывностиСкачать  |



 .
.


 , давление смеси газов:
, давление смеси газов:






 Закон Бойля – Мариотта [Р. Бойль (1627–1691) – английский ученый; Э. Мариотт (1620–1684) – французский физик]: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
Закон Бойля – Мариотта [Р. Бойль (1627–1691) – английский ученый; Э. Мариотт (1620–1684) – французский физик]: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
 Закон Шарля [(Ж. Шарль (1746–1823) – французский ученый]: давление данной массы газа при постоянном объеме изменяется линейно с температурой:
Закон Шарля [(Ж. Шарль (1746–1823) – французский ученый]: давление данной массы газа при постоянном объеме изменяется линейно с температурой: Закон Гей-Люссака [Ж. Гей-Люссак (1778–1850) – французский ученый]: объем данной массы газа при постоянном давлении изменяется линейно с температурой:
Закон Гей-Люссака [Ж. Гей-Люссак (1778–1850) – французский ученый]: объем данной массы газа при постоянном давлении изменяется линейно с температурой: или
или V/T = const при p = const, m = const;
V/T = const при p = const, m = const; Закон Дальтона [Дж. Дальтон (1766–1844) – английский химик и физик]: давление смеси идеальных газов равно сумме парциальных давлений pi, p1, p2. рn входящих в нее газов:
Закон Дальтона [Дж. Дальтон (1766–1844) – английский химик и физик]: давление смеси идеальных газов равно сумме парциальных давлений pi, p1, p2. рn входящих в нее газов: Французский физик и инженер Б. Клапейрон (1799–1864) вывел уравнение состояния идеаль-ного газа, объединив законы Бойля – Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V1, имеет давление p1 и находится при температуре T1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами p2, V2, T2 (рисунок 4). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: 1) изотермического (изотерма 1–1′); 2) изохорного (изохора 1′–2).
Французский физик и инженер Б. Клапейрон (1799–1864) вывел уравнение состояния идеаль-ного газа, объединив законы Бойля – Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V1, имеет давление p1 и находится при температуре T1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами p2, V2, T2 (рисунок 4). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: 1) изотермического (изотерма 1–1′); 2) изохорного (изохора 1′–2). .
.
 Taк как состояния 1 и 2 были выбраны произвольно, то для данной массы газа величина рV/Т остается постоянной, т.е.
Taк как состояния 1 и 2 были выбраны произвольно, то для данной массы газа величина рV/Т остается постоянной, т.е. pVm = RT
pVm = RT


 где NA/Vm = n – концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
где NA/Vm = n – концентрация молекул (число молекул в единице объема). Таким образом, из уравнения