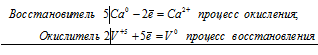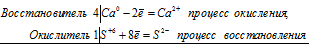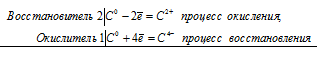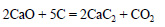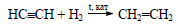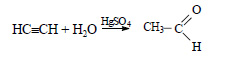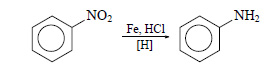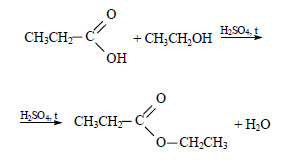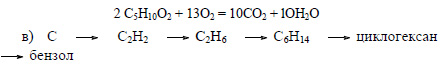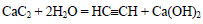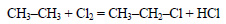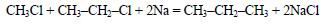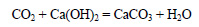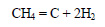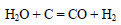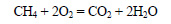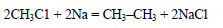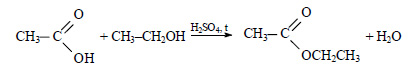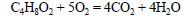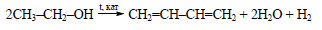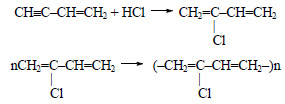Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Видео:Реакция оксида кальция с водой | CaO + H2O = Ca(OH)2Скачать

Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Характеристика химических свойств кальция
Задание 337
Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнения реакций кальция: а) с V2O5; б) СаSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
Благодаря большому отрицательному значению 
Уравнения реакций кальция:
5Ca 0 + 2V +5 = 5Ca 2+ + 2V 0
б) Ca + СаSO4 = CaO + CaS
4Ca 0 + S +6 = 4Ca 2+ + S 2-
4Са + CaSO4 = 4СаО + CaS
Задание 338
Какие соединения называют негашеной и гашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
Решение:
СаО – оксид кальция называют «негашеная известь». Са(ОН)2 – гидроксид кальция называют «гашённая известь».
а) Оксид кальция получают при термическом разложении известняка СаСО3:
Этот процесс протекает при температуре 1000 0 С (промышленный метод получения СаО).
б) При спекании известняка и графита получают оксид кальция:
Гашённую известь получают при действии воды на оксид кальция:
При прокаливании негашеной извести с углём образуется карбид кальция:
СаО + 3С СаС2 + СО
2Ca 0 + С 0 = 2Ca 2+ + С 4-
Таким образом, углерод является и окислителем, и восстановителем в данной реакции. Эта реакция является реакцией самоокисления-самовосстановления (реакцией диспропорционирования, дисмутации), потому что протекает с одновременным уменьшением и увеличением степени окисления одного и того же элемента (С – уголь).
Задание 339
Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
Решение:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

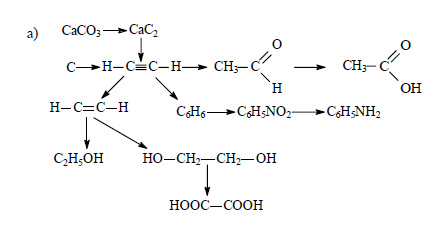
Составьте уравнения реакций по следующей схеме, отражающей генетическую связь между органическими и неорганическими веществами:
Ответ:
При сильном нагревании карбонат кальция разлагается на оксид кальция и оксид углерода (IV):
Оксид кальция при высокой температуре реагирует с углем с образованием карбида кальция:
При действии на карбид кальция воды получается ацетилен:
Этиловый спирт из ацетилена можно получить в две стадии. При гидрировании ацетилена в присутствии катализатора образуется этилен:
При присоединении к этилену воды в присутствии кислот образуется этиловый спирт.
При окислении этилена раствором перманганата калия образуется этиленгликоль:
При окислении этиленгликоля образуется щавелевая кислота:
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
При окислении уксусного альдегида образуется уксусная кислота:
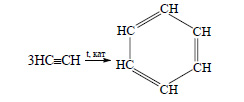
Из трех молекул ацетилена может образоваться молекула бензола (реакция тримеризации):
При действии на бензол смеси концентрированной азотной кислоты и концентрированной серной кислоты происходит замещение атома водорода на нитрогруппу и образуется нитробензол:
Нитробензол можно восстановить в аминобензол (анилин):
Из этана в две стадии можно получить этанол. При хлорировании этана образуется хлорэтан:
При действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.
При реакции этанола с пропионовой кислотой образуется этилпропионат (этиловый эфир пропионовой кислоты):
При сгорании этилпропионата образуется оксид углерода (IV). Молекулярная формула этилпропионата C5H10O2.
Оксид кальция при высокой температуре реагирует с углем с образованием карбида кальция:
При действии на карбид кальция воды получается ацетилен:
При хлорировании этана образуется хлорэтан:
При реакции хлорэтана с хлорметаном в присутствии натрия образуется пропан:
Из пропана в две стадии можно получить гексан. При хлорировании пропана образуется смесь изомеров – 1-хлорпропана и 2-хлорпропана. Изомеры имеют разные температуры кипения и их можно разделить перегонкой.
При взаимодействии 1-хлорпропана с натрием образуется гексан:
При взаимодействии 1-хлорпропана с натрием образуется гексан:
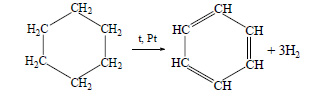
Бензол можно получить также при дегидрировании циклогексана:
г) Составьте уравнения реакций согласно второму форзацу учебника «Химия-11»:
При горении угля образуется оксид углерода (IV):
При реакции оксида углерода с гидроксидом кальция образуется оксид углерода (IV):
При сильном нагревании карбонат кальция разлагается на оксид кальция и оксид углерода (IV):
Оксид кальция образуется также при реакции кальция с кислородом:
При реакции кальция с водой образуется гидроксид кальция:
При реакции кальция с соляной кислотой образуется хлорид кальция:
Из хлорида кальция можно получить кальций электролизом расплава:
При реакции кальция или оксида кальция с углеродом при высокой температуре образуется карбид кальция:
При реакции карбида кальция с водой образуется ацетилен:
Ацетилен можно получить также из метана:
При разложении метана образуется также углерод:
Синтез-газ можно получить, пропуская водяной пар через раскаленный уголь:
Синтез-газ получают также из смеси метана и кислорода при нагревании в присутствии катализатора. При этом протекают следующие реакции: часть метана сгорает с образованием оксида углерода (IV) и воды.
Затем образовавшиеся вода и оксид углерода (IV) взаимодействую с оставшимся метаном:
Из синтез-газа можно получить уксусный альдегид при помощи следующей последовательности реакций:
При пропускании синтез-газа над катализатором образуется метанол:
При действии на метанол хлороводорода в присутствии серной кислоты образуется хлорметан (метилхлорид):
При взаимодействии хлорметана с натрием образуется этан (реакция Вюрца):
Из этана в две стадии можно получить этанол. При хлорировании этана образуется хлорэтан:
При действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.
Этанол окисляется оксидом меди при нагревании в уксусный альдегид:
При гидрировании ацетилена в присутствии катализатора образуется этилен:
Наоборот, при дегидрировании ацетилена образуется этилен:
При присоединении к этилену воды в присутствии кислот образуется этиловый спирт.
При сильном нагревании этилового спирта с серной кислотой происходит дегидратация и образуется этилен:
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
При окислении уксусного альдегида образуется уксусная кислота:
При восстановлении уксусного альдегида образуется этиловый спирт:
При реакции уксусной кислоты с этиловым спиртом образуется этилацетат:
При горении этилацетата образуется оксид углерода (IV):
Из этилового спирта в присутствии катализаторов образуется 1,3-бутадиен:
При полимеризации бутадиена получается синтетический каучук.
Ацетилен димеризуется с образованием винилацетилена.
При присоединении к винилацетилену хлороводорода образуется 2-хлорбутадиен-1,3 (хлоропрен), при полимеризации которого образуется хлоропреновый каучук.
При тримеризации ацетилена образуется бензол:
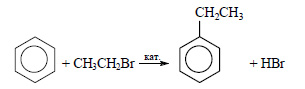
При реакции бензола с бромэтаном в присутствии катализатора образуется этилбензол (алкилирование бензола):
При дегидрировании этилбензола образуется винилбензол (стирол):
При полимеризации стирола образуется полистирол:

задача №1
к главе «Глава VII. Генетическая связь органических и неорганических веществ».
🎦 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

. Взаимодействие оксида кальция с водойСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химия 8 класс (Урок№9 - Относительная плотность газов. Объёмные отношения газов.)Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Получение оксида кальцияСкачать

Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Реакция Оксида Кальция и Серной Кислоты. Реакция CaO и H2SO4.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать