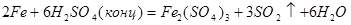Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например , хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например , хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства , а именно реагирует с кислотами . При этом образуются соответствующие соли.
Например , гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
3. Гидроксид железа (II) проявляет сильные восстановительные свойства , и реагирует с окислителями. При этом образуются соединения железа (III) .
Например , гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Видео:Опыты по химии. Получение гидроксида железа (II) и изучение его свойствСкачать

Гидроксид железа (II)
| Гидроксид железа (II) | |
|---|---|
| Систематическое название | Гидроксид железа (II) |
| Химическая формула | Fe(OH)2 |
| Внешний вид | белые или светло-зелёные кристаллы |
| Молярная масса | 89,86 г/моль |
| Температура разложения | 150—200 °C |
| Плотность | 3,4 г/см³ |
| Твёрдость по Моосу | 3,5—4 |
| Константа диссоциации pKb | 1,92 |
| Растворимость в воде | 5,2⋅10 −5 г/100 мл |
| Произведение растворимости | 7,9⋅10 −16 |
| Кристаллическая решётка | тригональная |
| Стандартная энтальпия образования | −574 кДж/моль |
| Стандартная молярная энтропия | +92 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −493 кДж/моль |
| Регистрационный номер CAS | 18624-44-7 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Гидроксид железа (II) — неорганическое вещество с формулой Fe(OH)2, соединение железа. Амфотерный гидроксид с преобладанием основных свойств. Кристаллическое вещество белого (иногда с зеленоватым оттенком) цвета, на воздухе со временем темнеет. Является одним из промежуточных соединений при ржавлении железа.
Видео:Получение гидроксида железа (II) Fe(OH)2Скачать

Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 4 Получение
- 5 Применение
Видео:Гидроксид Железа (II) - ПОЛУЧЕНИЕСкачать

Нахождение в природе
Гидроксид железа (II) встречается в природе в виде минерала амакинита. Данный минерал содержит примеси магния и марганца (эмпирическая формула Fe0,7Mg0,2Mn0,1(OH)2). Цвет минерала жёлто-зелёный или светло-зелёный, твёрдость по Моосу 3,5—4, плотность 2,925—2,98 г/см³. [1]
Видео:Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

Физические свойства
Чистый гидроксид железа (II) — кристаллическое вещество белого цвета (на фото — коричневый цвет). Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде (растворимость 5,8⋅10 −6 моль/л). При нагревании разлагается. Имеет тригональную сингонию кристаллической решётки.
Видео:Соединения железаСкачать

Химические свойства
Гидроксид железа (II) вступает в следующие реакции.
Проявляет свойства основания — легко вступает в реакции нейтрализации с разбавленными кислотами, например с соляной (образуется раствор хлорида железа (II)):
В более жёстких условиях проявляет кислотные свойства, например с концентрированным (более 50 %) гидроксидом натрия при кипении в атмосфере азота образует осадок тетрагидроксоферрата (II) натрия:
Не реагирует с гидратом аммиака. При нагревании реагирует с концентрированными растворами солей аммония, например, хлорида аммония:
При нагревании разлагается с образованием оксида железа (II):
Fe(OH)2 → 150−200∘C FeO + H2O В этой реакции в качестве примесей образуются металлическое железо и оксид железа (III) — железа (II) (Fe3O4).
В виде суспензии, при кипячении в присутствии кислорода воздуха окисляется до метагидроксида железа. При нагревании с последним образует оксид железа (III)-железа (II):
4 Fe(OH)2 + O2 ⟶ 4FeO(OH) + 2H2O Fe(OH)2 + 2FeO(OH) → 600−1000∘C (Fe II Fe2 III )O4 + 2H2O Эти реакции также происходят (медленно) в процессе коррозии железа.
Видео:Химия. 10 класс. Получение гидроксидов: железа (II) и (III), меди (II) /19.02.2021/Скачать

Получение
Гидроксид железа (II) может быть получен в виде осадка в обменных реакциях растворов солей железа (II) со щёлочью, например:
Образование гидроксида железа (II) является одной из стадий ржавления железа:
2Fe + 2H2O + O2 ⟶ 2Fe(OH)2 Также гидроксид железа (II) может быть получен электролизом раствора солей щелочных металлов(например хлорида натрия) при перемешивании. Сначала образуется соль железа, которая при реакции с образовавшимся гидроксидом натрия даёт гидроксид железа. Чтобы получить двухвалентный гидроксид нужно вести электролиз при большой плотности тока. Реакция в общем виде: Fe + 2H2O ⟶ Fe(OH)2↓ + H2
Видео:Получение гидроксида железа (III) и взаимодействие его с кислотамиСкачать

Применение
Гидроксид железа (II) находит применение при изготовлении активной массы железо-никелевых аккумуляторов.
Видео:Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать

Опыт № 3 Получение и свойства гидроксида железа (II).
Свойства d-элементов ( 2 часть).
Теоретическая часть
Железо, кобальт, никель составляют «семейство» железа.
Проявляют степень окисления главным образом +2 и +3. Степень окисления +3 более характерна железа, +2 для кобальта и никеля.
Родственные черты этих металлов проявляются в свойственной им ферромагнитности, каталитической активности, способности к образованию окрашенных ионов, комплексообразовании. Однако при схожести свойств, железо по своим магнитным свойствам ярко выделяется в триаде. Восстановительная активность железа значительно больше, чем кобальта и никеля (смотри электродные потенциалы). Все эти металлы со щелочами не взаимодействуют. При растворении в неокисляющих кислотах образуют ионы Fe 2+ , Co 2+ , Ni 2+
В разбавленной азотной кислоте (сильном окислителе ) образуются ионы Fe 3+ , Co 3+ , Ni 3+
Сильная окислительная среда: H2SO4 (конц.), HNO3 (конц.) пассивирует железо и оно начинает реагировать лишь при нагревании:
В азотной кислоте, содержащей соли NaNO2 и NaNO3, железо пассивируется с образованием пленки оксида высшей степени окисления FeO3

Гидроксид железа (II) легко окисляется кислородом воздуха:
Окисление ионов Co 2+ происходит труднее и протекает медленно:
Более интенсивно идет процесс при добавлении в раствор пероксида водорода:
Самопроизвольного окисления Ni(OH)2 кислородом воздуха не происходит, H2O2 является также не достаточно сильным окислителем и процесс окисления Ni(OH)2 становится возможным лишь при использовании более сильного окислителя, например бромной воды:
Гидроксиды Fe (III), Co (II), Co (III), Ni (II), Ni (III) носят в обычных условиях основной характер. При растворении в кислотах Co(OH)3 и Ni(OH)3 проявляют сильные окислительные свойства и восстанавливаются до катионов Co 2+ и Ni 2+ .
Гидроксид железа (III) при кипячении с концентрированным раствором щелочи образует ферриты — соли железистой кислоты.
Таким образом гидроксид Fe(OH)3, проявляет амфотерные свойства.
Гидроксиды Fe (II), Fe (III), Co (II), Co (III), Ni (II) нерастворимы
Гидроксиды Fe (II), Fe (III), Co (II), Co (III), Ni (II) являются слабыми основаниями, поэтому их соли в водных растворах гидролизуются.
Эти процессы идут без нагревания.
Однако гидролиз солей не идет до конца вследствие накопления в растворе H + . При сильном разбавлении и нагревании гидролиз идет дальше:
При кипячении раствора FeCl3 процесс гидролиза можно провести необратимо:
При подкислении растворов солей соответствующими кислотами степень их гидролиза уменьшается, так как равновесие сдвигается в сторону исходных веществ.
При сильном разбавлении степень гидролиза увеличивается. При добавлении растворимых карбонатов — происходит необратимой гидролиз, так как продукты реакции уходят из сферы взаимодействия.
Соли Fe (II) на воздухе постепенно переходят в соли Fe (III).
В комплексных соединениях Fe, Co, Ni являются центральными ионами комплексообразователями с координационными числами 4 или 6.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт № 3 Получение и свойства гидроксида железа (II).
К раствору соли железа (II) подливаем раствор щелочи NaOH до образования осадка, затем осадок разделить на три части:
а) в первую пробирку добавляем избыток щелочи;
б) во вторую — кислоту;
в) осадок из третьей пробирки отфильтровать и дать ему постоять на воздухе.
В присутствии влаги и кислорода воздуха гидроксид железа (II) переходит в гидроксид железа (III).

1. 


2. 
3. 
Опыт № 4 Характерная реакция на ион Fe 2+ .
Наливаем в пробирку немного соли железа (II) и добавляем небольшое количество раствора красной кровяной соли K3[Fe(CN)6]. Эта реакция применяется для открытия ионов железа (II).
Вывод: Красная кровяная соль K3[Fe(CN)6] является реактивом на ион железа (II).
Опыт № 5 Получение и гидролиз карбоната железа (II).
К раствору соли железа (II) добавляем раствор карбоната натрия. Образовавшаяся белая углекислая соль железа (II) мгновенно подвергается гидролизу с образованием гидроксида железа (II).
1.
2. 
Вывод: соль, образованная слабой кислотой гидролизуется до конца, т.к. H2CO3 распадается на H2O и CO2 и Þ H2CO3 полностью удаляется из сферы реакции.
📹 Видео
Уравниваем реакцию окисления сульфата железа (II) в нейтральной средеСкачать

19. Химические свойства и способы получения соединений железа (II)Скачать

Как получить гидроксиды металла в 2 стадии?Скачать

Химические свойства двухвалентного железа #1 образование Fe(OH)2Скачать

Оксиды и гидроксиды железаСкачать

Образование нерастворимых гидроксидов железа, меди и цинкаСкачать

8 класс. Составление уравнений химических реакций.Скачать

9 и 11 классы. Железо. Часть 2.Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

9 класс.Химия.ОГЭ.Задание 24.Сульфат железа (II).Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать