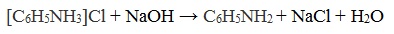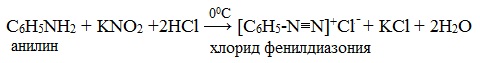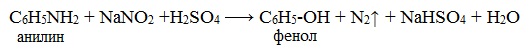Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
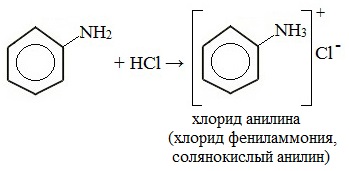
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
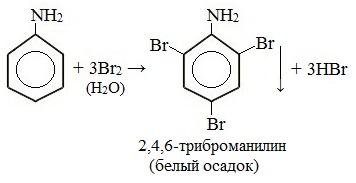
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
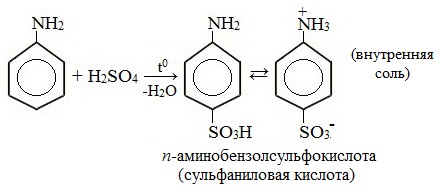
2. Сульфирование
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Видео:088 Окисление анилина расвором дихромата калияСкачать

Опыты по химии. Амины
Бромирование анилина
Аминогруппа влияет на свойства бензольного кольца. Она делает его более реакционноактивным. К насыщенному водному раствору анилина прильем бромную воду. Раствор мутнеет. Выпадает белый осадок 2,4,6-триброманилина.
С6Н5NH2 + 3 Br2 = C6H2Br3 + 3HBr
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и бромом.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие анилина с соляной кислотой
Анилин – слабое основание. С сильными кислотами анилин способен образовывать соли. Приготовим смесь анилина с водой. Прибавим к смеси соляную кислоту. Происходит растворение анилина. В растворе образуется солянокислый анилин или хлорид фениламмония
С6Н5NH2 + HCI = [C6H5NH3] CI
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение среды раствора анилина
Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов. Возьмем пробу раствора анилина. Добавим в пробирку лакмус. Окраска индикатора не изменяется, это значит, что раствора анилина имеет нейтральную реакцию среды. Оборудование: пробирка, штатив для пробирок.
Оборудование: пробирка, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение физических свойств анилина
Анилин – бесцветная маслянистая жидкость. При хранении анилин постепенно окисляется и приобретает вначале желтую, затем бурую окраску. Изучим растворимость анилина в воде. Прибавим анилин к воде и перемешаем раствор. Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется всего 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественное определение азота в органических соединениях
Очень чувствительным методом определения азота в органических соединениях является сплавление вещества с металлическим натрием. Небольшую порцию анализируемого вещества сплавляем с кусочком металлического натрия. Важно, чтобы весь натрий прореагировал или окислился. Когда весь натрий прореагировал, охлаждаем пробирку, заливаем ее водой и кипятим. К полученному раствору добавляем крупинку сульфата железа (II) и вновь нагреваем. Затем добавляем соляную кислоту. Появление синего окрашивания свидетельствует о наличии азота в исследуемом органическом соединении. При сплавлении натрия с азотсодержащим веществом образуется цианид натрия. С солью двухвалентного железа цианид натрия образует гексацианоферрат (II) натрия. Так как сульфат железа (II) всегда содержит примесь железа (III), то с железом (III) гексацианоферрат натрия образует берлинскую лазурь. Появляется голубое окрашивание.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, стакан, фильтровальная бумага, скальпель, пинцет.
Техника безопасности. Соблюдать правила работы со щелочными металлами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление анилина раствором дихромата калия
Окисление анилина дихроматом калия позволяет получить важный промышленный краситель – черный анилин. К насыщенному раствору дихромата калия прибавим раствор серной кислоты и эмульсию анилина. Жидкость окрашивается в зеленый цвет, который постепенно переходит в черный. Образуется черный анилин — нерастворимый в воде краситель.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление анилина раствором хлорной извести
Определить наличие анилина в растворе можно с помощью раствора хлорной извести. К сильно разбавленному раствору анилина добавим отфильтрованный раствор хлорной извести. Раствор становится синим. Реакция с хлорной известью – качественная реакция на анилин, она основана на легкой окисляемости анилина. Реакция очень чувствительна и позволяет определить даже следы анилина.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение гидроксида диметиламмония и изучение его свойств
Амины с водой образуют достаточно сильные основания. Приготовим раствор диметиламина в воде. Газ диметиламин хорошо растворяется в воде. При этом образуется гидроксид диметиламмония (гидрат диметиламина)
(СН3)2NH + H2O = [(СН3)2NH2]ОН
Пробу гидроксида диметиламмония (гидрата диметиламина) испытаем раствором фенолфталеина. Фенолфталеин приобретает малиновую окраску: среда раствора – щелочная. К следующей порции раствора прибавим раствор хлорида железа (III) – выпадает бурый осадок гидроксида железа.
3[(СН3)2NH2]ОН + FeCI3 = Fe(OH)3 ↓+ 3[(СН3)2NH2]CI
Вносим палочку, смоченную концентрированной соляной кислотой, в выделяющийся газ диметиламин, образуется густой белый дым. Дым – кристаллы гидрохлорида диметиламина.
(СН3)2NH + HCI = [(СН3)2NH2] CI
Оборудование: пробирки, штатив для пробирок, горелка.
Техника безопасности. Соблюдать правила работы со щелочами, кислотами. Правила работы нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение диметиламина и его горение
Получим диметиламин действием гидроксида натрия на хлорид диметиламина. Смешаем в пробирке хлорид диметиламина со щелочью и прибавим воды. При легком нагревании выделяется газ диметиламин.
[(СН3)2NH2] CI + NaOH = (СН3)2NH + NaCI + H2O
При поджигании диметиламин сгорает с образованием углекислого газа, водяных паров и азота.
4(СН3)2NH +15 O2 = 8CO2 + 14H2O + 2N2
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, газоотводная трубка.
Техника безопасности. Соблюдать правила работы со щелочами и нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Видео:Окисление анилина раствором дихромата калияСкачать

Уравнение окисление анилина дихроматом калия

Окисление анилина дихроматом калия позволяет получить важный промышленный краситель – черный анилин. К насыщенному раствору дихромата калия прибавим раствор серной кислоты и эмульсию анилина. Жидкость окрашивается в зеленый цвет, который постепенно переходит в черный. Образуется черный анилин — нерастворимый в воде краситель.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
🎦 Видео
Окисление анилина раствором дихромата калияСкачать

Окисление органических соединений перманганатом калияСкачать

Окисление этанола дихроматом калияСкачать

088 Окисление анилина расвором дихромата калияСкачать

234 Окисление анилина раствором дихромата калияСкачать

Окисление анилина расвором дихромата калияСкачать

Опыты по химии. Окислительные свойства дихромата калияСкачать

Реакция сойденения дихромата калия(K2Cr2O7) и гидроксида натрия(NaOH)Скачать

Все ОВР с дихроматом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Цветные химические опыты с дихроматом калия.Скачать

Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

Из хромата калия K2CrO4 в дихромат калия K2Cr2O7 и обратно - цветные переходы соединений хромаСкачать

Надхромовая Кислота - H2CrO6. Реакция Дихромата Калия, Серной кислоты и Перекиси Водорода.Скачать

Реакция этилена с раствором перманганата калияСкачать

Окисление анилина раствором хлорной известиСкачать

Дихромат калия из пасты ГОИ / Боль и страдания для химикаСкачать

Окисление анилина раствором K2Cr2O7Скачать

Окисление этанола раствором перманганата калияСкачать