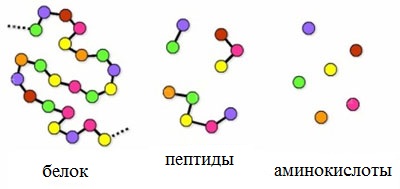
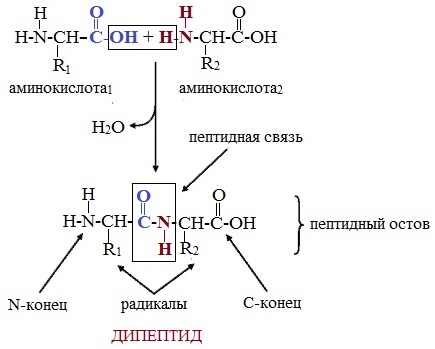
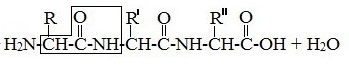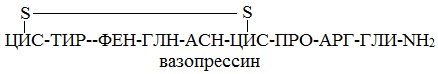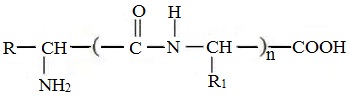Пептиды – семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями —С(О)NН- .
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот.
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.
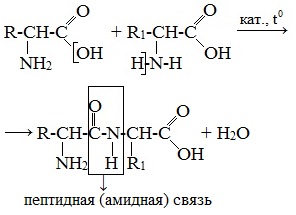
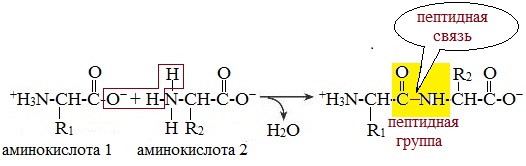
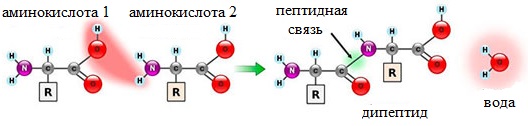
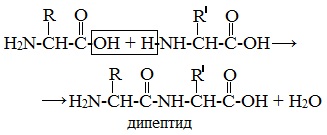
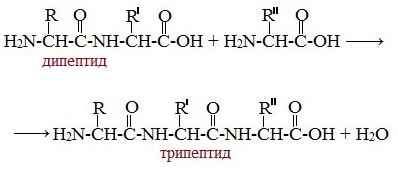
Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –СО-NH- .
Образование дипептидов
Две аминокислоты образуют дипептид:
Образование трипептидов
Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Полученное соединение называется трипептидом.
Процесс наращивания пептидной цепи может продолжаться неограниченно и приводит к веществам с очень высокой молекулярной массой (белкам).
Формулы пептидов обычно записываются так, что свободная аминогруппа находится слева, а свободная карбоксильная группа – справа. Основная часть пептидной цепи построена из повторяющихся участков –СН-СО-NН- и боковых групп R, R’ и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений.
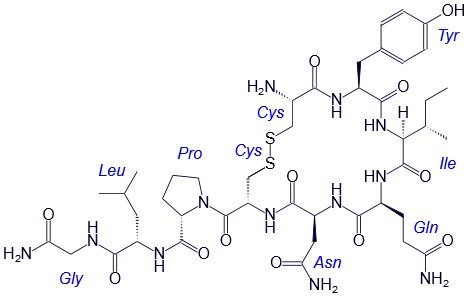
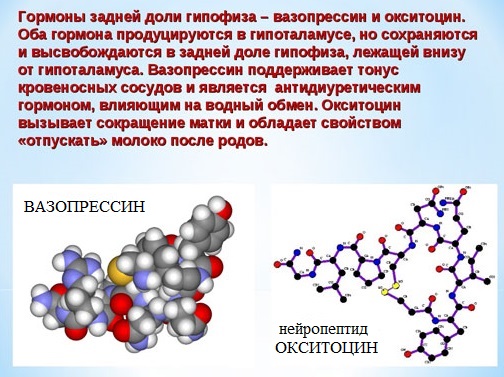
Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
Структурная формула вазопрессина
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
В этом пептиде остатки цистеина связаны дисульфидными мостиками. Правый конец цепи содержит амидную группу –СО-NН2 вместо карбоксильной.
Номенклатура
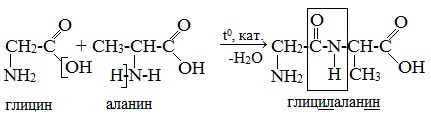
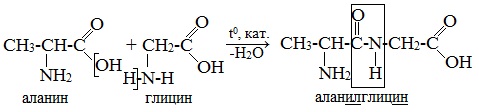
При составлении названия дипептида сначала называют аминокислоту, у которой в образовании дипептида участвует группа –СООН. В тривиальном названии этой кислоты последняя буква «н» заменяется буквой «л». Затем прибавляют без изменений тривиальное название аминокислоты, у которой в образовании дипептида участвует группа –NH2.
Любой дипептид имеет свободные амино- и карбоксильную группы и поэтому может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид. Таким же путем получают тетрапептиды и т.д.
Биологическое значение
Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты.
Некоторые пептиды (окситоцин, вазопрессин, инсулин) имеют огромное биологическое значение, являются важными гормонами.
Вазапрессин и окситоцин содержат 9 аминокислотных остатков.
Вазопрессин вырабатывается гипофизом и стимулирует сокращение кровеносных сосудов, повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
Инсулин – биологически важный пептид, который построен из двух цепей, состоящих из 21 и 30 α-аминокислотных остатков, которые связаны между собой дисульфидными мостиками. Вырабатывается поджелудочной железой и снижает содержание сахара в крови.
Химические свойства
Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь.
Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот.
Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенный участки пептидной цепи. Селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина.
Видео:СИГМА- ПИ- ДЕЛЬТА- СВЯЗЬСкачать

Эталонные решения задач
Гидролитическое расщепление L-аспарагина до L-аспарагиновой кислоты, при участии фермента аспарагиназы, используется в медицине при лечении лейкозов. Лейкозные клетки не могут синтезировать аспарагин и получают его из плазмы крови. Если аспарагин, содержащейся в плазме крови, разрушить реакцией гидролиза, происходит нарушение метаболизма в лейкозных клетках. Напишите реакцию гидролитического превращения L-аспарагина в L-аспарагиновую кислоту проекционными формулами Фишера.
Смесь глицина, аланина, лизина, аргинина, серина и глутаминовой кислоты разделяли методом электрофореза при рН = 6.
Определите направление движения аминокислот при электрофорезе, если изоэлектрические точки этих аминокислот соответственно равны значениям pH: 6,0; 6,0; 9,8; 10,8; 5,7 и 3,2.
В изоэлектрической точке (pI рН) суммарный заряд б-аминокислоты равен нулю. В данных условиях такое соотношение выполняется для аланина, глицина и серина и эти аминокислоты в электрическом поле перемещаться не будут.
При рН > pI преобладает анионная форма и аминокислота (в данном случае глутаминовая кислота) будет перемещаться к аноду.
В случае, когда рН + .
У лизина И.Э.Т. будет находиться в более щелочной среде, чем у глицина, так как для предотвращения образования второй NH3 + группы требуется дополнительное количество ионов OH.
Написать уравнения реакций аланина:
- а) с водным раствором щелочи;
- б) с водным раствором соляной кислоты;
- в) с бензоилхлоридом в щелочной среде.
Написать уравнения реакций лейцина:
- а) с уксусным ангидридом;
- б) с нитритом натрия в среде соляной кислоты;
- в) с этиловым спиртом в среде серной кислоты;
- г) с карбобензоксихлоридом.
В сильнощелочном растворе аминокислота существует в виде аниона и содержит две основные группы: NH2 и СОО. Учитывая тот факт, что константы основности для NH2-группы и карбоксилат-аниона R СОО соответственно равны 6,3•10 5 и 2,5•10 12 , определите, какая из этих групп будет более основной и к какой группе будет предпочтительно присоединяться протон при прибавлении к раствору кислоты. Какое соединение при этом образуется?
Из приведенных констант основности следует, что аминогруппа является более сильным основанием, чем карбоксильный ион (6,3•10 5 > 2,5•10 12 ), поэтому при добавлении кислоты протон будет присоединяться к аминогруппе, образуя биполярный ион:
В сильнокислом растворе аминокислота существует в виде катиона и содержит две кислотые группы: NH3 + и СООН. Учитывая, что константы кислотности для NH3 + и СООН групп соответственно равны 1,6•10 10 и 4•10 3 , определите, какая из этих групп будет более кислой и какая из них будет легче отдавать протон при прибавлении к исходному раствору щелочи. Какое соединение при этом образуется?
Из приведенных констант кислотности следует, что карбоксильная группа является более сильной кислотой, чем NH3 + ион, так как Kа( NH3 + ) = 1,6•10 10 3 , поэтому при добавлении щелочи карбоксильная группа будет отдавать протон, образуя биполярный ион:
При взаимодействии первичной аминогруппы с азотистой кислотой выделяется азот, по объёму которого по методу Ван-Слайка определяют число аминогрупп в кислоте.
При обработке равных количеств (по 0,001 моль) трех различных аминокислот получили (при н.у.):
- а) в первом случае 22,4 мл азота;
- б) во втором случае 44,8 мл азота;
- в) в третьем случае азот не выделялся вообще.
Какие возможные аминокислоты были взяты для этих экспериментов?
Рассчитаем количество азота, выделившихся в первом и втором опытах:
Таким образом, из 0,001 моль аминокислоты выделилось 0,001 моль азота. Следовательно, это может быть любая моноамино-карбоновая кислота (одно- или двухосновная).
В этом опыте количество выделившегося азота вдвое больше количества исходной кислоты. Следовательно, аминокислота содержит две аминогруппы (это может быть, в частности, лизин или орнитин).
в) В этом опыте азот не выделился вообще, следовательно, аминокислота не содержала свободной первичной аминогруппы. Например, это может быть иминокислота пролин.
Напишите все возможные стереоизомеры треонина в проекциях Фишера. Укажите конфигурацию каждого асимметрического центра. Какие структуры являются энантиомерами, а какие диастереомерами? Есть ли среди приведенных структур мезоформа?
Молекула треонина содержит два асимметрических центра:
следовательно, число оптических изомеров равно 2 n = 2 2 = 4.
I и II, III и IV энантиомеры;
I и III, I и IV, II и III, II и IV диастереомеры.
Среди приведенных структур мезоформы нет, так как каждый стереоизомер имеет свой энантиомер.
Укажите, какие исходные вещества надо взять для синтеза фенилаланина методом прямого аммонолиза и методом циангидринного синтеза. Напишите уравнения всех реакций.
Для синтезов необходимо иметь фенилэтаналь, 2-хлор-3-фенил-пропановую кислоту, аммиак и синильную кислоту.
б) циангидринный синтез:
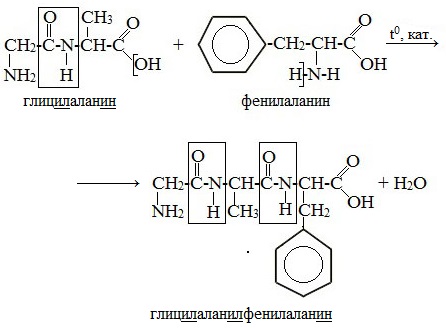
Фрагментом гормона окситоцина является трипептид цис-тир-иле. Напишите строение этого пептида, выделите пептидные связи и дайте полное название данного пептида.
Проведите синтез дипептида с аминокислотной последовательностью цистир, с предварительной защитой аминогруппы и активацией карбоксильной группы. Укажите все стадии процесса и назовите этот дипептид.
Аминогруппа тирозина будет участвовать в образовании пептидной связи, а аминогруппа цистеина должна быть свободной, поэтому надо проводить «защиту» аминогруппы цистеина карбобензоксихлоридом:
Для того чтобы провести реакцию с тирозином, надо «активировать» карбоксильную группу цистеина:
Тирозин следует «защитить» со стороны карбоксильной группы. Для этого проводят реакцию этерификации:
Полученный сложный эфир тирозина вступает в реакцию нуклеофильного замещения с карбобензоксихлоридом цистеина, защищенного по аминогруппе.
Последняя стадия процесса снятие «защиты» аминогруппы гидрогенолизом и гидролиз сложноэфирной группы в щелочной среде:
Напишите формулу трипептида гис-лиз-три. Дайте полное название этого трипептида, укажите пептидные связи, N- и С-концевые аминокислоты. Определите, в какой области рН находится изоэлектрическая точка данного пептида.
Изоэлектрическая точка этого пептида находится в щелочной среде, так как в данном пептиде число основных групп преобладает над числом карбоксильных групп.
Напишите тетрапептид со следующей последовательностью аминокислот: лизин-аланин-валин-глутаминовая кислота. Отметьте незаменимые аминокислоты, нейтральные и кислые. Выделите пептидную связь и объясните, почему она имеет плоское строение и вокруг каких связей возможно свободное вращение.
Незаменимые кислоты лизин и валин. Кислая кислота глутаминовая, нейтральные валин и аланин.
Плоское строение пептидной связи обусловлено sp 2 -гибридизацией атома углерода карбонильной группы. Сопряжение неподеленной пары электронов атома азота с двойной связью С = О (р-р сопряжение) приводит к частичной двоесвязанности связи С N, что и объясняет плоское строение всей группы СО NH.
Свободное вращение возможно вокруг одинарной связи азота с б-углеродным атомом и вокруг связи б-углеродного атома с атомом углерода карбонильной группы.
В пептидном гидролизате обнаружено четыре аминокислоты в молярном соотношении: гли:ала:фен:сер = 2:1:1:3. Молярная масса этого пептида равна 1438 г/моль. Определите аминокислотный состав данного пептида.
Рассчитаем суммарную массу двух моль глицина, одного моль аланина, одного моль фенилаланина и 3 моль серина:
m=2M(глицина) + 1M(аланина) + 1M(фенилаланина) + 2M(серина)
m = 275 + 89 + 165 + 1053 = 719 г.
Измеренная молярная масса пептида составляет 1438 г/моль, следовательно, число всех аминокислот в пептиде должно быть в два раза больше и тогда состав пептида будет следующим: 4 молекулы глицина, 2 молекулы аланина, 2 молекулы фенилаланина и 6 молекул серина.
В данном случае можно лишь установить количественный состав пептида, но нет возможности установить, в каком порядке эти аминокислоты связаны в пептид.
Как известно, атом галогена прочно привязан к бензольному кольцу, и поэтому ароматические галогениды не склонны реагировать с нуклеофилами. Объясните, почему 2,4-динитро-фторбензол легко реагирует со свободной аминогруппой N-концевой аминокислоты пептида и не реагирует с атомом азота пептидной группы NН С = О, хотя атом азота этой амидной группы тоже содержит неподеленную пару электронов.
Наличие сильно электроноакцепторных нитрогрупп в орто- и параположениях бензольного кольца и атома фтора, имеющего наибольшую электроотрицательность из всех известных элементов, резко уменьшают электронную плотность у атома углерода бензольного кольца, связанного со фтором, делая тем самым молекулу более восприимчивой к атаке нуклеофилом. В качестве нуклеофила выступает атом азота аминогруппы, содержащий неподеленную пару электронов.
Атом азота амидной группы в этой реакции в роли нуклеофила не может конкурировать со свободной аминогруппой, так как в результате сопряжения неподеленной пары электронов атома азота с двойной связью карбонильной группы, амиды становятся значительно более слабыми нуклеофилами, чем амины.
сопряжение пары электронов азота с двойной связью С = О
Напишите формулу тетрапептид фен-цис-три-глу. С помощью каких цветных реакций можно доказать наличие в этом пептиде бензольного кольца, пептидной связи, серусодержащей аминокислоты и триптофана?
Ароматическое кольцо в пептиде можно обнаружить реакцией с концентрированной азотной кислотой (ксантопротеиновая реакция).
Для качественного и количественного определения триптофана можно использовать реакцию Эрлиха в среде серной кислоты появляется красно-фиолетовое окрашивание.
Наличие пептидной связи доказывается с помощью биуретовой реакции.
Для обнаружения цистеина используют реакцию с ацетатом свинца в щелочной среде.
Укажите направления движения (движутся к катоду или к аноду, не перемещаются в электрическом поле) в процессе электрофореза при рН = 1,9; 3; 6,5 и 13 следующих пептидов:
Изоэлектрическая точка этого пептида находится в щелочной среде, так как число аминогрупп превышает число карбоксильных групп.
В сильнокислой среде при рН = 1,9 и при рН = 3 за счет протони-рования аминогрупп образуются катионы R NH3 + и пептид будет перемещаться к катоду. При рН = 6,5 (среда почти нейтральная) пептид будет перемещаться к катоду, так как его изоэлектрическая точка находится в щелочной среде. В сильнощелочной среде при рН = 13 образуется карбоксилат-ион и пептид будет перемещаться к аноду.
Изоэлектрическая точка этого пептида находится в среде близкой к нейтральной, так как число аминогрупп этого пептида равно числу карбоксильных групп. Поэтому в сильнокислой среде (при рН = 1,9 и рН = 3) диссоциация карбоксильных групп подавлена, а аминогруппы будут протонированы и пептид будет перемещаться к катоду. При рН = 6,5 (среда близкая к нейтральной) пептид в электрическом поле перемещаться не будет, так как он практически находится в изоэлектрическом состоянии. В сильнощелочной среде (при рН = 13) будут преобладать анионы (карбоксилат-ионы), и пептид начнет перемещаться к аноду.
Видео:Образование пептидов. Запись структурной формулы пептидаСкачать

Please wait.
Видео:2.1. Метод характеристик. Задача Коши для гиперболического уравнения на плоскости.Скачать

We are checking your browser. gomolog.ru
Видео:Определения кислоты и основания (видео 1) | Органические кислоты и основания | ХимияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:97. Глюкоза (структурные формулы)Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 70166c612b0b0b37 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
🔥 Видео
Химия 10 класс (Урок№3 - Непредельные углеводороды – алкены.)Скачать

Уравнение Харди-ВайнбергаСкачать

Закон Харди — Вайнберга | НОВАЯ тема ЕГЭ по Биологии | Популяционная генетикаСкачать

АллергияСкачать

12. Популяционная генетика. Решение генетических задач 9 - 11 классСкачать

Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

Структуры Льюиса и формальный зарядСкачать

СОСТАВНЫЕ УРАВНЕНИЯ / Математика 3 ,4 класс Петерсон , Моро . Как научить решать составные уравненияСкачать

16. Углеводы. Определение, классификация, формулы Фишера, D и L изомерыСкачать

№9. Элементы вариационного исчисления. Уравнения Лагранжа-Эйлера.Скачать

Родословная (видео 9) | Классическая генетикаСкачать
1. Уравнение плоскости проходящей через точку перпендикулярно вектору / общее уравнение / примерыСкачать

Теория отталкивания электронных пар валентной оболочки (видео 10) | Химические связиСкачать

Как изобразить точечные структуры Льюиса (видео 7) | Химические связи и структура молекулСкачать

Колыбасова В.В. - Методы математической физики.Семинары - 15. Решение краевых задач. Функция ГринаСкачать