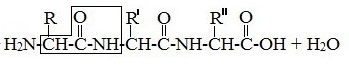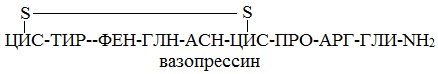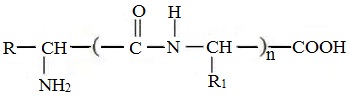Разделы: Химия
Цели урока:
- дать понятие об аминокислотах как органических амфотерных соединениях;
- дать определение реакции поликонденсации;
- ввести понятие пептидной связи. Ознакомить учащихся с природными полимерами – белками; дать характеристику белкам как важнейшим составным частям пищи.
Оборудование: компьютер, проектор, спиртовка, образцы белков, пробирки, реактивы.
План работы. Ход урока.
I. Оргмомент, проверка домашнего задания, повторение:
1. работа у доски:
а. структура пентана, число связей C- H
б. классификация жиров, примеры
в. муравьиная и уксусная кислоты
2.работа на местах:
I вариант – А1 – А7 (№11)
II вариант – А1 – А7(№12)
с самопроверкой работы
Работу начинаем со слайда №1 – рассматриваем структуру аминокислоты: наличие двух функциональных групп – основной и кислотной.
Значит это вещество амфотерное.
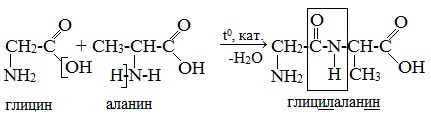
На примере уксусной кислоты показываем образование аминоуксусной кислоты – глицина. Эта кислота была выделена самой первой и названа гликокол, что означает сладкая.
Учитель демонстрирует упаковку глицина, как пример лекарственного вещества.
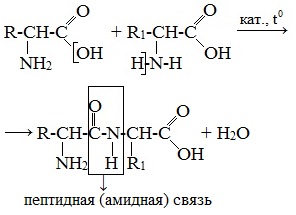
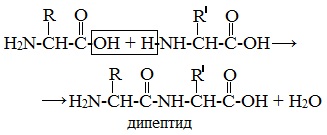
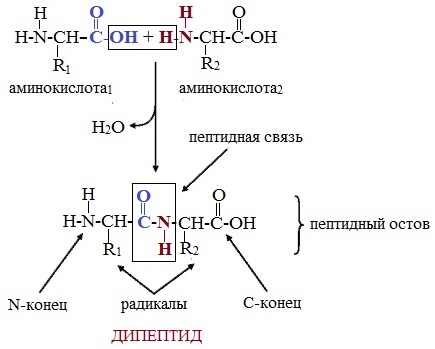
На следующем слайде разбираем пример образования пептидной связи, в результате реакции поликонденсации, между двумя аминокислотами.
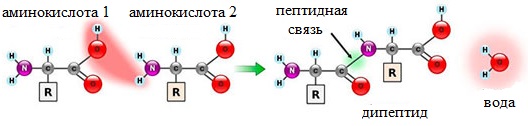
Затем на доске записываем уравнение образования дипептида аминоуксусной кислоты: аминоуксусная кислота + аминоуксусная кислота образуется дипептид + вода.
Это реакция поликонденсации.
III. Белки, их структура и свойства.
Рассмотренная реакция имеет важнейшее значение для производных из аминокислот – белков.
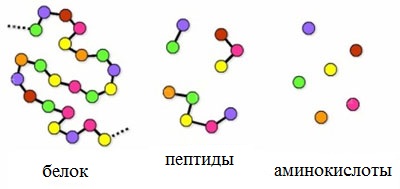
Принято говорить, что аминокислоты это кирпичики, из которых построены молекулы белка. Чтобы подчеркнуть масштабы, принято говорить макромолекула, т. е. большая. Белки являются природными полимерами. Всего сейчас известно около 150 аминокислот, но только 20 из них входят в состав белков. Половина из них относится к незаменимым, они должны поступать в организм вместе с пищей. А это значит, что ежедневно человек должен получать не менее 80-100 г белка. Какие это продукты? Молоко, мясо, яйца, рыба… В первой половине 19 века выяснилось, что белки составляют неотъемлемую часть всех без исключения живых веществ Земли. Существовало такое определение “Жизнь – это способ существования белковых тел”.
Для белков характерно образование трех видов структур: первичной, вторичной и третичной. Рассмотрим это на таблице. Цветными магнитами показать места образования пептидной связи в первичной структуре белка, состоящей из аминокислот.
Теперь перейдем к рассмотрению характерных для белков свойств:
1. Ставим перед учащимися проблемный вопрос: откуда в организме аминокислоты? Из пищи…
В основе пищеварения находится свойство белков гидролизоваться.
2.Белки – горят. Демонстрация горения пера. При этом надо сразу отметить практическое значение этой реакции как метода определения наличия белка.
3.Денатурация белка – разрушение природной структуры макромолекул.
Задание учащимся – провести исследование с выданными образцами белков, с целью изучения этого свойства. Карточка с алгоритмом действий.
Работаем со стеклянной посудой и растворами веществ. Соблюдаем правила техники безопасности. Работаем аккуратно.
1.Перед вами два образца растворимых в воде белков: №1-молоко; №2-белок яйца. Рассмотрите их.
2.К молоку, пробирка №1, добавьте раствор лимонной кислоты – пробирка №3. Осторожно встряхните. Что наблюдаете?
3.В пробирку №2, где находится белок куриного яйца, прилейте этиловый спирт – пробирка №4. Осторожно встряхните. Что произошло?
4.Сделайте общий вывод о действии веществ – спирта и кислоты – на белки.
Какое практическое значение это имеет для здоровья человека?
5.Выполните соответствующие записи в тетради.
Пока идет работа на местах учитель готовит ещё две демонстрации:
а. нагревание белка куриного яйца
б. действие солей тяжелых металлов на белки: к раствору белка куриного яйца добавляем раствор ацетата свинца.
Объединяя результаты, делаем общий вывод о факторах влияющих на денатурацию белков.
4.Цветные реакции на белок:
б. биуретовая – универсальная реакция
Эти демонстрации проводит учитель.
Дать учащимся отдохнуть и переключить внимание:
— как отличить сваренное яйцо от сырого? Надо покатать яйцо по столу: вареное будет долго вращаться, а сырое – нет. Практический совет – если хотите, чтобы яйцо при варке не лопнуло, в тупом его конце проколите иголкой маленькое отверстие.
— как проверить, что изделие из шерсти? Шерсть – это белок, надо сжечь кусочек нити и по запаху определить результат.
На закрепление темы урока проводим небольшое тестирование.
1.Аминокислоты амфотерные вещества, т.к. :
а. они вступают в реакцию только с кислотами;
б. они вступают в реакцию только с щелочами;
в.они содержат в своем составе основную и кислотную функциональную группу.
2.Для образования пептидной связи в реакцию вступают:
а. две аминокислоты;
в. два основания.
3.Первичной структурой белка называют:
а. цепочку веществ;
б.цепочку из аминокислот;
в.участок белковой молекулы.
4.Любой белок можно определить:
5.Шерстяную вещь можно отличить от синтетической:
а. по отношению к воде;
б. по реакции горения нити от изделия;
в. по реакции с кислотами.
Подводим итог урока. Делаем вывод о главенствующей роли белков, образованных аминокислотами, для жизни человека; о роли правильного питания для здоровья.
Приложение к уроку. Слайды по теме: “Аминокислоты”.
- Уравнение образования дипептида аминоуксусной кислоты
- Образование дипептидов
- Образование трипептидов
- Номенклатура
- Биологическое значение
- Химические свойства
- Напишите уравнения реакций образования трипептидов: а) из аминоуксусной кислоты; б) из аминоуксусной кислоты, аланина и цистеина.
- Ваш ответ
- Похожие вопросы
- 📽️ Видео
Видео:Образование пептидов. Запись структурной формулы пептидаСкачать

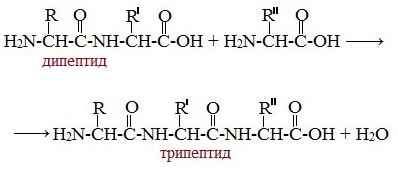
Уравнение образования дипептида аминоуксусной кислоты
Пептиды – семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями —С(О)NН- .
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот.
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.
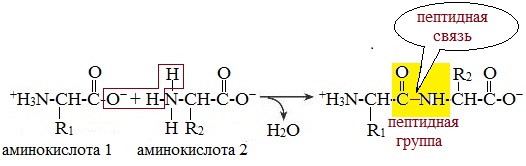
Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –СО-NH- .
Образование дипептидов
Две аминокислоты образуют дипептид:
Образование трипептидов
Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Полученное соединение называется трипептидом.
Процесс наращивания пептидной цепи может продолжаться неограниченно и приводит к веществам с очень высокой молекулярной массой (белкам).
Формулы пептидов обычно записываются так, что свободная аминогруппа находится слева, а свободная карбоксильная группа – справа. Основная часть пептидной цепи построена из повторяющихся участков –СН-СО-NН- и боковых групп R, R’ и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений.
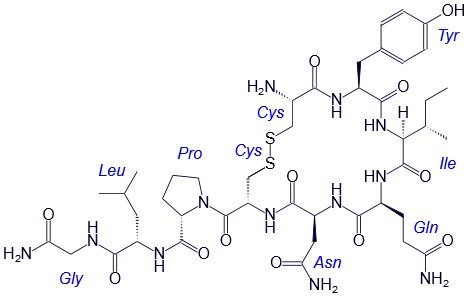
Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
Структурная формула вазопрессина
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
В этом пептиде остатки цистеина связаны дисульфидными мостиками. Правый конец цепи содержит амидную группу –СО-NН2 вместо карбоксильной.
Номенклатура
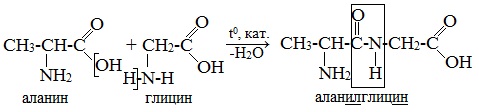
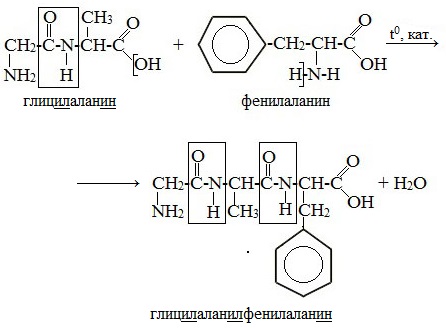
При составлении названия дипептида сначала называют аминокислоту, у которой в образовании дипептида участвует группа –СООН. В тривиальном названии этой кислоты последняя буква «н» заменяется буквой «л». Затем прибавляют без изменений тривиальное название аминокислоты, у которой в образовании дипептида участвует группа –NH2.
Любой дипептид имеет свободные амино- и карбоксильную группы и поэтому может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид. Таким же путем получают тетрапептиды и т.д.
Биологическое значение
Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты.
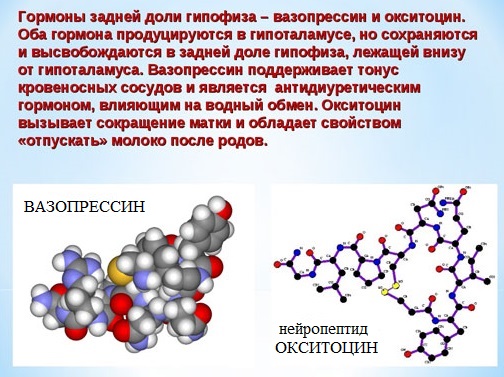
Некоторые пептиды (окситоцин, вазопрессин, инсулин) имеют огромное биологическое значение, являются важными гормонами.
Вазапрессин и окситоцин содержат 9 аминокислотных остатков.
Вазопрессин вырабатывается гипофизом и стимулирует сокращение кровеносных сосудов, повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
Инсулин – биологически важный пептид, который построен из двух цепей, состоящих из 21 и 30 α-аминокислотных остатков, которые связаны между собой дисульфидными мостиками. Вырабатывается поджелудочной железой и снижает содержание сахара в крови.
Химические свойства
Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь.
Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот.
Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенный участки пептидной цепи. Селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина.
Видео:Биохимия. Определение заряда аминокислот и пептидов в различных средах.Скачать

Напишите уравнения реакций образования трипептидов: а) из аминоуксусной кислоты; б) из аминоуксусной кислоты, аланина и цистеина.
Видео:Пептидная связь. Образование пептидной связи. Запись структурной формулы пептида.Скачать

Ваш ответ
Видео:Опыты по химии. Аминокислоты: агрегатное состояние; отношение к воде; отношение к индикаторуСкачать

Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
📽️ Видео
Аминокислоты. 10-11 класс. Подготовка к ЕГЭ по химииСкачать

АминокислотыСкачать

Дипептиды, аминокислоты и сложные эфиры в 35 задаче. Часть 1Скачать

Химия 10 класс (Урок№12 - Аминокислоты. Белки.)Скачать

Азотсодержащие органические соединения. Тема 38. АминокислотыСкачать

Видеоурок. АминокислотыСкачать

ВСЯ ХИМИЯ 11 КЛАСС ЕНТ Аминокислоты / Олеум / Смеси WannaBeTeacher Усенов УланСкачать

Двойные агенты в химии: аминокислотыСкачать

Образование мочевины, аммиака. Метаболизм азотсодержащих соединений. ЕГЭ по БИОЛОГИИ | Глеб МендельСкачать

493 Органическая химия Азотсодержащие орнанические соединение Аминокислоты Задача №3Скачать

Химия 9 класс (Урок№32 - Углеводы. Аминокислоты. Белки.)Скачать

Орнитиновый цикл БИОХИМИЯ: цикл мочевины, обезвреживание аммиакаСкачать
Аминокислоты и белки | ЕГЭ по химии 2023Скачать

Разбор варианта №1 от Широкопояса, БорисоваСкачать

СОСТАВИТЕЛИ ЕГЭ ПО ХИМИИ ОТВЕЧАЮТ НА ВОПРОСЫСкачать

Задачи по химии. Аминокислоты. A37 РТ1 15 16 вариант 2Скачать