4.2. ОСНОВНЫЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПОТЕНЦИАЛ
Рассчитанный по уравнению Нернста равновесный потенциал зависит прежде всего от соотношения концентраций окисленной и восстановленной форм рассматриваемой полуреакции: увеличение концентрации окисленной формы, также как уменьшение концентрации восстановленной формы, приводит к возрастанию потенциала. Однако эти изменения потенциала сравнительно невелики. Например для n =1 увеличение концентрации окисленной формы в 1000 раз приводит к изменению потенциала на (0,059/ n ) lg 1000 ≈ 0,188В.
Во многих окислительно-восстановительных реакциях участвуют ионы водорода (гидроксония)
Cr 2 O 7 2- +14 H + + 6 e — = 2 Cr 3+ + 7 H 2 O .
Для полуреакции в общем виде имеем:
В соответствии с уравнением Нернста потенциал выражается следующим образом:
Отсюда видно, что изменение концентрации ионов водорода в процессе химического взаимодействия вносит существенный вклад в изменение потенциала окислительно-восстановительной системы.
В тех случаях, когда в окислительной или восстановительной полуреакции ионы водорода не принимают непосредственного участия, они могут влиять на состояние ионов окисленной и восстановленной форм в растворе, тем самым изменяя потенциал.
Значение рН среды иногда определяет возможность осуществления окислительно-восстановительной реакции и использование ее в аналитической химии. Например, в зависимости от кислотности раствора реальный потенциал восстановления перманганата принимает следующие значения: рН =0, Е=1,51 В; рН=3, Е=1,23 В; рН=6, Е=0,93 В. Учитывая это, можно использовать перманганат калия для дифференцированного окисления следующих окислительно-восстановительных систем: Е ° С l 2/2 Cl — = 1,36 В; Е ° Br 2/2 Br — = 1,09 В ; Е ° I 2/2 I — =0,54 В. При рН =6 окисляется только I — , при рН=3 – I — и Br — , тогда как при рН=0 окислить можно все три иона.
На значение потенциала существенное влияние оказывают любые побочные химические процессы, в которых участвуют окисленная и восстановленная формы. Часто такими процессами являются реакции комплексообразования, при которых возможно существование в растворе ряда комплексных соединений. Обычно наиболее склонна к реакциям комплексообразования окисленная форма, в результате чего потенциал системы и окислительные свойства уменьшаются. Эту зависимость потенциала от концентрации комплесообразующего реагента широко используют в аналитической практике для регулирования окислительно-восстановительных свойств различных систем. Например, при титровании раствора, содержащего ионы Fe 2+ , раствором бихромата калия в присутствии дифениламина комплексообразование используется для снижения индикаторной ошибки.
Изменение стандартного (реального) потенциала вследствие реакции комплексообразования используют для стабилизации в растворе ионов металлов. Например, некоторые неорганические лиганды стабилизируют ионы Fe 3+ , а органические лиганды – ионы Fe 2+ .
Как следует из уравнения Нернста, потенциал системы зависит от температуры (предлогарифмический множитель). Наиболее существенно влияние температуры на потенциал окислительно-восстановительных систем, включающих гетерогенную фазу. Кроме того, значительное влияние температура оказывает на скорость окислительно-восстановительных реакций.
- Окислительно — восстановительный потенциал
- Электродные потенциалы. ЭДС реакции
- Элемент Даниэля-Якоби
- Окислительно-восстановительный потенциал
- Факторы, влияющие на значение окислительно-восстановительного потенциала
- Что можно определить по значению окислительно-восстановительного потенциала
- Как определить электродвижущую силу (ЭДС) реакции?
- Связь константы равновесия и окислительно — восстановительного потенциала
- Как составить схему гальванического элемента?
- Влияние различных факторов на протекание окислительно- восстановительных реакций
- 🎥 Видео
Видео:ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

Окислительно — восстановительный потенциал
Видео:Окислительно-восстановительный потенциалСкачать

Электродные потенциалы. ЭДС реакции
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Видео:Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
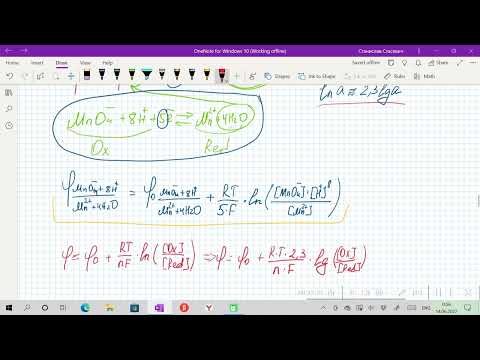
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
При Cок > Cвос, E > E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + .
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F — ) = +2,87 В – сильнейший окислитель
E°(K + /K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
практически протекает в прямом направлении, т.к.
E° (Sn 4+ /Sn 2+ ) = +0,15 В,
E° (Fe 3+ /Fe 2+ ) = +0,77 В,
т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ).
Cu + Fe 2+ = Cu 2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
- Mg + Fe 2+ = Mg 2+ + Fe
- Mg + 2H + = Mg 2+ + H2
- Mg + Cu 2+ = Mg 2+ + Cu
E° (Mg 2+ /Mg) = — 2,36 В
E° (Fe 2+ /Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е 0 ок — Е 0 восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu 2+ = Zn 2+ + Cu
Применяя закон действующих масс, можно записать
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим
В состоянии равновесия E 0 Zn/Zn2+ = E 0 Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E1 0 -E2 0 )n/0,059, где
K — константа равновесия
E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E1 0 > E2 0 , то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца.
Напротив, если E1 0 0 , то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Влияние различных факторов на протекание окислительно- восстановительных реакций
Окислительно-восстановительные потенциалы редокс-пар и, следовательно, потенциалы окислительно-восстановительных реакций зависят от природы реагентов и растворителя, концентраций реагентов, pH среды, температуры и присутствия других веществ в растворе. От тех же факторов зависит и направление протекания окислительновосстановительной реакции.
Рассмотрим конкретно зависимость потенциалов от указанных факторов.
Влияние концентрации реагентов — участников реакции.
Это влияние очевидно из рассмотрения уравнений Нернста (5.2)— (5.5), связывающих реальные потенциалы и концентрации реагентов и позволяющих рассчитать, как влияет изменение концентрации того или иного реагента — участника реакции на окислительно-восстановительные потенциалы редокс-пар или на потенциал самой реакции.
Влияние pH среды. Величина pH растворов непосредственно влияет на потенциалы и направление протекания окислительно-восстановительной реакции тогда, когда в реакции принимают участие ионы водорода, поскольку в этом случае как окислительно-восстановительные потенциалы редокс-пар, так и их разность (потенциал реакции) зависят от концентрации ионов водорода. Так, например, в реакции
ионы водорода участия не принимают; потенциал реакции не зависит от активности ионов водорода. Следовательно, pH среды не влияет на направление протекания данной реакции. Напротив, в окислительно-восстановительной реакции
непосредственно участвуют ионы водорода, поэтому потенциал этой реакции существенно зависит от pH среды. Варьируя pH среды таких реакций, можно изменять потенциалы и тем самым оказывать влияние на протекание окислительно-восстановительных процессов. Заметим, что иногда pH среды влияет на характер протекания окислительно-восстановительных процессов в растворе даже тогда, когда ионы водорода не участвуют непосредственно в рассматриваемой реакции. Это объясняется влиянием pH среды не на данную реакцию, а на протекание побочных процессов. Так, например, в цериметрии, в основе которой лежит полуреакция без участия ионов водорода, определение восстановителей ведут в сернокислой среде, поскольку именно в этой среде устойчив церий(IV) в форме сульфатных комплексов.
Влияние добавок посторонних (индифферентных) ионов. В уравнение Нернста для окислительно-восстановительных потенциалов и потенциала реакции входят значения активности ионов — участников реакции. Они зависят от коэффициентов активности ионов, а последние — от ионной силы раствора. Ионная сила раствора 1С определяется как Ic=Y2Lcizf, т. е. зависит от зарядов z< и концентраций с, всех ионов, присутствующих в растворе, как принимающих, так и не принимающих непосредственное участие в реакции. Следовательно, добавки посторонних (индифферентных) электролитов, обусловливая ионную силу раствора, влияют также и на активности ионов — участников реакции, а потому меняются и соответствующие потенциалы. В каждом конкретном случае с использованием уравнения Нернста можно рассчитать, как изменятся окислительно-восстановительные потенциалы редокс-пар или потенциал реакции.
Влияние температуры. Уравнение Нернста (5.4) показывает, что от температуры существенно зависит реальный потенциал редокс- пары, следовательно, и потенциал реакции.
Влияние давления. Если при протекании окислительно-восстановительной реакции не выделяются и не поглощаются газообразные вещества, то потенциал реакции практически не зависит от внешнего давления. Если же в окислительно-восстановительной реакции непосредственно участвуют газообразные вещества, то потенциал такой реакции может заметно зависеть от давления, поскольку в этом случае в уравнение Нернста для потенциала реакции включаются (вместо активностей) парциальные давления газообразных реагентов.
Влияние химических взаимодействий на потенциал. Протекание окислительно-восстановительных реакций часто сопровождается побочными взаимодействиями реагентов с окисленной или восстановленной формами, что приводит к созданию новых редокс-систем. Окисленная или восстановленная форма системы может связываться в комплексы или переходить в малорастворимые соединения. Связывание в комплекс или малорастворимое соединение окисленной формы редокс-пары понижает потенциал системы. Образование комплексов или малорастворимых соединений восстановленной формы повышает потенциал системы. В большинстве ОВ-реакций за одну элементарную стадию происходит перенос только одного электрона. При этом могут получиться промежуточные продукты с неустойчивой степенью окисления. Реакции, в которых передается более двух электронов, всегда мно- гостадийны.
Многостадийные реакции часто протекают медленно и необратимо. Уравнение Нернста, строго говоря, справедливо только для обратимых систем, поэтому важно знать, является ли полуреакция обратимой. Для выяснения обратимости полуреакций широко используют правила.
- 1. Все полуреакции, в которых передается более двух электронов, необратимы.
- 2. Полуреакции, сопровождающиеся глубокой структурной перестройкой реагирующих частиц, также необратимы.
Например, полуреакция МПО4 + 8Н + + 5е _ = Мп 2+ + 4Н20 необратима, а полуреакция |[Fe(CN)6] 3- +е
Для ускорения протекания ОВ-реакций используют различные приемы, один из них — введение катализаторов. Например, для ускорения окисления Мп(П) персульфат-ионом вводят ионы серебра.
🎥 Видео
Уравнение НернстаСкачать
Продукты в ОВР. Ч.2-2. Окислительно-восстановительный (редокс) потенциал в растворе.Скачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Окислительно-восстановительные равновесия в аналитической химии.Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

011 Электрохимия 4 уравнение НернстаСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Влияние подкисления и величины окислительно восстановительного потенциала на подвижность CsСкачать

Использование таблиц потенциалов и расчет ЭДС реакции. Продукты в ОВР. Ч.5-1.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решатьСкачать

Шеховцова Т.Н. - Аналитическая химия - Окислительно-восстановительные реакцииСкачать

Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

Химия 8 класс (Урок№33 - Окислительно-восстановительные реакции.)Скачать


