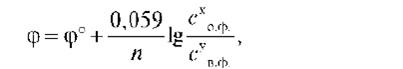Мерой окислительно-восстановительной способности веществ служат окислительно-восстановительные потенциалы. Рассмотрим механизм возникновения потенциала. При погружении химически активного металла (Zn, Al) в раствор его соли, например Zn в раствор ZnSO4, происходят дополнительное растворение металла в результате процесса окисления, образование пары, двойного электрического слоя на поверхности металла и возникновение потенциала пары Zn 2+ /Zn ° .
Металл, погруженный в раствор своей соли, например цинк в растворе сульфата цинка, называют электродом первого рода. Это двухфазный электрод, который заряжается отрицательно. Потенциал образуется в результате реакции окисления (рис. 5.1).
Рис. 5.1. Окисление цинка
При погружении в раствор своей соли малоактивных металлов (Cu) наблюдается противоположный процесс. На границе металла с раствором соли происходит осаждение металла в результате процесса восстановления иона, обладающего высокой акцепторной способностью к электрону, что обусловлено высоким зарядом ядра и малым радиусом иона. Электрод заряжается положительно, в приэлектродном пространстве избыточные анионы соли формируют второй слой, возникает электродный потенциал пары Cu 2+ /Cu ° . Потенциал образуется в результате процесса восстановления (рис. 5.2). Механизм, величина и знак электродного потенциала определяются строением атомов участников электродного процесса.
Рис. 5.2. Восстановление меди
Итак, потенциал, который возникает на границе раздела металла с раствором в результате окислительного и восстановительного процессов, протекающих с участием металла (электрода) и образованием двойного электрического слоя называют электродным потенциалом.
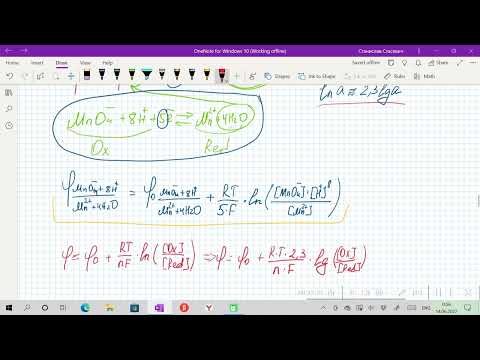
Если отводить электроны с цинковой пластины на медную, то равновесие на пластинках нарушается. Для этого соединим цинковую и медную пластины, погруженные в растворы их солей, металлическим проводником, приэлектродные растворы — электролитным мостиком (трубка с раствором K2SO4), чтобы замкнуть цепь. На цинковом электроде протекает полуреакция окисления: Zn 0 (т) — 2ē → Zn 2+ (р-р), а на медном — полуреакция восстановления: Cu 2+ (р-р) + 2ē → Cu 0 (т)
Электрический ток обусловлен суммарной окислительно-восстановительной реакцией:
Zn 0 (т) + Cu 2+ (р-р) → Zn 2+ (р-р) + Cu 0 (т)
Окислительно-восстановительные потенциалы пары зависят от природы участников электродного процесса и соотношения равновесных концентраций окисленной и восстановленной форм участников электродного процесса в растворе, температуры раствора и описываются уравнением Нернста.
Количественной характеристикой окислительно-восстановительной системы является редокс-потенциал, возникающий на границе раздела фаз платина — водный раствор. Величина потенциала в единицах СИ измеряется в вольтах (В) и рассчитывается по уравнению Нернста-Петерса:
где а(Oх) и a(Red) — активность окисленной и восстановленной форм соответственно; R — универсальная газовая постоянная; Т — термодинамическая температура, К; F — постоянная Фарадея (96500 Кл/моль); n — число электронов, принимающих участие в элементарном редокс-процессе; а — активность ионов гидроксония; m — стехиометрический коэффициент перед ионом водорода в полуреакции. Величина φ° — стандартный редокс-потенциал, т.е. потенциал, измеренный при условиях а(Oх) = a(Red) = a(H + ) = 1 и данной температуре.
Стандартный потенциал системы 2Н + /Н2 принят равным 0 В. Стандартные потенциалы являются справочными величинами, табулируются при температуре 298К. Сильнокислая среда не характерна для биологических систем, поэтому для характеристики процессов, протекающих в живых системах, чаще используют формальный потенциал, определяемый при условии а(Oх) = a(Red), pH 7,4 и температуре 310К (физиологический уровень). При записи потенциала пара указывается в виде дроби, причем окислитель записывается в числителе, а восстановитель в знаменателе.
Для 25°С (298К) после подстановки постоянных величин (R = 8,31 Дж/моль×град; F = 96500 Кл/моль) уравнение Нернста принимает следующий вид:
где φ°- стандартный окислительно-восстановительный потенциал пары, В; Со.ф. и Св.ф. — произведение равновесных концентраций окисленной и восстановленной форм соответственно; х и у — стехиометрические коэффициенты в уравнении полуреакций.
Редокс-системы делят на два типа:
1. в системе осуществляется только перенос электронов: Fe 3+ +ē = Fe 2+ , Sn 2+ — 2ē = Sn 4+ . Это изолированное окислительно-восстановительное равновесие;
2. системы, когда перенос электронов дополняется переносом протонов, т.е. наблюдается совмещенное равновесие разных типов: протолитическое (кислотно-основное) и окислительно-восстановительное с возможной конкуренцией двух частиц протонов и электронов. В биологических системах важные редокс-системы относятся к этому типу.
Примером системы второго типа является процесс утилизации перекиси водорода в организме: Н2О2 + 2Н + + 2ē ↔ 2Н2О, а также восстановление в кислой среде многих окислителей, содержащих кислород: CrО4 2- , Cr2О7 2- , MnО4 — . Например, MnО4 — + 8Н + + 5ē = = Mn 2+ + 4Н2О. В данной полуреакции участвуют электроны и протоны.
Итак, окислительно-восстановительный потенциал (ОВП) – это потенциал системы, в которой активности окислительной и восстановительной форм данного вещества равны единице. ОВП измеряется с помощью окислительно-восстановительных электродов в сочетании со стандартными электродами сравнения.
В каждой окислительно-восстановительной реакции есть своя редокс-пара – эта пара имеет вещество в окисленной и восстановленной форме (Fe +3 /Fe +2 ).
Количественной мерой активности редокс-пары является величина ее ОВП.
Видео:Уравнение НернстаСкачать
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Видео:Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Занятие №9. Электродные и редокс — потенциалы. уравнение нернста-петерса. редокс-системы в жизнедеятельности
ЗАНЯТИЕ № 9. ЭЛЕКТРОДНЫЕ И РЕДОКС — ПОТЕНЦИАЛЫ.
УРАВНЕНИЕ НЕРНСТА-ПЕТЕРСА. РЕДОКС-СИСТЕМЫ В ЖИЗНЕДЕЯТЕЛЬНОСТИ.
Необходимый базовый уровень:
1) окислительно-восстановительные реакции
2) окислитель и восстановитель
3) ЭДС окислительно-восстановительной реакции
Вопросы для подготовки к занятию:
1) Механизм возникновения электродного потенциала. Элемент Даниэля-Якоби. Уравнение Нернста.
2) Окислительно-восстановительная система: типы окислительно-восстановительных систем. Уравнение Нернста-Петерса.
3) Механизм возникновения редокс-потенциала. Факторы, влияющие на редокс-потенциалы: влияние лигандного окружения центрального атома на величину редокс-потенциала.
4) Водородный электрод: устройство, применение. Уравнение Нернста для водородного электрода.
5) Измерение ЭДС с помощью водородного электрода. Ряд напряжений металлов.
6) Ионселективные электроды: стеклянный электрод. Уравнение Нернста для стеклянного электрода.
7) Определение рН растворов с помощью водородного и стеклянного электродов.
8) ЭДС электрохимической реакции. Константа окислительно-восстановительного процесса.
Определение стандартного редокс-потенциала системы Fe3+/Fe2+ потенциометрическим методом.
НА ЗАНЯТИИ БУДЕТ ПРОВЕДЕН ВХОДНОЙ ТЕСТ-КОНТРОЛЬ!
Задачи и упражнения для самоподготовки
Вычислить потенциал серебряного электрода (Ag+/Ag0), погруженного в 0,01 М раствор AgNO3 при 250С, ?0(Ag+/Ag0) = +0,799 В. Ответ: 0,68 В. Потенциал цинкового электрода, помещенного в раствор собственной соли при Т = 298 К составил -0,819 В. Вычислить концентрацию ионов Zn2+, если ?0(Zn2+/ Zn0)=-0,76 В. Ответ: С(Zn2+)=0,01 моль/л. Рассчитать при 298 К редокс-потенциал системы Sn4+/Sn2+, содержащей смесь солей SnCl2 и SnCl4, если С(Sn2+) = 0,01 моль/л, С(Sn4+) = 0,05 моль/л. ?0(Sn4+/Sn2+) = 0,15 В. Ответ: 0,17 В. Рассчитать стандартный окислительно-восстановительный потенциал (?0(Fe3+/Fe2+) при 298 К, если ЭДС (Е) гальванического элемента, состоящего из этого редокс-электрода и насыщенного хлорсеребряного электрода, равняется +0,55 В, С(Fe2+) = 0,05 моль/л, С(Fe3+) = 0,02 моль/л, ?0(нас. хлорсер. эл.) = 0,201 В. Схема гальванической цепи:
Ag, AgCl (т) | KCl (нас.) || Fe2+, Fe3+ | Pt
При температуре 250С потенциал водородного электрода, погруженного в исследуемый раствор, ?(2Н+/Н2) = – 0,118 В. Вычислить рН этого раствора. Ответ: 2. Вычислите при 100С потенциал водородного электрода, погруженного в раствор NaOH с концентрацией 0,001 моль/л. Ответ: –0,623 В. Гальванический элемент составлен из хлорсеребряного и водородного электродов, погруженных в желудочный сок. При 370С ЭДС (Е) элемента равна 0,308 В, ?ХСЭ при этой же температуре равна 0,223В. Вычислить рН желудочного сока. Ответ: 1,38 В. Для измерения рН желчи из пузыря была составлена гальваническая цепь из водородного и хлорсеребряного электродов (?0(хлорсер. эл.) = 0,238 В). Измеренная при 250С ЭДС составила 0,577 В. Вычислите рН желчи. Ответ: 5,74. Концентрации MnO4– и Mn2+ равны между собой. Как изменится редокс-потенциал при окислении 20% ионов Mn2+ при постоянном рН и при 250С? (?0 = 1,59 В). Ответ: увеличится на 0,176 В.
Общая химия. Биофизическая химия. Химия биогенных элементов/, , ; Под ред. .- 3-е изд., стер.-М.: Высш. шк., 2002.-С.464-488. , . Общая химия.- М.: ГЭОТАР-Медиа, 2007-С.687-724. Руководство к практическим занятиям по общей химии: Методические разработки к выполнению лабораторных работ.-Ч. II / Сост. , , и др.-Ижевск, 2004.- С. 16-21.
💡 Видео
Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Электрохимический ряд потенциалов. 1 часть. 10 класс.Скачать

Гальванические элементы. 1 часть. 10 класс.Скачать

ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

011 Электрохимия 4 уравнение НернстаСкачать

Потенциал покоя и равновесный потенциалСкачать

Использование таблиц потенциалов и расчет ЭДС реакции. Продукты в ОВР. Ч.5-1.Скачать

Составление схемы и вычисление ЭДС гальванического концентрационного элемента | Уравнение НернстаСкачать

4 3 Электрохимический потенциалСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Электродные потенциалы металлов. Электроды сравненияСкачать

Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Основы теплотехники. Второй закон термодинамики. Энтропия. Теорема Нернста.Скачать

Гальванические элементыСкачать
Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

Закон диффузии ФикаСкачать