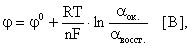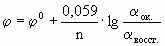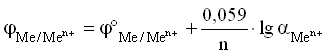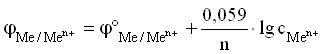При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Видео:Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Уравнение Нернста. Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях
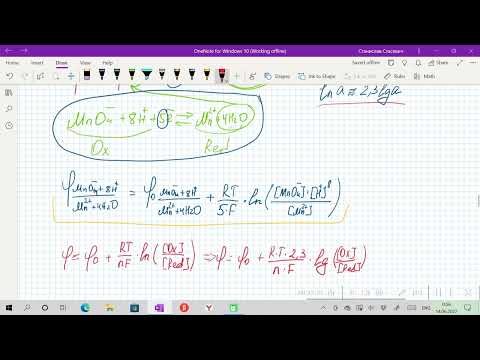
Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях, можно рассчитать по уравнению Нернста:
где: φ — электродный потенциал окислительно-восстановительного электрода, В;
φ 0 — стандартный электродный потенциал этого электрода, В, R — универсальная газовая постоянная, равная 8,314 Дж/моль· К, T – температура в K; n — число электронов в уравнении электродной реакции, F — число Фарадея, равное 96500 Кл/моль, aок., a восст. — активности окисленной формы восстановителя (Ме n+ ) и восстановленной формы окислителя (Ме) в электродной реакции. Подставив в уравнение Нернста T = 298 K, R, F и введя множитель 2,3 (переход к десятичным логарифмам), получим:
Уравнение Нернста для металлического электрода имеет вид:
Для разбавленных растворов, в которых активности мало отличаются от концентрации (a » С):
Величина j°Me n+ /Me 0 называется стандартным ЭП металлического электрода. Значение ЭП металлического электрода равно величине стандартного ЭП металлического электрода при концентрации ионов металла в растворе, равной 1 моль/л. Стандартный электродный потенциал – равновесная разность потенциалов гальванического элемента, составленного из стандартного водородного электрода (электрод сравнения) и электрода, потенциал которого определяется в стандартных условиях.
Дата добавления: 2015-07-30 ; просмотров: 2606 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Уравнение Нернста. Потенциометрические методы анализа
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС):
где E — электродвижущая сила (ЭДС);
E1 и E2 — потенциалы электродов исследуемой цепи.
Потенциал электрода E связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
где E0 — стандартный потенциал редокс-системы;
R — универсальная газовая постоянная, равная 8,312 Дж/(моль К);
T — абсолютная температура, К;
F — постоянная Фарадея, равная 96485 Кл/моль;
n — число электронов, принимающих участие в электродной реакции;
aox, ared — активности соответственно окисленной и восстановленной форм редокс-системы;
[ox], [red] — их молярные концентрации;
Гox, Гred — коэффициенты активности.
E=E0 при aox = ared = 1, причем имеется в виду гипотетический стандартный 1 М раствор, в котором коэффициент активности каждого растворенного вещества равен 1, а чистые вещества находятся в наиболее устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении.
Подставляя T=298,15 и числовые значения констант в уравнение, получаем для 25 °C
Однако потенциал отдельного электрода экспериментально определить невозможно. Относительные значения электродного потенциала находят, комбинируя данный электрод со стандартным водородным электродом, который является общепринятым международным стандартом. Потенциал водородного электрода принят равным нулю при всех температурах, поэтому потенциал данного электрода — это, в сущности, ЭДС элемента, состоящего из данного и стандартного водородного электрода.
Конструктивно стандартный водородный электрод представляет собой платинированную платиновую пластинку, омываемую газообразным водородом при давлении 1,013 . 10 5 Па (1 атм) и погруженную в раствор кислоты с активностью ионов H + , равной единице. При работе водородного электрода протекает реакция
В практической работе вместо хрупкого и нередко капризного водородного электрода применяют специальные, более удобные в работе стабильные электроды сравнения, потенциал которых по отношению к стандартному водородному электроду точно известен.
Уравнение (2) можно переписать
Величину E0‘ называют формальным потенциалом. Как видно, формальный потенциал характеризует систему, в которой концентрации (а не активности) всех участников равны 1,0 моль/л. Формальный потенциал включает в себя коэффициенты активности, т.е. зависит от ионной силы раствора. Если коэффициент активности равен 1, то E0‘=E0, т.е. формальный потенциал совпадает со стандартным. Точность такого приближения для многих расчетов оказывается достаточной.
Природа возникновения потенциала различна. Можно выделить следующие три основные классы потенциалов, которые не исчерпывают, конечно, всего многообразия. Это:
- Электродные потенциалы.
- Редокс-потенциалы.
- Мембранные потенциалы.
Хотя по термином «электродный потенциал» нередко имеют в виду любой потенциал, независимо от механизма его возникновения, в более узком понимании — это потенциал непосредственно связанный с материалом электрода. Например, цинковый электрод:
Активность свободного металла принимается равной единице. Электродные потенциалы отличаются от редокс-потенциалов, для которых материал электрода не имеет значения, так как они химически инертны по отношению ко всем веществам в растворе, и от мембранных, для которых разность потенциалов на мембране измеряется с помощью пары других (в принципе, возможно, одинаковых) электродов.
Потенциометрические методы анализа известны с конца прошлого века, когда Нернст вывел (1889) известное уравнение (1), а Беренд сообщил (1883) о первом потенциометрическом титровании. Интенсивное развитие потенциометрии в последние годы связано, главным образом, с появлением разнообразных типов ионоселективных электродов, позволяющих проводить прямые определения концентрации многих ионов в растворе, и успехами в конструировании и массовом выпуске приборов для потенциометрических измерений.
Потенциометрические методы анализа подразделяют на прямую потенциометрию (ионометрию) и потенциометрическое титрование. Методы прямой потенциометрии основаны на прямом применении уравнения Нернста (1) для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу соответствующего электрода. При потенциометрическом титровании точку эквивалентности определяют по резкому изменению (скачку) потенциала вблизи точки эквивалентности.
Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец. — 2-е изд., перераб. и доп. — М.:Дрофа, 2002. — 384 с., ил. — С. 179-181.
💡 Видео
Электрохимический ряд потенциалов. 1 часть. 10 класс.Скачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

4 3 Электрохимический потенциалСкачать

Уравнение НернстаСкачать
Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

Электродные потенциалы металлов. Электроды сравненияСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

011 Электрохимия 4 уравнение НернстаСкачать

Лекция 6 Водородный электрод в качестве электрода сравненияСкачать

Лекция 4 Уравнение Нернста. Электрохимическое равновесиеСкачать

Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Лекция 60 Электродный потенциалСкачать

Электроды и гальванические элементыСкачать

Использование таблиц потенциалов и расчет ЭДС реакции. Продукты в ОВР. Ч.5-1.Скачать

ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

Потенциометрический принцип измерения рНСкачать

Потенциал покоя и равновесный потенциалСкачать