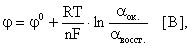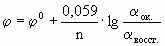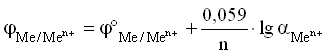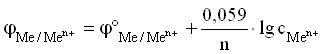Лабораторная работа № 5. Исследование электрохимических потенциалов между различными металлами
1. Применение уравнения Нернста
В общем случае для цепи, где число электронов, участвующих в окислительно-восстановительных процессах, протекающих на электродах, различно (z1≠ z2) (–) Ме1 | 



уравнение ЭДС будет иметь вид:

Это основное уравнение ЭДС гальванического элемента составленного из двух металлических электродов, его часто называют уравнением Нернста для определения ЭДС гальванического элемента.
ЭДС элемента (Е) рассчитывается как разность величины потенциала катода и величины потенциал анода.
Зависимость электродного потенциала металла от активности потенциалопределяющих ионов в растворе дается уравнением электродного потенциала Нернста:

По данным о стандартных электродных потенциалах меди и цинка рассчитать ЭДС элемента, составленного из полуэлементов:

Решение: Рассчитаем ЭДС по уравнению
Упростим выражение подставив известные величины:
Значение стандартных электродных потенциалов находим в справочнике:




Так как медный полуэлемент более электроположителен, то
Ответ: Е = 1,135 В.
Определить активность ионов меди, если ЭДС цепи
при T = 298 К равна 0,08885 В.
Решение: ЭДС цепи равна разности электродных потенциалов:
откуда x = 0,0013 моль/л.
Ответ: а1 = 0,0013 моль/л.
При Т = 298 К электродный потенциал электрода
равен 0,2712 В. Определить стандартный потенциал медного электрода.
Ответ:
Видео:Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Видео:Уравнение НернстаСкачать
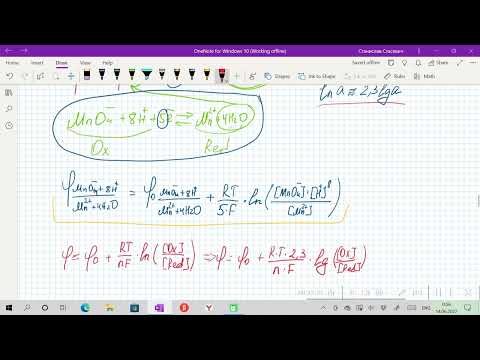
Уравнение Нернста. Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях
Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях, можно рассчитать по уравнению Нернста:
где: φ — электродный потенциал окислительно-восстановительного электрода, В;
φ 0 — стандартный электродный потенциал этого электрода, В, R — универсальная газовая постоянная, равная 8,314 Дж/моль· К, T – температура в K; n — число электронов в уравнении электродной реакции, F — число Фарадея, равное 96500 Кл/моль, aок., a восст. — активности окисленной формы восстановителя (Ме n+ ) и восстановленной формы окислителя (Ме) в электродной реакции. Подставив в уравнение Нернста T = 298 K, R, F и введя множитель 2,3 (переход к десятичным логарифмам), получим:
Уравнение Нернста для металлического электрода имеет вид:
Для разбавленных растворов, в которых активности мало отличаются от концентрации (a » С):
Величина j°Me n+ /Me 0 называется стандартным ЭП металлического электрода. Значение ЭП металлического электрода равно величине стандартного ЭП металлического электрода при концентрации ионов металла в растворе, равной 1 моль/л. Стандартный электродный потенциал – равновесная разность потенциалов гальванического элемента, составленного из стандартного водородного электрода (электрод сравнения) и электрода, потенциал которого определяется в стандартных условиях.
Дата добавления: 2015-07-30 ; просмотров: 2579 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
💡 Видео
Электрохимический ряд потенциалов. 1 часть. 10 класс.Скачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Электродные потенциалы металлов. Электроды сравненияСкачать

Урок 298. Электрический ток в жидкостях. Закон Фарадея для электролизаСкачать

011 Электрохимия 4 уравнение НернстаСкачать

В парламенте обсудили проблемные вопросы технологического присоединения к электрическим сетямСкачать

БТГ. Холодный ток или положительное электричество от Э. ГреяСкачать

ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

Составление схемы и вычисление ЭДС гальванического концентрационного элемента | Уравнение НернстаСкачать

Introduction to ElectrochemistryСкачать

Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

4 3 Электрохимический потенциалСкачать

Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

Гальванический элементСкачать

4 3 Термодинамика гальванического элемента, ч 2Скачать

Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать