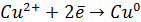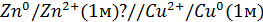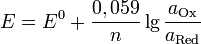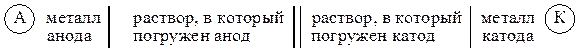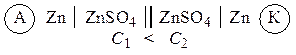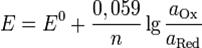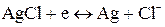Лабораторная работа № 1
Определение термодинамических характеристик электрохимических цепей.
Система, состоящая из двух электродов, помещенных в раствор электролита, которая при соединении электродов вне электролита каким-либо металлическим проводником создает во внешней цепи электрический ток, называется гальваническим (или электрохимическим) элементом.
Условная запись (схема) гальванического элемента
Для описания гальванических элементов применяется условная запись, в соответствии с которой сначала указывается материал одного из электродов, далее – раствор, в который помещен этот электрод, затем раствор, в который погружен второй электрод, и, наконец, материал другого электрода. Электроды отделяются от раствора сплошной вертикальной линией, а растворы разделяются либо двумя вертикальными линиями, когда считают, что на границе растворов нет скачка потенциала, либо пунктирной линией, когда таким скачком пренебречь нельзя. Так, медно-цинковый элемент может быть записан следующим образом:
где знаки + и – указывают полярность электродов; c1 и c2 – концентрации растворов.
При большой разнице между c1 и c2, когда нельзя пренебречь скачком потенциала на границе двух растворов, этот элемент записывают в другом виде:
(-)Zn½ZnSO4
В тех же случаях, когда хотят указать только участвующие в электродных реакциях ионы, запись упрощают:
Для обратимо работающего гальванического элемента ток всегда должен идти слева направо, а на концах быть один и тот же металл.
Устройство медно-цинкового гальванического элемента (элемента Даниэля-Якоби) показано на рисунке.
Рисунок — Медно-цинковый элемент (элемент Даниэля-Якоби):
1 – пористая диафрагма; 2 – цилиндрический электрод из листового цинка; 3 – медный электрод.
При замыкании электродов через внешнюю цепь на медном электроде пойдет процесс восстановления меди:
а на цинковом электроде – процесс окисления цинка:
Электроны, остающиеся на электроде при реакции окисления, будут перетекать во внешней цепи от цинка к меди, где будут участвовать в процессе восстановления меди. В растворе при работе гальванического элемента ток будет переноситься ионами меди и цинка, движущимися к цинковому электроду, и сульфат-ионами, движущимися к медному электроду.
Равновесные потенциалы медного и цинкового электродов связаны с активностями ионов меди и цинка в растворе уравнением Нернста:
Электродвижущая сила (ЭДС) гальванического элемента. Стандартная ЭДС
Разность равновесных потенциалов электродов гальванического элемента называется электродвижущей силой этого элемента. Для элемента Даниэля-Якоби это можно выразить:

где 
Стандартная ЭДС обратимо работающего гальванического элемента равна разности стандартных потенциалов отдельных электродов гальванического элемента, причем, так как ЭДС всегда положительная величина, от положительного потенциала отнимается отрицательный потенциал.
Вывод уравнения Нернста для гальванического элемента
Если в электрохимической системе обратимо и изотермически протекает следующая реакция:

при 
и обратимая ЭДС ( ЕP, T) системы определяется как:
В то же время изменение энергия Гиббса реакции определяется формулой:
и так как 
где 
В состоянии равновесия при данных давлении и температуре 
Если активности всех компонентов равны единице (аi=1), то 


где Ка — константа равновесия реакции. Из этого следует, что:
Если аi = 1, то 
где Е0 — стандартная ЭДС. Полученное после подстановки уравнение называется уравнением Нернста:


Обратимые и необратимые гальванические элементы
Гальванические элементы могут быть обратимыми и необратимыми. Гальванический элемент является обратимым, если токообразующая реакция в элементе может быть обращена в противоположном направлении при приложении к нему извне ЭДС, превышающей собственную ЭДС элемента на бесконечно малую величину. Примером обратимых гальванических элементов может служить элемент Даниэля-Якоби (если пренебречь переходом ионов через границу растворов):
В этом элементе при его работе будет иметь место реакция:
Zn + CuSO4 ® Cu + ZnSO4
Если к элементу приложить внешнюю ЭДС, противоположно направленную относительно ЭДС элемента, то в нем будет идти реакция:
Cu + ZnSO4 ® CuSO4+ Zn,
т. е. в отличие от токообразующей реакции в элементе медь начнет растворяться, а цинк – выделяться из раствора.
Примером необратимого элемента может служить цепь:
В этом элементе при его работе будет идти процесс:
Zn + CuSO4 ® ZnSO4+Cu
Если приложить к нему внешнюю противоположно направленную ЭДС, то будет происходить процесс растворения меди на медном электроде и ее выделение на цинковом, т. е. этот процесс не будет обратным процессу при работе такого гальванического элемента.
Термодинамические характеристики гальванического элемента
Работа какого-либо обратимого процесса при определенных ограничениях, налагаемых на условия осуществления процесса, например при постоянстве температуры и давления, будет максимальной полезной работой, поэтому термодинамический расчет ЭДС возможен только в случае обратимых гальванических элементов. Зависимость максимальной полезной работы химической реакции в гальваническом элементе от температуры можно связать с уравнениями Гиббса-Гельмгольца:
Максимальная полезная работа электрохимической реакции равна
Подставляя в уравнения Гиббса-Гельмгольца вместо DG и DF их значения, выраженные через ЭДС, можно получить эти уравнения в форме, связывающей ЭДС с тепловым эффектом реакции и температурой:
где ¶Е/¶T – температурный коэффициент, который показывает во сколько раз изменяется ЭДС при увеличении температуры на 1 К.
Или, учитывая, что — DН=Qp – тепловой эффект реакции при постоянном давлении, а — DU=Qv — тепловой эффект реакции при постоянном объеме, можно получить уравнения Томсона, являющиеся частным случаем уравнений Гиббса-Гельмгольца:
В том случае, когда ЭДС гальванического элемента не зависит от температуры, т. е. (¶Е/¶T)р=0 или (¶Е/¶T)v=0, эти уравнения переходят в:
Если ¶Е/¶T > 0, то 
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Элемент Даниэля-Якоби. Приведите уравнение реакции, протекающей в данном элементе. Уравнение Нернста, связь ЭДС с концентрациями потенциалопределяющих ионов.
Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Способен преобразовать энергию химической реакции в электрическую. Рассмотрим устройство и принцип работы гальванического элемента Даниэля-Якоби. Он состоит из корпуса 1 (рис. 22), разделенного на две части пористой перегородкой 2. В каждую из частей помещаются электроды: медный 3 и цинковый 4. Медный электрод погружается в раствор сульфата меди, цинковый – в раствор сульфата цинка. Пористая перегородка предотвращает смешивание соприкасающихся растворов и пространственно разделяет окислительно-восстановительную реакцию, протекающую при замкнутой внешней цепи: окисление цинка и восстановление меди.
2ē переходят по цепи.
Итак, при работе элемента Даниэля-Якоби протекают процессы:
Восстановление ионов меди:
Процессы восстановления называют в электрохимии катодными, а электроды, на которых идут процессы восстановления – катодами.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
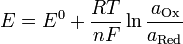
§ 
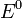
§ 
§ 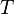
§ 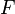
§ 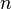
§ 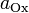
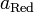
Если в формулу Нернста подставить числовые значения констант 
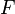

Химические гальванические элементы, понятие и примеры. Зависимость ЭДС от активностей участников электрохимической реакции, протекающей в гальваническом элементе. Вывод и анализ уравнения Нернста
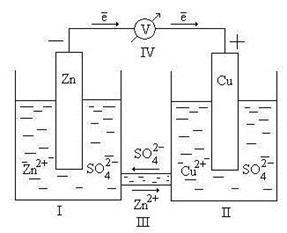
Гальванический элемент – это химический источник тока, в котором энергия, выделяющаяся при протекании на электродах окислительно-восстановительной реакции, непосредственно преобразуется в электрическую энергию. Принцип работы гальванического элемента можно рассмотреть на примере Даниэля Якоби (рис 9.2).
Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит).
Стандартный электродный потенциал цинкового электрода 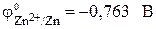
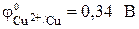

| Zn – 2? = Zn 2+ . | (а) |
Электрод, на котором идет реакция окисления или который посылает катионы в электролит, называется анодом. У рассматриваемого гальванического элемента в роли анода выступает цинковый электрод. Так как стандартный электродный потенциал цинка ниже, чем у меди, цинковому электроду приписывается условный заряд «–», а медному – «+».
Электроны, освободившиеся в результате окисления, по внешней цепи переходят на медь (возникает электрический ток).
На медном электроде происходит процесс восстановления катионов электролита Cu 2+ :
| Cu 2+ +2? = Cu. | (б) |
Электрод, на котором идет реакция восстановления или который принимает катионы из электролита, называется катодом.
Через электролитический ключ происходит движение ионов в растворе: анионов SO4 2– к аноду, катионов Zn 2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Реакции (а) и (б) называются электродными реакциями.
Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
| Zn + Cu 2+ = Zn 2+ + Cu | (в) |
или, с учетом анионов раствора:
| Zn + CuSO4= ZnSO4+ Cu. | (г) |
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
| MeА + MeК n+ Á MeА n+ + MeК, | (д) |
где индексы А и К относятся к металлам анода и катода соответственно.
Реакции (в) – (д) называются токообразующими реакциями.
Символическая запись (схема) гальванического элемента имеет вид:
Часто вместо растворов обозначают только катионы, содержащиеся в растворе:
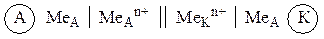 | (9.3) |
Схема гальванического элемента Даниэля – Якоби имеет вид:
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента Е. Она вычисляется по формуле;
| Е= φк – φа, | (9.4) |
где φк и φа – электродные потенциалы катода и анода соответственно.
Величина ЭДС элемента Даниэля – Якоби при стандартных условиях равна:
Электродвижущая сила Е характеризует способность гальванического элемента совершать электрическую работу во внешней цепи.
Электрическая работа определяется максимальной полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала ?G процесса. Связь между величиной ?G и ЭДС описывается уравнением:
| ?G = –nFE, | (9.5) |
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея.
Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях ?G 0 связана с константой равновесия этой реакции Кравн соотношением
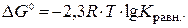 | (9.6) |
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимно обратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:
Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой ( разностью потенциалов ) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов. 
· 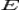
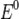
· 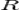
· 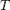
· 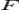
· 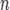
· 
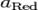
Если в формулу Нернста подставить числовые значения констант 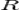
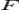

Химические гальванические элементы. Приведите пример гальванического элемента, составленного из электродов первого и второго рода, электрохимическая цепь без жидкостных соединений — «без переноса». Запишите уравнения электродных полуреакций и уравнение химической реакции, самопроизвольно протекающей при включении данного гальванического элемента во внешнюю цепь.
Процессы, протекающие в этом элементе:
(–) Анод Sn 2+ – 2ē →Sn 4+
(+) Катод 2Fe 3+ + 2ē → 2Fe 2+
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
Цепь без переноса–это цепь без жидкостной границы. Например, 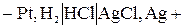
катод
анод
Поскольку электролит является общим для обоих электродов, диффузионный потенциал в таких цепях не возникает.
Химические гальванические элементы. Приведите пример элемента, составленного из газового электрода и электрода первого рода, электрохимическая цепь с переносом. Зависимость ЭДС элемента от давления газообразного участника реакции, протекающей в элементе
Цепь с переносом – это цепь с жидкостной границей. Например:
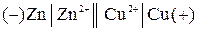
В состав электродов входят растворы различной природы или различной концентрации. Контакт между двумя растворами обеспечивается с помощью специальных приспособлений, например, солевым мостиком, состоящим из трубки, заполненной смесью влажного желеобразного вещества агар-агара с солью сильного электролита (КСl). Диффузионный потенциал на границе раздела раствор-раствор в этом случае устраняется.
Зависимость эдс от давления:
66. Химические гальванические элементы, основные типы. Применение измерений ЭДС для определения тепловых эффектов и энтропий химических реакций, самопроизвольно протекающих в гальванических элементах.
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.
Типы гальванических элементов:
Гальванические первичные элементы — это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля—Якоби.
Широкое распространение получили марганцево-цинковые элементы, не содержащие жидкого раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше: цинковый электрод служит катодом, электрод из смеси диоксида марганца с графитом служит анодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Вторичные источники тока (аккумуляторы) — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую.
Одним из наиболее распространённых аккумуляторов является свинцовый (или кислотный). Электролитом является 25—30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решётки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в сульфат свинца (II) — PbSO4.
Также существуют щелочные аккумуляторы: наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит гидроксид калия (K-OH).
В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Электрохимические генераторы (топливные элементы) — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента, электроды не расходуются. Восстановителем является водород (H2), метанол(CH3OH), метан (CH4); в жидком или газообразном состоянии. Окислителем обычно является кислород — из воздуха или чистый. В кислородно-водородном топливном элементе с щелочным электролитом, происходит превращение химической энергии в электрическую. Энергоустановки применяются на космических кораблях: они обеспечивают энергией космический корабль и космонавтов
Видео:Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Уравнение нернста для гальванического элемента даниэля якоби
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.1 Электрические потенциалы на фазовых границах
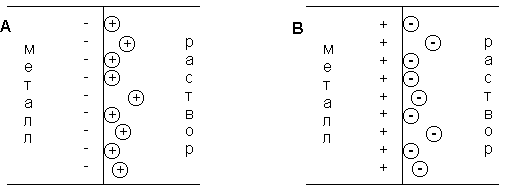
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой (рис. 3.12а; о моделях строения ДЭС смотрите п. 4.2.4). Отрицательный заряд на электроде будет препятствовать дальнейшему переходу ионов меди в раствор, и через некоторое время установится динамическое равновесие, которое можно однозначно охарактеризовать потенциалом электрического поля ДЭС Φ, зависящего от заряда на электроде, или некоторой равновесной концентрацией ионов в приэлектродном слое Сo. При погружении медного электрода в раствор СuSО4, содержащий ионы меди в концентрации С возможны три случая:
Рис. 3.12 Схема двойного электрического слоя на границе электрод-раствор
1. С Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО4 2- (рис. 3.12b).
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом , электрод, на котором идет процесс восстановления – катодом . При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
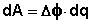
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента .
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
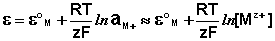
В уравнении Нернста ε ° – стандартный электродный потенциал , равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε ° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
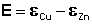
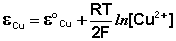
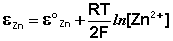
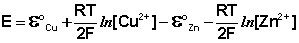
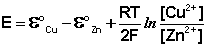
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
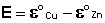
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] 2+ ] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
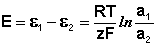
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Copyright © С. И. Левченков, 1996 — 2005.
🎥 Видео
Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Разбор схемы гальванического элементаСкачать

Гальванический элементСкачать

Гальванический элементСкачать

Гальванические элементыСкачать
Гальванические элементы. Практическая часть. 10 класс.Скачать

Лабораторная работа "Гальванический элемент"Скачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Составление схемы и вычисление ЭДС гальванического концентрационного элемента | Уравнение НернстаСкачать

Лекция 77 Химические цепи с переносом Элемент Даниэля-ЯкобиСкачать

ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТСкачать

011 Электрохимия 4 уравнение НернстаСкачать

Уравнение НернстаСкачать
Электроды и гальванические элементыСкачать

Дмитрий Евстафьев: большая европейская войнаСкачать

Электрохимический ряд потенциалов. 1 часть. 10 класс.Скачать

Гальванические элементы. 2 часть. 10 класс.Скачать