ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
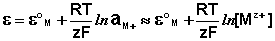
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
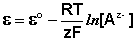
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения . В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
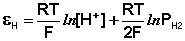
Каломельный электрод . Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
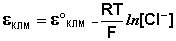
Хлорсеребряный электрод . В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора:
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
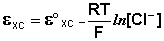
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод , относящийся к классу окислительно-восстановительных электродов (см. ниже), представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 – соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
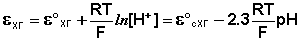
Стеклянный электрод , являющийся наиболее распространенным индикаторным электродом, относится к т.н. ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
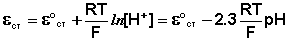
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe 3+ до Fe 2+ за счет электронов, полученных от платины, либо окисление ионов Fe 2+ до Fe 3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом . Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H + // Fe 3+ , Fe 2+ / Pt
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
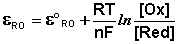
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
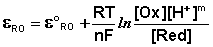
При составлении гальванических элементов с участием редокс-электрода электродная реакции на последнем в зависимости от природы второго электрода может быть либо окислительной, либо восстановительной. Например, если составить гальванический элемент из электрода Pt / Fe 3+ , Fe 2+ и второго электрода, имеющего более положительный электродный потенциал, то при работе элемента редокс-электрод будет являться анодом, т.е. на нем будет протекать процесс окисления:
Если потенциал второго электрода будет меньше, чем потенциал электрода Pt / Fe 3+ , Fe 2+ , то на последнем будет протекать реакция восстановления и он будет являться катодом:
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Copyright © С. И. Левченков, 1996 — 2005.
Видео:Классификация электродов 1Скачать

УРАВНЕНИЕ НЕРНСТА
Если одни из электродов — стандартный водородный, то выражение для ЭДС гальванического описывается уравнением Нернста:
где R — универсальная газовая постоянная, 8,314 Дж/(моль-К); Т — абсолютная температура, К; F — постоянная Фарадея, 96500 Кл; п — число электронов в полуреакции Ох + пе = Red», ?ox/Red — равновесный электродный потенциал, В; ?°ox/Red — стандартный электродный потенциал полуреакции, В; аох и «Red— активности окисленной и восстановленной формы в степенях, соответствующих стехиометрическим коэффициентам.
Для разбавленных растворов активности можно заменить на равновесные концентрации окисленной и восстановленной формы: [Од:], [Red]. Активности для твердых веществ и воды равны единице.
Постоянные величины констант и коэффициента перехода от натуральных логарифмов к десятичным (2,3) можно заменить температурным коэффициентом, равным при 298 К (25 °С) 0,059:
Пример 7.1. Записать уравнение Нернста для восстановительноокислительного потенциала пары:
Решение. Необходимо найти в справочнике табличные значения стандартных электродных потенциалов и подставить их в уравнение (7.1):
- а) Е° = 0,771 В, поэтому Е = 0,771 — 0,059*lg([Fe 3+ ]/[Fe 2+ ]);
- б) Е° = 1,51 В, поэтому Е- 1,51 + 0,059/5 *lg([Mn04][H + ] 8 /[Mn 2+ ]).
Пример 7.2. Потенциал серебряного электрода в растворе соли серебра равен 0,434 В (относительно стандартного водородного электрода). Какова равновесная концентрация ионов Ag + , если E°(Ag + /Ag) = 0,799 В.
Решение. Необходимо записать уравнение (7.1):
Поскольку равновесная концентрация металлического серебра равна единице, то уравнение примет вид:
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

ИНДИКАТОРНЫЕ ЭЛЕКТРОДЫ
В электрохимических методах анализа в качестве индикаторных используют мембранные и металлические электроды.
Видео:Лекция 64 Классификация электродов Электрод первого родаСкачать

Металлические электроды
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Электроды первого рода обратимы по катиону, и их потенциал связан уравнением Нернста с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
Уравнение Нернста для системы металл раствор:
где R — универсальная газовая постоянная, 8,314 Дж/(моль К); Т — абсолютная температура, К; F — постоянная Фарадея, 96500 Кл; п — валентность ионов металла; ?ме п+ /ме — равновесный электродный потенциал, В; ?°ме п+ /ме — стандартный электродный потенциал, В; [Ме п+ ] — равновесная концентрация ионов металла, моль/л.
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. К электродам этого типа относится хлоридсеребряный электрод, он обратим относительно аниона, и зависимость его электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
Видео:Как расспознать тип электродов и понять для чего они применяются?!Скачать

Уравнение нернста для электродов обратимых по катиону электродов 1 го рода имеет вид
К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов.
Электродами первого рода являются:
1. Электроды, состоящие из элементарного вещества , находящегося в контакте с раствором, содержащим его собственные ионы .
а) Металлический электрод – металл, погруженный в раствор своей соли M|M, например, цинковый и медный электроды:
 |  |
 |  |
Металлический электрод обратим по отношению к катиону. Его электродный потенциал
|
б) Газовый электрод в качестве одного из компонентов электродной пары содержит газ (H2, Cl2 и др.), адсорбированный на химически инертном проводнике первого рода (обычно платина, покрытая платиновой чернью). При контакте адсорбированного газа с раствором собственных ионов устанавливается равновесие. Для хлорного и водородного электродов это равновесие можно представить уравнениями:
 |
 |
Соответствующие им уравнения Нернста имеют вид:
 |
 |
Очевидно, что их электродный потенциал зависит от давления и активности (концентрации) ионов в растворе.
🔥 Видео
Расшифровка обозначений электродовСкачать

Электродные потенциалы металлов. Электроды сравненияСкачать

Лекция 68 Газовые электродыСкачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Каким должен быть наклон электрода? | АКАДЕМИЯ СВАРГО #shortsСкачать

Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Лекция 66 Классификация электродов Электрод третьего родаСкачать

Какие электроды выбрать для определенных работСкачать

классификация электродов продолжениеСкачать

Почему залипает электрод? 👨🏭 АКАДЕМИЯ СВАРИВАЕМ БУДУЩЕЕ #shorts #сварка #сварго #свариваембудущееСкачать

Провар корня шва сверху вниз электродом. Кто использует такую технологию?Скачать

Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

Секрет держателя для электрода #стройка #сварка #лайфхакиСкачать

Когда электроды хороши #сварка #электродыСкачать

Мало кто знает о такой сварке! | Универсальный электрод!Скачать






