Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
- Способ получения
- Качественная реакция
- Химические свойства
- 1. Дано уравнение реакции получения аммиака: N2 + 3H2 ↔ 2NH3 + Q
- При каких условиях усилится гидролиз соли карбоната натрия
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 📺 Видео
Видео:How to Balance NaHCO3=Na2CO3+H2O+CO2|Chemical equation NaHCO3=Na2CO3+H2O+CO2Скачать

Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Видео:Double displacement of NaHCO3 + Ca(OH)2 | Precipitation reactionСкачать

Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Видео:how to balance naoh+co2=na2co3+h2oСкачать

Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом . При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
2.5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы . При этом образуются карбонат натрия и углекислый газ:
Видео:Тип реакции для NaHCO3 = Na2CO3 + H2O + CO2Скачать

1. Дано уравнение реакции получения аммиака: N2 + 3H2 ↔ 2NH3 + Q
Дайте характеристику реакции по всем изученным вами классификационным признакам.
А) обмена, экзотермическая.
1) Zn + 2HCl → ZnCl2+H2↑
Б) замещения, окислительно — восстановительная.
2) H2S + 2NaOH → Na2S + 2H2O + Q
В) разложения, гетерогенная.
3) 2SO2 + O2 → 2SO3
Г) соединения, гомогенная.
4) 2Fe(OH)3 → Fe2O3 + 3H2O
3. Приведите примеры образования оксида углерода (IV) в результате реакции:
4. Проставьте коэффициенты в следующих схемах реакции, определите к какому типу относиться каждая из них:
CaO + H3PO4 → Ca3(PO4)2 + H2O
Ca(HCO3)2 → CaCO3 + H2O + CO2↑
Al + HCl → AlCl3 + H2↑
5. К какому типу химической реакции относиться образование оксида железа(II) в результате:
взаимодействия железного гвоздя с водой;
прокаливания гидроксида железа(II);
сжигания железных опилок в кислороде;
термическое разложение карбоната железа(II) без доступа воздуха?
6*. По каким внешним признакам можно судить, что произошла химическая реакция при взаимодействии следующих пар веществ:
Завершите уравнения химических реакций, укажите названия образующихся веществ, расставьте коэффициенты и укажите, к какому типу реакций относиться каждая из них.
Видео:Sodium Hydrogen Carbonate explanationСкачать

При каких условиях усилится гидролиз соли карбоната натрия
Задача 1001.
Добавление каких из указанных веществ усилит гидролиз карбоната натрия: а) NаОН; б) ZnCl 2 ; в) Н 2 O; г) К 2 S?
Решение:
Na 2 CO 3 – соль сильного основания и слабой кислоты гидролизуется по аниону. Гидролиз практически протекает по первой ступени:
а) При добавлении к раствору карбоната натрия, содержащему избыток ионов OH − , раствора NaOH в смеси появится дополнительное количество ионов ОН − (NaOH ↔ Na + + OH − ). Избыток ионов ОН − , согласно принцип Ле Шателье, сместит равновесие в системе влево, в сторону уменьшения концентрации ионов ОН − , т.е. гидролиз соли замедлится.
б) ZnCl2 – соль сильной кислоты и слабого основания гидролизуется по катиону. Гидролиз практически протекает по первой ступени:
Zn 2+ + H2O ↔ ZnOH + + H + ;
При гидролизе ZnCl2 образуется избыток ионов Н + . Поэтому при приливании раствора хлорида цинка к раствору карбоната натрия произойдёт связывание ионов Н+ и ОН- с образованием Н2О (Н + + ОН − ↔ Н2О). Таким образом, согласно принципу Ле Шателье, равновесие в системе сместится вправо, в сторону увеличения концентрации Н2О, т. е. гидролиз обеих солей усилится.
в) При разбавлении раствора карбоната натрия водой концентрация ионов ОН − уменьшится что, согласно принципу Ле Шателье, сместит равновесие системы вправо, в сторону увеличения концентрации ионов ОН − , т. е. гидролиз солей взаимно усилится.
г) K2S – соль сильного основания и слабой кислоты гидролизуется по аниону. Гидролиз практически протекает по первой ступени:
S 2 − + H2O ↔ HS − +OH − ;
При гидролизе сульфида калия образуется избыток ионов ОН − . Поэтому при добавлении раствора сульфида калия к раствору карбоната натрия образуется дополнительный избыток ионов ОН − , что, согласно принципу Ле Шателье, сместит равновесие системы влево, в сторону уменьшения концентрации ионов ОН − , т. е. гидролиз обеих солей замедлится.
Видео:Balance equation NaHCO3=Na2CO3+H2O+CO2Скачать

Please wait.
Видео:Na2CO3+HClO3=NaClO3+CO2+H2O balance the chemical equation by law of conservation of mass.Скачать
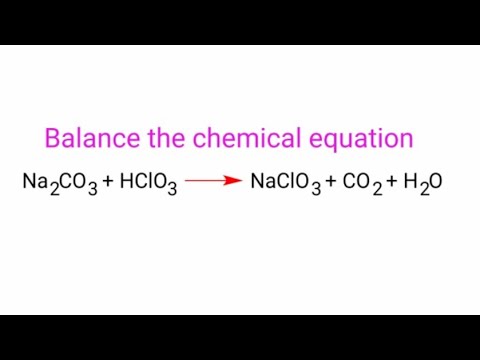
We are checking your browser. gomolog.ru
Видео:Как сбалансировать NaHCO3 + NaOH = Na2CO3 + H2O (бикарбонат натрия + гидроксид натрия)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Кондуктометрическое титрование (NaOH + HCl → NaCl + H₂O)Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7077e6524daf0b5f • Your IP : 85.95.179.80 • Performance & security by Cloudflare
📺 Видео
Как сбалансировать NaHCO3 = Na2CO3 + H2O + CO2Скачать

Окисление иодида калия KI + H2O2, KI + CuSO4, KI + Fe(NO3)3, KI + KMnO4Скачать

CH3COOH+NaHCO3=CH3COONa+CO2+H2O balance the chemical equation @mydocumentary838.Скачать

NaHCO3 + Ca(OH)2. Natri hidrocacbonat (sodium bicarbonate) PƯ với canxi hidroxit (calcium hydroxide)Скачать

Каталитическое разложение H2O2 под действием MnO2Скачать

Гибридизация - смысл. Разбор 10 молекул:CH4, NH3, H2O, C2H4, BCl3, SO2, SO3, BeCl2, CO2, C2H2.Скачать

КАК УРАВНЯТЬ NH3 + O2 = N2 + H2O ЭЛЕКТРОННЫМ БАЛАНСОМ / Реакция аммиака и кислородаСкачать

Как сбалансировать H2CO3 + NaOH = Na2CO3 + H2OСкачать

How to Balance NaHCO3 + HBr = H2O + CO2 + NaBrСкачать

Как сбалансировать Na2CO3 + H2O = NaOH + CO2 (карбонат натрия + вода)Скачать

How to balance CH3COOH+NaOH=CH3COONa+H2O| Chemical equation CH3COOH+NaOH=CH3COONa+H2O| CH3COOH+NaOH=Скачать
