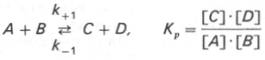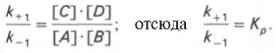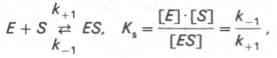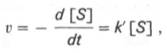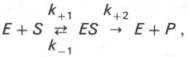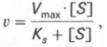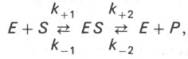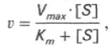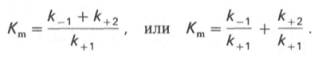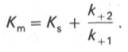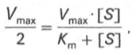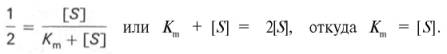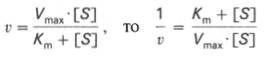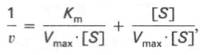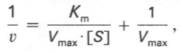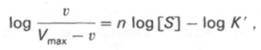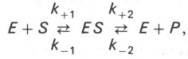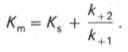Одним из характерных проявлений жизни является удивительная способность живых организмов кинетически регулировать химические реакции, подавляя стремление к достижению термодинамического равновесия. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакций является получение информации, которая может способствовать выяснению молекулярного механизма действия фермента.
Общие принципы кинетики химических реакций применимы и к ферментативным реакциям. Известно, что любая химическая реакция характеризуется константой термодинамического равновесия. Она выражает состояние химического равновесия, достигаемого системой, и обозначается Кр. Так, для реакции:
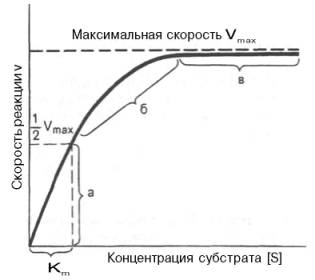
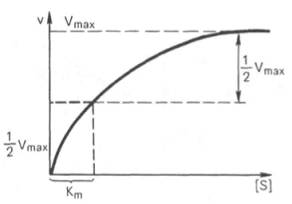
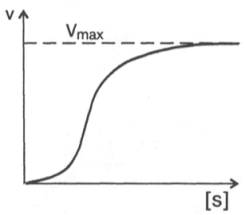
Рис. 4.12. Теоретический график зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
а — реакция первого порядка (при [ S ]
Таким образом, константа равновесия равна отношению констант скоростей прямой и обратной реакций. Величину, обратную константе равновесия, принято называть субстратной константой, или, в случае ферментативной реакции, константой диссоциации фермент–субстратного комплекса, и обозначать символом KS. Так, в реакции
т.е. KSравна отношению произведения концентрации фермента и субстрата к концентрации фермент-субстратного комплекса или отношению констант скоростей обратной и прямой реакций. Следует отметить, что константа KSзависит от химической природы субстрата и фермента и определяет степень их сродства. Чем ниже значение KS, тем выше сродство фермента к субстрату.
При изучении кинетики ферментативных реакций следует учитывать одну важную особенность этих реакций (не свойственную обычным химическим реакциям), связанную с явлением насыщения фермента субстратом. При низкой концентрации субстрата зависимость скорости реакции от концентрации субстрата (рис. 4.12) является почти линейной и подчиняется кинетике первого порядка. Это означает, что скорость реакции S —> Р прямо пропорциональна концентрации субстрата S и в любой момент времени t определяется следующим кинетическим уравнением:
где [S] – молярная концентрация субстрата S; –d[S]/dt – скорость убыли субстрата; k’ – константа скорости реакции, которая в данном случае имеет размерность, обратную единице времени (мин –1 или с –1 ).
При высокой концентрации субстрата скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата [ S ] . В этом случае реакция подчиняется кинетике нулевого порядка v = k» (при полном насыщении фермента субстратом) и целиком определяется концентрацией фермента. Различают, кроме того, реакции второго порядка, скорость которых пропорциональна произведению концентраций двух реагирующих веществ. В определенных условиях при нарушении пропорциональности говорят иногда о реакциях смешанного порядка (см. рис. 4.12).
Изучая явление насыщения, Л. Михаэлис и М. Ментен разработали общую теорию ферментативной кинетики. Они исходили из предположения, что ферментативный процесс протекает в виде следующей химической реакции:
т.е. фермент Е вступает во взаимодействие с субстратом S с образованием промежуточного комплекса ES, который далее распадается на свободный фермент и продукт реакции Р. Математическая обработка на основе закона действующих масс дала возможность вывести уравнение, названное в честь авторов уравнением Михаэлиса–Ментен, выражающее количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:
Из уравнения Михаэлиса–Ментен следует, что при высокой концентрации субстрата и низком значении KSскорость реакции является максимальной, т.е. v = Vmax(реакция нулевого порядка, см. рис. 4.12). При низкой концентрации субстрата, напротив, скорость реакции оказывается пропорциональной концентрации субстрата в каждый данный момент (реакция первого порядка).
Следует указать, что уравнение Михаэлиса–Ментен в его классическом виде не учитывает влияние на скорость ферментативного процесса продуктов реакции, например в реакции
и носит несколько ограниченный характер. Поэтому были предприняты попытки усовершенствовать его. Так, было предложено уравнение Бриггса-Холдейна:
где Кm представляет собой константу Михаэлиса, являющуюся экспериментально определяемой величиной. Она может быть представлена следующим уравнением:
Рис. 4.13. Кривая уравнения Михаэли-са-Ментен: гиперболическая зависимость начальных скоростей катализируемой ферментом реакции от концентрации субстрата.
В числителе представлены константы скоростей распада комплекса ES в двух направлениях (в сторону исходных Е и S и в сторону конечных продуктов реакции Е и Р). Отношение k–1/ k+1представляет собой константу диссоциации ферментсубстратного комплекса KS, тогда:
Отсюда вытекает важное следствие: константа Михаэлиса всегда больше константы диссоциации фермент-субстратного комплекса KSна величину
Для определения численного значения Кm обычно находят ту концентрацию субстрата, при которой скорость ферментативной реакции v составляет половину от максимальной Vmax, т.е. если v = 1 /2 Vmaх. Подставляя значение v в уравнение Бриггса–Холдейна, получаем:
разделив обе части уравнения на Vmах, получим
Таким образом, константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость данной ферментативной реакции составляет половину от максимальной.
Определение величины Кm имеет важное значение при выяснении механизма действия эффекторов на активность ферментов и т.д. Константу Михаэлиса можно вычислить по графику (рис. 4.13). Отрезок на абсциссе, соответствующий скорости, равной половине максимальной, будет представлять собой Кm.
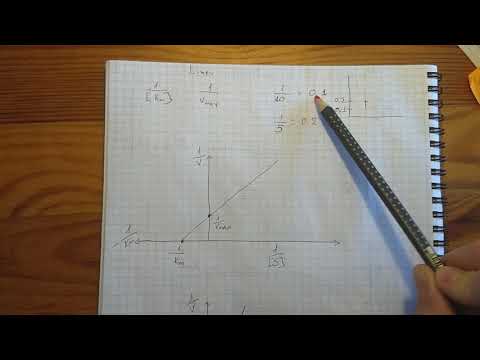
Пользоваться графиком, построенным в прямых координатах зависимости начальной скорости реакции v0 от начальной концентрации субстрата [S0], неудобно, поскольку максимальная скорость Vmaxявляется в данном случае асимптотической величиной и определяется недостаточно точно.
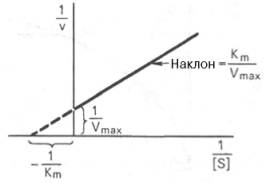
Рис. 4.14. График Лайнуивера-Бэрка.
Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк преобразовали уравнение Бриггса–Хол-дейна по методу двойных обратных величин исходя из того принципа, что если существует равенство между двумя какими-либо величинами, то и обратные величины также будут равны. В частности, если
то после преобразования получаем уравнение:
которое получило название уравнения Лайнуивера–Бэрка. Это уравнение прямой линии: у = ах + b. Если теперь в соответствии с этим уравнением построить график в координатах 1/v (y) от l/[S] (x), то получим прямую линию (рис. 4.14), тангенс угла наклона который будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax(обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, тогда на абсциссе отсекается отрезок, соответствующий обратной величине константы Михаэлиса – 1/Кm (см. рис. 4.14). Таким образом, величину Кm можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений.
Следует подчеркнуть, что значения Vmax, как и величину Кm, более точно, чем по графику, построенному в прямых координатах, можно определить по графику, построенному по методу двойных обратных величин. Поэтому данный метод нашел широкое применение в современной энзимологии. Предложены также аналогичные графические способы определения Кm и Vmaxв координатах зависимости v от v/[S] и [S]/v от [S].
Следует отметить некоторые ограничения применения уравнения Ми-хаэлиса–Ментен, обусловленные множественными формами ферментов и аллостерической природой фермента. В этом случае график зависимости начальной скорости реакции от концентрации субстрата (кинетическая
Рис. 4.15. Сигмоидная кинетическая кривая насыщения субстратом.
кривая) имеет не гиперболическую форму, а сигмоидный характер (рис. 4.15) наподобие кривой насыщения гемоглобина кислородом. Это означает, что связывание одной молекулы субстрата в одном каталитическом центре повышает связывание субстрата с другим центром, т.е. имеет место кооперативное взаимодействие, как и в случае присоединения кислорода к 4 субъединицам гемоглобина. Для оценки концентрации субстрата, при которой скорость реакции составляет половину максимальной, в условиях сигмоидного характера кинетической кривой обычно применяют преобразованное уравнение Хилла:
где К’ – константа ассоциации; n – число субстратсвязывающих центров.
Видео:USMLE Step 1 - Фармакология: кинетика ферментов | уравнение Михаелиса - Ментена и не толькоСкачать

Зависимость фермента от количества субстрата описывает ферментативная кинетика
Уравнения Михаэлиса-Ментен и Лайнуивера-Берка
Общую теорию ферментативной кинетики и зависимость активности фермента от субстрата.описали Л.Михаэлис и М.Л.Ментен, выразив его в своем уравнении. Бриггс и Холдейн усовершенствовали их уравнение, введя введя в него константу Михаэлиса (Km), определяемую экспериментально.
Уравнение Михаэлиса-Ментен показывает взаимосвязь максимально возможной скорости, реальной скорости реакции, константы Михаэлиса и концентрации субстрата. Так как пользоваться графиком, построенным в прямых координатах V и [S] для точных расчетов неудобно, то Г.Лайнуивер и Д.Бэрк преобразовали уравнение Бриггса–Холдейна в обратные координаты.
Уравнение Михаэлиса-Ментен
Уравнение Лайнуивера-Бэрка
На самом деле уравнение Михаэлиса-Ментен в данном виде предложили Бриггс и Холдейн, но в честь основоположников оно носит название Михаэлиса-Ментен.
Выделяют три основных решения уравнения Михаэлиса-Ментен:
1. Концентрация субстрата равна величине константы Михаэлиса ([S] = Km).
В этом случае, решая уравнение Михаэлиса-Ментен, получаем, что скорость реакции V будет равна половине максимальной Vmax.(V = ½ Vmax).
В математическом смысле Km соответствует концентрации субстрата при которой скорость реакции равна половине максимальной. Ее биологический смысл заключается в характеристике сродства фермента к субстрату, а именно: увеличение величины Кm означает снижение сродства фермента к субстрату.
2. Концентрация субстрата значительно больше Km ([S] >> Km). В этом случае величиной Km можно пренебречь, при решении получим, что скорость реакции максимальна (плато на графике).
3. Концентрация субстрата значительно меньше Km ([S]
Видео:Кинетика. О чем говорят графики. БиохимияСкачать

Вывод уравнения Михаэлиса-Ментен.
Полный математический анализ ферментативной реакции приводит к сложным уравнениям, не пригодным для практического применения. Наиболее удобной оказалась простая модель, разработанная в 1913 г Михаэлисом и его сотрудницей Ментен. Она объясняет характерную гиперболическую зависимость скорости реакции при постоянной концентрации фермента от концентрации субстрата и позволяет получать константы, которые количественно характеризуют эффективность фермента.
Модель Михаэлиса-Ментенисходит из того, что вначале субстрат (S) обратимо образует с ферментом (E) комплекс (ЕS), который ,быстро превращается в продукт Р, что можно выразить следующей схемой:
Математическая обработка этой системы уравнений с использованием закона действующих масс и уравнения материального баланса позволяет вывести уравнение, названное в честь авторов уравнением Михаэлиса–Ментен, выражающее количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:
Вывод уравнения Михаэлиса-Ментен:
Скорость прямой реакции образования ES — Vпр = K+1[E][S] 1
Скорость обратной реакции — Vобр = К-1[ES] 2
В стационарном состоянии, т.е. когда концентрация ES постоянна скорость прямого процесса равна скорости обратного — Vпр = Vобр или K+1[E][S] = К-1[ES]
[E][S]/[ES] = K-1/K+1 = Кs – константа диссоциации фермент-субстратного комплекса
Из уравнения материального баланса имеем: аналитическая концентрация фермента ([Eобщее]) равна сумме концентраций свободного фермента ([E]) и фермент-субстратного комплекса ([ES]): — [Eобщее] = [E] + [ES] 4
Скорость образования продукта реакции Р равна — Vобр продукта = К+2 [ES] 5
Из уравнения (3) имеем: [ES] = [E][S]/Ks, а из уравнения (4) — [E] = [Eобщ ] – [ES], после
подстановки этого значения в предыдущее уравнение получаем:
После преобразования уравнения (6) относительно [ES] имеем:
Подставляя уравнение (7) в уравнение (5) получаем:
Очевидно, что скорость реакции образования продукта будет максимальной при данных условиях когда [ES] = [Eобщ ], т.е. — K+2 [Eобщ] = Vmax
Вводя это значение в уравнение (8) получаем уравнение в виде:
которое называется уравнением Михаэлиса-Ментен, где:
· v – наблюдаемая скорость реакции при данной концентрации субстрата [S];
· KS– константа диссоциации фермент-субстратного комплекса, моль/л;
· Vmax– максимальная скорость реакции при полном насыщении фермента субстратом.
KS и Vmax – это константы, которые не зависят от концентрации субстрата, а характеризуют свойства фермента.



Следует отметить, что уравнение Михаэлиса–Ментен в его классическом виде было выведено с использованием ряда допущений и, в частности, что образование продукта реакции идет быстро и необратимо. В реальной ферментативной кинетике как раз, как правило, образование продукта реакции процесс обратимый, т.е. более реальная схема ферментативного процесса должна учитывать как минимум 4 константы:
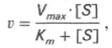
по сути мало отличается от уравнения Михаэлиса-Ментен. Отличие заключается в том, что вместо константы диссоциации фермент-субстратного комплекса Кs = K-1/K+1 в уравнении используется более сложная константа названная позднее константой Михаэлиса Кm. Константа Михаэлиса (Кm) может быть представлена следующим уравнением:
Ферментативная активность. Каталитическая константа — число оборотов фермента. Максимальная скорость ферментативной реакции (Vmax). Константа диссоциации фермент-субстратного комплекса (Ks). Константа Михаэлиса-Ментен (Km).
Особенностью ферментативной кинетики является также то, что экспериментально измеряется не скорость ферментативной реакции, а активность фермента (ферментативная активность). Ранее в лекции №2 уже давалось определение ферментативной активности
Поскольку ферментативная активность не зависит от объема раствора, в котором протекает реакция (она пропорциональна концентрации фермента) ее выражают в специальных единицах: Если размерность скорости реакции – моль/ л·с, то размерность ферментативной активности моль субстрата, превращаемого в единицу времени. Используются следующие единицы активности ферментов:
- Катал. 1 кат = количеству фермента, которое превращает 1 моль субстрата за 1 сек.
- Нкат– нонакатал; 1нкат = 10 9 кат
- Международная единица ферментативой активности (Е) – количество фермента, превращающего 1 мкмоль субстрата в 1 мин.
Удельная активностьвыражается либо 1) количеством единиц (Е или кат, нкат) на 1 мг белка, либо 2) числом молей продукта образовавшегося за 1 минуту на 1 мг белка. Суммарная ферментативная активность определяется как произведение удельной активности на общее количество фермента.
Рассмотрим физический смысл констант уравнения Михаэлиса-Ментен: каталитической константы (К2), максимальной скорости ферментативной реакции (Vmax), константы диссоциации фермент-субстратного комплекса (Ks) и константы Михаэлиса-Ментен (Km).
1. Константа скорости k2 намного выше, чем константа той же, но некаталитической реакции. Константу k2называют каталитической константой скорости ферментативной реакции Ее физический смысл заключается в том, что она соответствует числу молекул субстрата, превращаемых в продукт одной молекулой фермента за 1 сек. В связи с этим каталитическая константа еще называется «числом оборотов фермента».
Число оборотов фермента позволяет характеризовать активность ферментов, молекулярная масса которых известна. Чем больше число оборотов фермента, тем он более активен. В настоящее время около 2000 ферментов выделено в чистом виде и молекулярная масса определена у около 150 ферментов. Самым активным ферментом оказалась карбоангидраза, которая катализирует реакцию гидратации углекислого газа. Для нее число оборотов составляет 600.000 сек -1 . Амилаза, которая катализирует гидролиз крахмала, имеет число оборотов 18.300 сек -1 , число оборотов большей части ферментов определяется трех- или четырехзначным числом. Это свидетельствует о высокой активности ферментов. Если фермент не получен в чистом виде, то его активность определяется количеством молей преобразованного субстрата в одну минуту в расчете на 1 мг белка. Эта величина называется удельной активностью фермента. Очевидно, что чем чище ферментный препарат, тем выше окажется его удельная активность.
2. Максимальная скорость реакции (Vmax) как видно из уравнения равна k+2[Eобщ]. Очевидно, что эта величина является константой для данной реакции, проводимой с данной концентрацией фермента, т.е. эта величина также характеризует активность фермента. Если молекулярная масса фермента известна, то экспериментальное значение максимальной скорости реакции при данной молярной концентрации фермента легко может быть пересчитано в число оборотов.
3. Константа диссоциации фермент-субстратного комплекса (Ks)характеризует устойчивость фермент-субстратного комплекса. Чем меньше значение константы тем стабильнее фермент-субстратный комплекс.
4. Константа Михаэлиса (Кm)характеризуетсродствофермента к субстрату. Высокое сродство фермента к субстрату характеризуется низкой величинойКm и наоборот. Величина Кm всегда численно больше чем величинаKs. Константа Михаэлиса численно равна той концентрации субстрата [S], при которой ν достигает половины максимальной величины Vmax (действительно, если v = Vmax/2, то [S] / (Кm + [S]) = 1/2, отсюда Кm = [S]).
📸 Видео
Биохимия | Кинетика ферментативных реакций: константа Михаэлиса и график Лайнуивера-БеркаСкачать

Уравнение Михаэлиса-МентенСкачать

Биохимия: Константа Михаэлиса #биохимияСкачать

Разбираем Michaelis-Menten and Lineweaver-Burk plots.Скачать
ФЕРМЕНТАТИВНАЯ КИНЕТИКА: Занятие 1. Вывод уравнения Михаэлиса-МентенСкачать

Асеев В. В. - Основы энзимологии - Ферментативная кинетика Уравнение Михаэлиса-МентенСкачать
Химическое равновесие. Константа равновесия. 10 класс.Скачать

ФЕРМЕНТЫ 5.Основы ферментативного катализа. Кинетика ферментативных реакций.Скачать

Биохимия. Лекция 22. Ферменты. Part 2.Скачать

Ферментативная кинетикаСкачать

Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Лекция 11.11.20 | Схема Михаэлиса-Ментен (завершение), гетерогенный катализ | Химическая кинетикаСкачать

Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Асеев В. В. - Основы энзимологии - Кинетика ферментативных реакцийСкачать

Лекция 28.10.20 | Параллельные реакции, катализ, схема Михаэлиса-Ментен | Химическая кинетикаСкачать

Гладилин А.К. - Введение в специальность - 10. Ферментативная кинетикаСкачать

Лекция 4 Ферменты Кинетика, ингибирование, изоферментыСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать