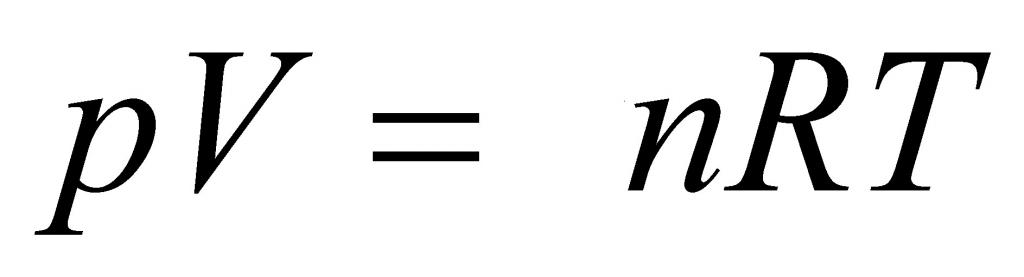Из уравнений (1.8.1) и (1.8.7) следует, что
Учитывая, что n = N/V и N/NА = m/μ = ν, получим

где введена постоянная R=kNA=8,31Дж/мольּК, которую называют универсальной газовой постоянной. Физический смысл ее установим из уравнения (1.9.2):

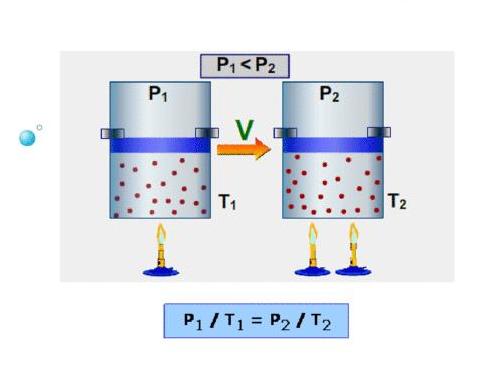
которое называют уравнением Менделеева – Клапейрона. Для этого запишем уравнение (1.9.3) для двух состояний изобарического процесса:
 |
Откуда находим

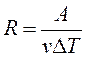
т. е. постоянная R численно равна работе при изобарическом нагревании на один Кельвин (ΔТ = 1К) одного моля (ν = 1моль) идеального газа. Так как k = R/NA, то постоянная Больцмана имеет тот же смысл, что и R, только рассчитанная на одну молекулу.
Из уравнения состояния идеального газа (1.9.3) можно получить известные из опыта газовые законы.
1. Полагая в уравнении (1.9.3) ν = const и Т = const, получаем
Отсюда вытекает формулировка закона Бойля – Мариотта (изотермический процесс): при неизменных массе и температуре идеального газа произведение его объема на давление есть величина постоянная.
2. При изобарическом процессе P = const.Также ν = сonst. Поэтому из уравнения состояния (1.9.3) в этом случае

т. е. при неизменных массе и давлении идеального газа отношение объема, занимаемого газом, к его температуре – величина постоянная. Это утверждение известно как закон Гей-Люссака.
3. Пусть процесс протекает при постоянном объеме V=const (по
прежнему ν = сonst). Тогда из (1.9.3)

т. е. при неизменных массе и объеме идеального газа отношение давления газа к его температуре есть величина постоянная. Уравнение (1.9.8), называемое уравнением изохорического процесса, выражает известный закон Шарля.
4. Из уравнения (1.9.3), очевидно, также следует объединенный закон
Мариотта – Гей- Люссака

т. е. произведение давления газа на его объем, деленные на абсолютную температуру, для данной массы газа есть величина постоянная.
5. Из уравнения (1.9.3) также следует закон Авогадро, согласно которому при одинаковых давлениях и температурах в равных объемах любого газа содержится одинаковое число молекул. Действительно, пусть имеются два одинаковых объема двух различных газов при одинаковых давлениях и температурах. Для каждого из них можно написать уравнение состояния (1.9.2)
где N1 и N2 – число молекул обоих газов. Из этих равенств непосредственно следует, что N1= N2. Это и есть закон Авогадро. Из него, очевидно, следует и обратная формулировка: различные газы, но содержащие одинаковое число молекул, будут при одинаковых давлениях и температурах занимать одинаковые объемы. Поэтому моль любого газа при данных давлении и температуре занимает одинаковый объем. В частности, при нормальных условиях (Т0= 273,15К, Ратм= 1,01ּ10 5 -Па) моль любого газа занимает объем

6. Следствием уравнения идеального газа является и закон Дальтона, утверждающий: давление смеси химически не реагирующих газов равно сумме парциальных давлений отдельных газов. Парциальным давлением называют давление, которое создал бы газ, если бы он находился один в объеме, занятом смесью.
Для доказательства закона Дальтона учтем, что в смеси нескольких газов общее количество молекул равно сумме количеств молекул отдельных газов
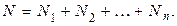
Подставим (1.9.10) в (1.9.3)

Каждое из слагаемых выражения (1.9.11) представляет собой парциальное давление. Поэтому

Что и требовалось доказать.
7. Наконец, следствием уравнения Менделеева – Клайперона является закон Амага: объем смеси химически нереагирующих идеальных газов равен сумме их парциальных объемов, т. е.

где парциальный объем

Как видно из выражения (1.9.14), парциальный объем Vi есть объем, который занимал бы i-й газ, если бы все остальные газы были удалены, а давление Р и температура Т остались неизменными.
Для доказательства найдем из уравнения (1.9.2) идеального газа объем смеси

и подставим в него вместо N его выражение из (1.9.15). В результате получим
что и доказывает справедливость закона Амага.
1. Доказать, что молекулы любых газов при одинаковых температурах обладают одинаковой средней кинетической энергией поступательного движения.
Решение. Выражение (1.5.9): 




Если температуры этих газов одинаковы, то
где
Как видно из доказательства, средняя кинетическая энергия поступательного движения не зависит от массы и внутренней структуры молекулы. Поэтому ее выбирают в качестве меры нагретости
Следует обратить внимание на тот факт, что средние кинетические энергии вращательного и колебательного движений молекулы не могут быть взяты за меру температуры газа, так как эти энергии зависят не только от температуры, но и от параметров, характеризующих структуру молекулы – ее момента инерции и частот колебаний атомов в молекуле.
2. Земная атмосфера состоит из смеси различных газов, которые на уровне моря по объему составляют (при нормальных условиях): азот – 78,09 %, кислород – 20,95 %, аргон – 0,93 %, углекислый газ – 0,03 %, неон – 0,0018 %. Остальными компонентами (водород, гелий, ксенон, криптон, метан и др.) пренебрегают, так как они составляют миллионные доли процента. Найти молярную массу воздуха.
Решение. Пусть взято количество воздуха массы 

Выражая отношения масс через отношение плотностей и объемов 
где 
V4/V = 0,0003, V5/V = 0,000018, а также, взятые из таблиц, опытные значения (при нормальных условиях) плотностей азота ρ1= 1,250 кг/м 3 , кислорода
ρ2= 1,429 кг/м 3 , аргона ρ3= 1,784 кг/м 3 , углекислого газа ρ4= 1,977 кг/м 3 , неона ρ5= 0,900 кг/м 3 воздуха ρ=1,293 кг/м 3 и молярные массы компонентов воздуха μ1= 28·10 – 3 кг/моль,μ2= 32·10 – 3 кг/моль, μ3= 40·10 – 3 кг/моль,μ4=
= 44·10 – 3 кг/моль, μ5= 20·10 – 3 кг/моль,получим молярную массу воздуха μ =
= 0,02896 ≈ 29·10 – 3 кг/моль.
Распределение Максвелла
В газе, находящемся в равновесии при температуре T, скорость любой молекулы из-за столкновений непрерывно меняется как по абсолютной величине, так и по направлению. Распределение по направлениям движения в состоянии равновесия равновероятно. Если бы это было не так, то в каком-то направлении в газе двигалось бы большее число молекул, чем в другом. В результате возник бы макроскопический поток газа и газ не находился бы в равновесии.
Иначе обстоит дело с абсолютными значениями скоростей молекул: они не будут равновероятны, т. е. функция плотности вероятности F(υ) принимает неодинаковые значения при различных скоростях молекул. При этом, наибольшее число молекул будет группироваться около некоторой средней скорости, к примеру, около средней квадратичной υкв, которая на основании формулы (1.8.7),

Очень большие скорости молекул, по сравнению со средней квадратичной, маловероятны. В самом деле, чтобы молекула могла приобрести при столкновениях очень большую скорость, ей необходимо испытать подряд много таких столкновений, при которых она в основном получает энергию, и почти ни одного столкновения, при котором она ее теряет. Но такие столкновения маловероятны. Поэтому значения функции F(υ) при больших скоростях должны быть малы.
Функция F(υ) в равновесном состоянии газа не должна зависеть от времени. В самом деле, если бы функция распределения зависела от времени, то средняя квадратичная скорость, определяемая по формуле,

также зависела бы от времени. Но это противоречит тому, что в состоянии равновесия (T = const), как видно из (1.10.1), υкв= сonst.
Таким образом, распределение молекул по скоростям должно иметь максимум около среднего квадратичного значения скорости и убывать до нуля от этого максимального значения в сторону больших скоростей молекул. Найдем, следуя Максвеллу, явный вид этой функции.
Спроектируем скорости всех N молекул газа на ось x. Вероятность того, что произвольно взятая молекула имеет проекцию скорости, заключенную в интервале (υx , υx+ dυx), будет равна
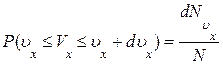
где 

Сравнивая выражения (1.10.2) и (1.10.3) , находим

Аналогичные соотношения могут быть записаны для проекций скоростей молекул на оси Y и Z.
Важно отметить, что функции 


Запишем далее вероятность того, что случайно взятая молекула имеет проекции скорости, заключенные в интервалах (υx, υx + dυx), (υy, υy + dυy) и (υz, υz + dυz) или, то же самое, что эта молекула движется в направлении, близком к направлению, определяемом вектором 

где 


Из выражений (1.10.5) и (1.10.6) следует, что

Чтобы дать наглядное представление о функции 




Функция 


где 
Наряду с введенными функциями φ и f, рассмотрим распределение молекул F(υ) по абсолютной величине скорости. Распределение F(υ)определяется вероятностью того, что величина скорости молекулы заключена в пределах от υ до υ + dυ независимо от направления, т. е.

где 
Функции F(υ) и f(υ) жестко связаны друг с другом. Для определения этой связи обратимся к пространству скоростей. Очевидно, в этом пространстве число скоростных точек, попадающих в шаровой слой между сферами радиусов υ и υ+dυ, объем которого 


Подставив 

Далее Максвелл предположил, что события, заключающиеся в попадании проекций υx, υy, υz скорости данной молекулы в интервалы
(υx, υx + dυx), (υy, υy + dυy) и (υz, υz + dυz)соответственно, являются независимыми событиями. Тогда, согласно теореме умножения, совместная вероятность этих событий равна произведению их вероятностей, т. е.

На основании формул (1.10.6) и (1.10.3), равенство (1.10.11) можем переписать в виде:

Разделив обе части (1.10.12) на 


Прологарифмируем последнее равенство

Дифференцируя выражение (1.10.14) на компоненте скорости υx , получим

Учитывая, что 

Это позволяет записать соотношение (1.10.15) в виде

Аналогичные выражения могут быть получены при дифференцировании (1.10.14) по двум другим компонентам скорости υy и υz:

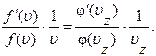
Правые части этих равенств равны друг другу, так как левые части их одинаковы. Правая часть (1.10.17) не зависит от υy и υz. Значит, от них не зависит и левая часть. Аналогично, правая часть (1.10.18) не зависит от υx и υz, откуда следует независимость и левой части от этих величин. Но тогда и правая часть (1.10.17) не зависит от υх. Это возможно только в том случае, если

Умножим обе части (1.10.20) на υхdυх. В результате будем иметь




Из-за равной вероятности направлений движения молекул точно такой же вид имеют функции 



Второе уравнение – это связь средней кинетической энергии поступательного движения молекулы с температурой:

Как было выяснено ранее, очень большие скорости молекул должны быть маловероятными. Это возможно только в том случае, если постоянная в формуле (1.10.24) отрицательна, т. е.

В выражении (1.10.25) максимально возможная проекция на ось Х скорости молекул, находящихся при температуре T, положена равной бесконечности, что физически нереально. Однако увеличение интервала интегрирования сверх некоторой максимальной скорости не приведет к заметной ошибке ввиду того, что функция (1.10.27) быстро убывающая.
Подставляя (1.10.27) в (1.10.25) и интегрируя (см. формулу (B.2) приложения B), получим

Откуда находим 

Чтобы воспользоваться равенством (1.10.26) для нахождения постоянной С1учтем, что

так как ввиду равновероятности направлений движения молекул 



Используя формулы (1.10.31), (1.10.30) и (1.10.26), находим

Подстановка постоянной (1.10.32) в (1.10.29) дает

Точно такие же формулы будут справедливы и для других проекций скорости молекул. Поэтому функция (1.10.13)

а функция распределения по абсолютным значениям скорости (1.10.10)

Как это мы уже отмечали при выводе распределений (1.10.33–1.10.35) по скоростям, Максвеллом было сделано предположение: проекции скорости молекул статистически независимы. Это предположение им не было доказано или обосновано. В дальнейшем американским физиком-теоретиком Д. Гиббсом было доказано, что условие независимости компонент скорости имеет место тогда, когда кинетическая энергия квадратична по компонентам импульсов; последнее справедливо всегда, за исключением случая релятивистских скоростей частиц.
Очень важно отметить, что при доказательстве распределения Максвелла (1.10.33–1.10.35) не делалось никаких предположений относительно структуры молекул, сил взаимодействия между ними, поэтому они справедливы не только для газов, но и для жидкостей, для твердых тел и, даже, для броуновских частиц, если при этом возможно классическое описание.
Как доказывается в статистической физике, классический способ изложения применим, если температура Т равновесного состояния системы частиц значительно больше так называемой температуры вырождения

где h и k – постоянные Планка и Больцмана, m0 – масса частицы, n – концентрация частиц.
Систему частиц, находящуюся при температуре T 3 огромно и имеет порядок 10 29 Z, где Z – валентность металла. Вычисления по формуле (1.10.36) дают TB
10 4 K. Поэтому при условиях близким к нормальным электронный газ в металлах является вырожденным и к нему неприменима статистика Максвелла. Она, как доказывается в квантовой физике, должна быть заменена на статистику Ферми – Дирака.
Однако электроны, эмитируемые с раскаленного металла в вакуум, образуют электронный газ, скорости частиц которого уже будут распределены по закону Максвелла, т. к. их концентрация n значительно меньше, чем в металле, и соотношение (1.10.36) будет выполнено.
В качестве второго примера рассмотрим водород, который при нормальных условиях имеет концентрацию n0=2,7·10 25 м –3 . Вычисления по формуле (1.10.36) дают TB = 0,06 K. Так как все газы при нормальных условиях имеют одну и ту же концентрацию n0=2,7·10 25 м –3 , а массу молекул большую, чем масса молекулы водорода, то условие (1.10.36) будет выполнено и, таким образом, ко всем газам применима статистика Максвелла. Более того, непосредственным расчетом нетрудно показать, что к некоторым газам (углекислый газ, воздух, азот и др.), находящимся при низких температурах Т в жидком или твердом состоянии, распределения скоростей поступательного движения молекул, определяемые формулами (1.10.33–1.10.35), можно применять, т. е. в этом случае условие (1.10.36) будет выполнено.
- Уравнение Клапейрона-Менделеева
- Что такое уравнение Клапейрона-Менделеева
- Какое значение имеет универсальная газовая постоянная
- Связь с другими законами состояния идеального газа
- Изотермический процесс (T=const)
- Изохорный процесс (V=const)
- Изобарный процесс (p=const)
- Использование универсального уравнения для решения задачи
- Закон Клапейрона-Менделеева для идеального газа: исторические предпосылки, формула, пример задачи
- Концепция идеального газа
- Предпосылки возникновения уравнения состояния идеального газа
- Формула закона Клапейрона-Менделеева
- Откуда выводится изучаемое уравнение?
- Использование универсального уравнения для решения задачи
- 💥 Видео
Видео:Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

Уравнение Клапейрона-Менделеева
Видео:Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать

Что такое уравнение Клапейрона-Менделеева
Идеальный газ — это газ, в котором пренебрегают взаимодействием молекул газа между собой.
Идеальными считают разреженные газы. Особенно близкими к идеальным считают гелий и водород.
Идеальный газ — это упрощенная математическая модель, которая широко применяется для описания свойств и поведения реальных газов при атмосферном давлении и комнатной температуре.
Давление, объем и температура — это основные параметры состояния системы, и они связаны друг с другом. Соотношение, при котором определяется данная связь, называется уравнением состояния данного газа.
Существует эквивалентная макроскопическая формулировка идеального газа — это такой газ, который одновременно будет подчиняться закону Бойля-Мариотта и Гей-Люссака, то есть:
p V = c o n s t * T
В представленном выше уравнении состоянии газа под const подразумевается количество молей.
Свойства классического и квазиклассического идеального газа описываются уравнением состояния идеального газа, которое называется уравнением Менделеева-Клапейрона, ниже представлена формула Менделеева-Клапейрона.
p V = m M R T = n R T , где m — масса газа, M — молярная масса газа, R = 8 , 314 Д ж / ( м о л ь * К ) — универсальная газовая постоянная, T — температура (К), n — количество молей газа.
Таким образом давление и объем прямо пропорциональны количеству молей и температуре.
Также уравнение Клапейрона-Менделеева можно записать в ином виде:
p V = N k T , где N — это количество молекул газа массой m , k = 1 , 38 * 10 — 23 Д ж / К — постоянная Больцмана, которая определяет «долю» газовой постоянной, приходящуюся на одну молекулу и определяется по формуле:
N = m N A M , где
N A = 6 . 02 * 10 23 м о л ь — 1 ; — это постоянная Авогадро.
Видео:Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Какое значение имеет универсальная газовая постоянная
Универсальная газовая постоянная (R) — это величина, которая является константой, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 K.
Значение данной константы находится как произведение постоянной Больцмана ( k = 1 , 38 * 10 — 23 Д ж / К ) на число Авогадро ( N A = 6 . 02 * 10 23 м о л ь — 1 ) . Таким образом универсальная газовая постоянная принимает следующее значение: R = 8 , 314 Д ж / ( м о л ь * К ) .
Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения, тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Связь с другими законами состояния идеального газа
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса и один трех макропараметров (давление, температура или объем) — остаются неизменными.
Количественные зависимости между двумя параметрами газа при фиксированном третьем параметре называют газовыми законами, которые связывают эти параметры.
Изопроцессы — это термодинамические процессы, во время протекания которых количество вещества и один из макропараметров состояния: давление, объем, температура или энтропия — остается неизменным.
В зависимости от того, какой параметр остается неизменным различают разные процессы, которые выражаются законами, являющимися следствием уравнения состояния газа:
- изотермический процесс (T=const);
- изохорный процесс (V=const);
- изобарный процесс (p=const).
Изотермический процесс (T=const)
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой — термостатом. Им может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса.
Согласно уравнению Клапейрона-Менделеева, в любом состоянии с неизменной температурой произведение давления газа на объем одно и то же, то есть постоянно:
Этот закон был открыт экспериментально английским ученым Бойлем и несколько позднее французским ученым Мариоттом. Именно поэтому он называется закон Бойля-Мариотта.
Закон Бойля-Мариотта справедлив для любых газов, а также для смеси газов (например, для воздуха).
Зависимость давления газа от объема при постоянной температуре изображается графической кривой — изотермой. Изотерма для различных температур представлена в координатах pV на рис.1. и представляет собой гиперболу.
Рис.1. Изотерма в pV — координатах.
Изохорный процесс (V=const)
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Из уравнения состояния следует, что отношение давлений газа данной массы при постоянно объеме равно отношению его абсолютных температур:
p 1 p 2 = T 1 T 2
Газовый закон был установлен экспериментально в 1787 г. французским физиком Ж. Шарлем и носит название закона Шарля: давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре.
Так, если в качестве одного из состояний газа выбрать состояние газа при нормальных условиях, тогда
p = p 0 T T 0 = p 0 γ T
Коэффициент γ называют температурным коэффициентом давления газа. Он одинаков для всех газов.
Зависимость давления газа от температуры при постоянном объеме изображается графически прямой, которая называется изохорой (Рис.2).
Рис.2 Изображение изохоры в pT-координатах.
Изобарный процесс (p=const)
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Из уравнения Клапейрона-Менделеева вытекает, что отношение объемов газа данной массы при постоянном давлении равно отношению его абсолютных температур.
V 1 V 2 = T 1 T 2
Если в качестве второго состояния газа выбрать состояние при нормальных условиях (нормальном атмосферном давлении, температуре таяния льда) следует:
V = V 0 T T 0 = V 0 α T
Этот газовый закон был установлен экспериментально в 1802 г французским ученым Гей-Люссаком.
Закон Гей-Люссака: объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре.
Коэффициент α называют температурным коэффициентом объемного расширения газов.
Зависимость объема газа от температуры при постоянном давлении изображается графической прямой, которая называется изобарой (Рис.3).
Рис. 3. Изобара в VT-координатах.
Видео:Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Использование универсального уравнения для решения задачи
В реальности проводятся различные физико-химические процессы. Рассмотрим каким образом уравнение состояния идеального газа и законы, связанные с ним находят применение для решения физических и химических задач.
Определить давление кислорода в баллоне объемом 1 м 3 при температуре t = 27 C o . Масса кислорода 1 кг.
Так как в уравнении даны объем и температура — два из трех макроскопических параметров, а третий (давление) нужно определить, то мы можем использовать уравнение Клапейрона-Менделеева:
p V = n R T = m M R T
Не забываем перевести температуру в Кельвины:
T = t + 273 = 27 + 273 = 300 K
Молярная масса кислорода известна из таблицы Менделеева:
M ( O 2 ) = 2 * 16 = 32 г / м о л ь = 32 * 10 — 3 к г / м о л ь
Выразим из уравнения состояния давления и поставим все имеющиеся данные:
p = n R T V = m R T M V = 1 * 8 . 31 * 300 32 * 10 — 3 * 1 = 77 . 906 П а = 78 к П а
Ответ: p = 78 кПа.
Каким может быть наименьший объем баллона, содержащего кислород массой 6,4 кг, если его стенки при t = 20 C o выдерживают p = 1568 Н / с м 2 ?
Используем уравнение Менделеева-Клапейрона, из которого выражаем объем кислорода, который нужно найти:
p = n R T V = m R T M V
Молярная масса кислорода предполагается равной:
M ( O 2 ) = 2 * 16 = 32 г / м 3
Не забываем перевести температуру в Кельвины:
T = t + 273 = 20 + 273 = 293 K
Переводим давление: p = 15680000 Па
Выражаем из уравнения Клапейрона-Менделеева объем и подставляем значения, данные в условиях задачи:
V = n R T p = m R T M p = 6 . 4 * 8 . 31 * 293 15680000 * 32 * 10 — 3 = 3 . 1 * 10 — 2 м 3 = 31 л .
Используя уравнение состояния идеального газа, доказать, что плотность любого газа равна половине плотности водорода ( ρ Н 2 ) , взятого при тех же условиях, умноженной на относительную молекулярную массу этого газа M_r, то есть ρ = ρ Н 2 * M r 2 .
Согласно уравнению Менделеева-Клапейрона:
p = n R T V = m R T M V
Плотность — это величина, характеризующая массу некоторого объема и находится по формуле:
ρ = m V и л и V = m ρ
Тогда p m ρ = n R T = m R T M
Откуда выражаем плотность газа:
Для водорода эта формула запишется следующим образом:
ρ H 2 = p M H 2 R T
По условию задачи водород и любой другой газ находятся при одинаковых условиях, откуда следует, что:
ρ H 2 M H 2 = p R T
Поставим последнее выражение в выражение для плотности любого газа:
ρ = M * ρ H 2 M H 2
Молярная масса водорода, исходя из таблицы Менделеева равна 2 г/моль и тогда. Молекулярная масса численно равная молярной и представляет собой массу молекулы в атомных единицах, поэтому в дальнейшем мы совершили переход к молекулярной массе.
ρ = M r * ρ H 2 2
Вывод: плотность любого газа равна половине плотности водорода ( ρ Н 2 ) , взятого при тех же условиях, умноженной на относительную молекулярную массу этого газа M_r, то есть ρ = ρ Н 2 * M r 2 .
Рассмотрим несколько задач на законы, связанные с уравнение Клапейрона-Менделеева, то есть на изотермические, изохорные, изобарные процессы.
При уменьшении давления газа в 2,5 раза его объем увеличился на 12 л. Какой объем занимал газ в начальном состоянии, если температура на протяжении всего процесса оставалась постоянной?
По условию задачи температура в ходе всего процесса оставалась постоянной, откуда следует, что у нас изотермический процесс, и мы можем воспользоваться для решения законом Бойля-Мариотта.
p 1 V 1 = p 2 V 2 , г д е p 1 – давление газа в начальном состоянии (до расширения), V 1 — объем газа в начальном состоянии, p 2 = p 1 2 . 5 — давление газа в конечном состоянии (после расширения), V 2 = V 1 + ∆ V — объем газа в конечном состоянии.
Откуда можем найти начальный объем:
p 1 V 1 = p 1 2 . 5 ( V 1 + ∆ V ) = p 1 2 . 5 V 1 + p 1 2 . 5 ∆ V
V 1 ( p 1 — p 1 2 . 5 ) = p 1 2 . 5 ∆ V
p 1 2 . 5 V 1 ( 2 . 5 — 1 ) = p 1 2 . 5 ∆ V
V 1 = ∆ V 1 , 5 = 8 л
Ответ: первоначальный объем газа был равен 8 л.
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Так как нагревание газа по условиям данной задачи происходит при постоянном объеме, значит перед нами изохорный процесс.
При изохорном процессе:
p 1 T 1 = p 2 T 2
T 2 = p 2 T 1 p 1
p 2 p 1 = 1 . 5 T 2 = 1 . 5 * T 1 = 1 . 5 * 400 = 600 K
При 27°C объем газа равен 600 мл. Какой объем займет газ при 57°C, если давление будет оставаться постоянным?
Так как давление по условию остается постоянным, то можем использовать закон Гей-Люссака.
V 1 V 2 = T 1 T 2
V_2 – искомый объем
Для правильного расчета необходимо перевести температуры из Цельсий в Кельвины:
T 1 = 273 + 27 = 300 K
T 2 = 273 + 57 = 330 K
T 2 V 1 T 1 = V 2
V 2 = ( 600 * 330 ) / 300 = 660 м л
Газ в трубе плавильной печи охлаждается от температуры t 1 = 1150 ° С д о t 2 = 200 ° С . Во сколько раз увеличивается плотность газа при этом? Давление газа не меняется.
Так как по условию задания давления газа не изменяется, значит перед нами изобарный процесс. Для решения воспользуемся законом Гей-Люссака:
V 1 V 2 = T 1 T 2
Перейдем к абсолютной температуре:
T 1 = 1150 + 273 = 1423 K
T 2 = 200 + 273 = 473 K
Масса газа: m = ρ 1 V 1 = ρ 2 V 2
Использование этих формул приводит к следующему:
Видео:Успеть за 300 секунд, #3: Уравнение Клапейрона-МенделееваСкачать

Закон Клапейрона-Менделеева для идеального газа: исторические предпосылки, формула, пример задачи
Рассмотрение свойств газов в физике в первом приближении основывается на концепции идеального газа. В данной статье подробно изучим эту концепцию и приведем уравнение, которое описывает численно термодинамические свойства упомянутой текучей субстанции. Это уравнение называется законом Клапейрона-Менделеева.
Видео:Уравнение Менделеева - Клапейрона за 10 минут | Физика с Никитой АрхиповымСкачать

Концепция идеального газа
В школьном курсе физики газовое агрегатное состояние вещества характеризуется произвольным перемещением с различными скоростями всех составляющих его атомов и молекул. Эти частицы считаются в первом приближении абсолютно упругими материальными точками. Они имеют массу, но не размеры. Весь характер их взаимодействия друг с другом заключается в абсолютно упругих столкновениях, в результате которых сохраняется количество движения и энергия. Все перечисленные свойства частиц и их приближения образуют концепцию идеального газа.
Любой реальный газ, будь то гелий, кислород или воздух, можно с высокой точностью считать идеальным, если его давление составляет порядка одной атмосферы и ниже, а температура соответствует комнатной или выше. Если эти условия не выполняются, то газ считается реальным, и для его описания следует использовать уравнение Ван-дер-Ваальса, а не закон Клапейрона-Менделеева, о котором пойдет речь далее в статье.
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Предпосылки возникновения уравнения состояния идеального газа
Под уравнением состояния газа идеального принято понимать математическую формулировку газового закона Менделеева-Клапейрона. Как и любое открытие в физике, это уравнение не появилось из неоткуда, а имело вполне определенные исторические предпосылки.
В 60-70-е годы XVII века англичанин Роберт Бойль и француз Эдм Мариотт независимо друг от друга в результате многих проведенных экспериментов с различными газами установили, что произведение объема на давление для закрытой системы с газом остается постоянным для любых процессов, в результате которых температура не изменяется. В настоящее время этот газовый закон носит фамилии названных ученых.
Спустя почти 1,5 века, в конце XVIII — начале XIX веков французы Шарль и Гей Люссак открывают еще два экспериментальных закона в поведении идеальных газов. Они устанавливают прямо пропорциональную зависимость между давлением и температурой при постоянном объеме и между объемом и температурой при постоянном давлении.
Наконец, в 1834 году Эмиль Клапейрон вывел, анализируя открытые предыдущими учеными газовые законы, уравнение Клапейрона. Менделеева фамилия появилась в названии этого уравнения благодаря его вкладу в преобразование исходного выражения к современному виду. В частности, Менделеев ввел понятие универсальной газовой постоянной.
Видео:Урок 2.Уравнение Менделеева-Клапейрона. Решение задач. База. ЕГЭСкачать

Формула закона Клапейрона-Менделеева
Выше мы дали определение идеального газа, рассказали о законах, которые привели к формулировке универсального уравнения состояния. Теперь пришло время записать это уравнение:
Здесь P, V, n и T — давление, объем, количество вещества и температура, соответственно. Таким образом, произведение объема системы на давление в ней всегда находится для идеального газа в прямой пропорциональности произведению абсолютной температуры на количество вещества.
Коэффициентом пропорциональности является уже упомянутая универсальная постоянная R. Она равна 8,314 Дж/(моль*К). Если 1 моль газа нагреть на 1 кельвин, то в процессе расширения он совершит работу 8,314 Джоуля. Любопытно заметить, что универсальной величина R называется потому, что она не определяется химической природой газа. Для всех чистых газов и их смесей она принимает единственное значение.
Видео:62. Уравнение Клапейрона-МенделееваСкачать

Откуда выводится изучаемое уравнение?
Выше мы уже сказали, что Клапейрон свое уравнение получил в результате банального обобщения экспериментальных результатов различных ученых. Тем не менее, закон Клапейрона-Менделеева может быть получен чисто теоретическими методами.
Одним из них является МКТ (молекулярно-кинетическая теория). МКТ рассматривает газовую систему с точки зрения концентрации частиц, распределения их скоростей, учета их масс и следование концепции идеального газа. Универсальное уравнение газа однозначно следует, если применить второй закон Ньютона к процессу упругого соударения частиц со стенками герметичного сосуда. В результате применения МКТ получается выражение:
Это равенство приводит к записанному в предыдущем пункте уравнению, если учесть следующие выражения:
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Использование универсального уравнения для решения задачи
Известно, что некоторый газ под давление 2 атмосферы находится в баллоне при температуре 25 o C. Объем баллона составляет 50 литров. Какое количество вещества содержится в баллоне?
Поскольку нам известны 3 из 4-х параметров, то можно применить закон Клапейрона-Менделеева, чтобы найти величину n. Прежде чем это сделать, переведем все единицы в систему СИ:
T = 25 + 273,15 = 298,15 К;
Теперь воспользуемся формулой, получим:
n = P*V/(R*T) = 202650*0,05/(8,314*298,15) = 4,09 моль.
Хотя само значение 4,09 моль является небольшим, количество частиц газа будет гигантским. Чтобы его получить, следует n умножить на NA=6,02*10 23 .
💥 Видео
Решение графических задач на тему Газовые законыСкачать

Газовые законы. Изопроцессы | Физика 10 класс #34 | ИнфоурокСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Уравнение Менделеева-Клапейрона.Все виды задач на ЕГЭ.52 задачиСкачать

Урок 158. Задачи на газовые законы - 1Скачать

Успеть за 300 секунд, #5: Закон Авогадро и его следствияСкачать

Задачи на уравнение Менделеева-Клапейрона. Ч.2. Решение задач.Скачать

Уравнение состояния идеального газаСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать