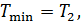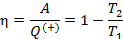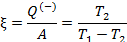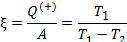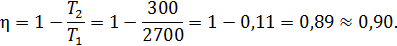| Теплоёмкость идеального газа. Уравнение Майера |   |
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус:
Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости. Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К. Для газов удобно пользоваться молярной теплоемкостью Cμ— количество теплоты, необходимое для нагревания 1 моля газа на 1 градус:
Из п. 1.2 известно, что молярная масса – масса одного моля:
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV. СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2). Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния. Величины СР и СV оказываются связанными простыми соотношениями. Найдём их. Пусть мы нагреваем один моль идеального газа при постоянном объёме(dA = 0). Тогда первое начало термодинамики запишем в виде:
Теплоемкость при постоянном объёме будет равна:
Из (4.2.4) следует, что
Для произвольной идеальной массы газа:
При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом:
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе. Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж. Полезно знать формулу Майера для удельных теплоёмкостей: Содержание Видео:Термодинамика | уравнение МайераСкачать  Вывод формулы• Воспользовавшись записью первого начала термодинамики в дифференциальной форме (9.2), получим выражение для теплоёмкости произвольного процесса: • Представим полный дифференциал внутренней энергии через частные производные по параметрам После чего формулу (9.6) перепишем в виде Соотношение (9.7) имеет самостоятельное значение, поскольку определяет теплоёмкость • Рассмотрим процесс при постоянном давлении Исходя из полученной формулы, можно легко найти связь между теплоемкостями Уравнение Роберта Майера Выразим частные производные в правой части уравнения (9.8), с помощью термического и калорического уравнений, записанных для одного моля идеального газа. Внутренняя энергия идеального газа зависит только от температуры и не зависит от объёма газа, следовательно Из термического уравнения легко получить Подставим (9.9) и (9.10) в (9.8), тогда Вы, надеюсь, узнали (9.11). Да, конечно, это уравнение Майера. Еще раз напомним, что уравнение Майера справедливо только для идеального газа. 9.3. Политропические процессы в идеальном газе Как отмечалось выше первое начало термодинамики можно использовать для вывода уравнений процессов, происходящих в газе. Большое практическое применение находит класс процессов, называемых политропическими. Политропическим называется процесс, проходящий при постоянной теплоемкости Уравнение процесса задается функциональной связью двух макроскопических параметров, описывающих систему. На соответствующей координатной плоскости Вывод уравнения политропического процесса в идеальном газе • Требование постоянства теплоёмкости • Используя уравнение Майера (9.11) и уравнение состояния идеального газа, получаем следующее выражение для • Разделив уравнение (9.12) на T и подставив в него (9.13) придем к выражению • Разделив ( • Интегрированием (9.15), получаем Это уравнение политропы в переменных Исключая из уравнения ( Параметр К этому классу процессов относится также адиабатный или адиабатический процесс. Адиабатным называется процесс, проходящий без теплообмена ( Из определения теплоемкости следует, что в адиабатическом процессе где В этом случае уравнение политропы принимает вид Уравнение адиабатного процесса (9.20) называют также уравнением Пуассона, поэтому параметр Графики политропических процессов для различных значений На рис. 9.1 графики процессов пронумерованы в соответствии с табл. 9.1.
Знание показателя политропы Тогда, бесконечно малое количество теплоты, сообщённое макросистеме в политропическом процессе равно Соответственно полное количество теплоты, полученное системой при изменении её температуры от Зная Таким образом, мы можем получить исчерпывающую информацию об энергообмене системы с окружающей средой. Теперь уместно поставить следующие вопросы. Что делать, если процесс не политропический? Можно ли глядя на график процесса, догадаться, что это не политропа? Иногда можно. Взгляните на рис. 9.2. Это уж точно не политропы. Для подобных процессов количество теплоты рассчитать не так просто как в случае политропных процессов Полное количество теплоты, полученное системой в произвольном процессе, можно рассчитать только интегрированием Вычисление теплоемкости и количества теплоты в различных процессах является внутренней подзадачей многих учебных задач, с которыми вы встретитесь при изучении термодинамики. 9.4. Тепловые машины и их эффективность. Циклические процессы являются основой действия тепловых машин. В используемых на практике разнообразных тепловых машинах реализованы различные виды термодинамических циклов. Тепловыми машинами являются двигатели внутреннего сгорания, реактивные двигатели, холодильники, кондиционеры, тепловые насосы, паровые турбины и т. д.
Работа расширения Действительно, проинтегрировав по циклу равенство, выражающее первое начало термодинамики, получим важный результат: из которого следует, что работа равна количеству теплоты, полученной системой за цикл Теплота в каких-то частях цикла поступает в систему ( Определить поступает в систему количество теплоты или оно теряется иногда можно только расчётом, но зачастую это видно на графике процесса: • Если температура • Если температура Принципиальная схема работы тепловой машины Схематически работа машин по прямому и обращенному циклу представлена на рис. 9.4 и 9.5. Любая машина должна включать в себя нагреватель с температурой Принцип работы двигателя: в процессе работы машина получает количество теплоты от нагревателя, часть которого идёт на совершение полезной работы (приводится в действие какой-либо силовой агрегат), а часть отдаётся холодному резервуару. Принцип работы холодильной машины: для того, чтобы отобрать количество теплоты от холодильника и передать его нагревателю, необходимо затратить некоторое количество энергии на совершение механической работы над рабочим веществом машины. Показатели эффективности тепловых машин Эффективность двигателя характеризуется коэффициентом полезного действия η (КПД). Эффективность холодильной машины – коэффициентом использования энергии ξ(КИЭ). На схеме 9.4.1 приведены формулы для вычисления КПД и КИЭ.
Чтобы воспользоваться формулами 1. Сформулируйте первое начало термодинамики. Запишите его уравнение в дифференциальной форме, поясните обозначения бесконечно малых величин. К каким процессам применим этот постулат? 2. Что называется вечным двигателем первого рода? 3. Как определяются теплоемкости при постоянном объеме и при постоянном давлении? Почему их называют функциями состояния? 4. Получите уравнение, связывающее теплоемкости 5. Сделайте вывод уравнения Майера. Для каких систем это уравнение применимо? 6. Что называется политропическим процессом? Запишите уравнение политропы для параметров 7. Как связан показатель политропы с теплоемкостью процесса? 8. Является ли адиабатный процесс политропическим процессом? Обоснуйте ответ. 9. Как выглядят графики политропических процессов? Приведите примеры. 10. Как можно определить работу, совершенную системой, через количество теплоты, полученное ею извне в политропическом процессе? 11. Нарисуйте принципиальные схемы тепловых машин, работающих как двигатель и как холодильная машина. 12. Дайте определения КПД и КИЭ. По каким формулам они вычисляются и как связаны между собой? ТЕОРЕМЫ КАРНО И ИХ ПРИЛОЖЕНИЯ В 1824 году французский физик и военный инженер Никола Леонар Сади Карно опубликовал свою работу «Размышления о движущей силе огня и о машинах, способных развивать эту силу», в которой им были сформулированы основные положения теории тепловых машин, содержащие по своей сути идею второго начала термодинамики. В этом сочинении Карно ввёл в научный обиход множество понятий, использующихся в термодинамике и сейчас. Однако главной заслугой учёного стало выдвижение идей о необходимости перепада температур для создания циклически действующей тепловой машины и о том, что величина работы определяется только разностью температур нагревателя и холодильника и не зависит от природы рабочего вещества.
В идеальной машине Карно рабочее вещество (идеальный газ) совершает цикл, представленный на рис. 10.1, состоящий из двух изотерм и двух адиабат. Адиабата и изотерма слабо отличаются друг от друга, поэтому площадь внутри замкнутой кривой на диаграмме Расчёт КПД машины Карно Идеальный газ совершает цикл, состоящий из двух изотерм и двух адиабат – цикл Карно, представленный на рис. 10.2. Актуальная информация о системе и процессах • Так как газ идеальный, то справедливо уравнение Клапейрона-Менделеева • Изменение внутренней энергии идеального газа на изотерме равно нулю • Уравнение адиабаты для идеального газа в параметрах Рассчитать КПД тепловой машины Карно. • По определению КПД двигателя равен • Количество теплоты, поступающее к рабочему телу от нагревателя на участке 1-2 При записи (10.3) учтено, что изменение внутренней энергии идеального газа на изотерме не происходит. • На участке 3-4 • На участках 2-3 и 4-1 рабочее тело изолируется от нагревателя и холодильника. Соответствующие квазистатические процессы идут без теплообмена • Подставим в формулу (10.2) полученные значения • Уравнение адиабатического процесса (10.1) позволяет существенно упростить это выражение. Действительно, для адиабаты 2 — 3 (рис. 10.2) а для адиабаты 4 — 1 запишем Если разделить уравнение (10.6) на уравнение (10.7), то получим • Воспользовавшись этим результатом, из формулы (10.5) получим окончательный ответ Из (10.9) видно, что чем ниже температура холодильника 10.2. Теоремы Карно Основные положения теории тепловых машин Сади Карно сформулировал в виде двух теорем, которые доказываются от противного [12]. Мы приведём лишь формулировки этих теорем и сфокусируем внимание на их приложениях (схема 10.2.1).
Далее мы подробно рассмотрим каждое из приложений этих двух теорем. Начнем с построения абсолютной термодинамической шкалы температур. Термодинамическая шкала температур Поскольку КПД не зависит от рабочего тела, то можно представить следующую процедуру построения шкалы температур. • В качестве нагревателя машины Карно берется некоторое стандартное тело, например, вода, кипящая при атмосферном давлении. • В качестве холодильника выбирается другое стандартное тело, например лед, тающий при атмосферном давлении. • Разность температур • Осуществляется обратимый цикл Карно с каким-либо телом. • Измеряются Кроме того Отсюда находится искомая температура Построенная таким образом шкала температур Кельвина, как мы уже знаем, совпадает со шкалой газового термометра. Из уравнения (10.10) следует, что нулем температуры является температура, при которой 10.3. Метод циклов С помощью первой теоремы Карно можно получить много важных соотношений между физическими величинами в дифференциальной форме, характеризующими систему в состоянии термодинамического равновесия. Для этого надо заставить систему надлежащим образом осуществить цикл Карно и применить к нему теорему Карно. Этот метод называется методом циклов. Проясним его сущность на примере решения следующей задачи. Задача о нахождении зависимости внутренней энергии макроскопического тела от его объема Рассмотрим произвольное физически однородное тело, состояние которого характеризуется двумя параметрами известно его термическое уравнение состояния Для того, чтобы в соответствии с методом циклов получить зависимость энергии от объема в дифференциальной форме, необходимо осуществить бесконечно малый цикл Карно над рассматриваемым телом таким образом, чтобы температуры изотерм отличались на Запишем КПД цикла Карно с одной стороны через температуры, а с другой – через полученное телом количество теплоты и совершенную им работу Работа Высота этого параллелограмма численно равна приращению Основание же 6-1дает приращение давления при повышении температуры на Для работы цикла, которая численно равна его площади, получаем Вычислим теперь количество теплоты Так как на изотерме 1-2температура постоянна, то Подставив (10.14) в (10.13), получим Теперь вернемся к (10.11). Выразим числитель и знаменатель правой части этого уравнения согласно (10.12) и (10.15). Тогда получим Из (10.16) легко выразить частную производную. В итоге получаем искомое решение Подобным образом можно найти зависимость давления насыщенного пара от температуры или закон изменения поверхностного натяжения с температурой и множество других закономерностей. 10.4. Неравенство Клаузиуса. Определение энтропии На основе второй теоремы Карно можно получить неравенство, связывающее приведённую теплоту нагревателя где Запишем это неравенство более детально или, что, то же самое Знак минус в этом неравенстве показывает, что Отметим, что знак равенства относится к равновесному циклу Карно, а знак неравенства к неравновесному (необратимому). Неравенство Клаузиуса можно обобщить для произвольного цикла [12]. Оно имеет следующий вид здесь под Запишем (10.20) для произвольного обратимого цикла Из этого следует (см. 8.1), что бесконечно малая величина под интегралом в (10.21) является полным дифференциалом некоторой функции состояния. Обозначим её буквой Равенство (10.22) определяет энтропию для обратимых процессов. Дальнейшему обсуждению этой важной термодинамической величины будет посвящена следующая лекция. Кроме того, свойства энтропии в окрестности абсолютного нуля температур мы рассмотрим при изучении третьего начала термодинамики. 10.5. Оценка эффективности тепловых машин сверху В повседневной жизни мы постоянно используем различные виды тепловых машин. Наземные транспортные средства невозможно представить без бензинового двигателя внутреннего сгорания или дизельного мотора. На тепловых электростанциях работают паровые турбины. В небо нас уносят турбореактивные самолеты. В основе работы этих и многих других машин лежат различные циклические процессы и в них применяются разные рабочие вещества. У вас будет возможность научиться рассчитывать КПД и КИЭ на основе рассмотрения конкретных циклов Отто, Дизеля, Брайтона и других. Возникает вопрос, можно ли рассчитать показатели эффективности машины, не вдаваясь в детали ее работы. Оказывается можно, но, разумеется, приближенно. Вторая теорема Карно позволяет сделать оценки эффективности реальных машин сверху. Для этого нужно знать только максимальную температуру цикла машины будем рассчитывать КПД и КИЭ реальных машин по формулам цикла Карно. Эти формулы приведены на схеме 10.5.1.
Примеры оценок эффективности тепловых машин сверху КПД бензинового двигателя внутреннего сгорания КПД реального теплового двигателя, работающего по циклу Отто, не превосходит 0,56. Видео:Основы теплотехники. Теплоёмкость газов и газовых смесей. Уравнение МайераСкачать  Формула Майера для теплоемкостей идеального газа, пример задачиМногие газы в физике принято описывать в рамках идеальной модели, с помощью которой можно легко определить основные термодинамические характеристики системы. В данной статье приведем вывод формулы Майера для газа идеального и покажем, как ее можно использовать для решения задачи. Видео:Адиабатный процесс. 10 класс.Скачать  Идеальный газ и его уравнениеЧтобы понять вывод формулы Майера, следует ближе познакомиться с моделью идеального газа. Согласно ей, термодинамическая система представляет собой совокупность частиц, которые не обладают размерами (являются материальными точками). Их кинетическая энергия является единственной компонентой внутренней энергии системы (потенциальная энергия взаимодействий равна нулю), и скорости частиц подчиняются классическому распределению Максвелла-Больцмана. Описанная модель хорошо подходит для многих реальных газообразных систем, состоящих из химически инертных атомов и молекул, и имеющих невысокие давления и температуры в несколько сотен кельвин. Идеальный газ описывается универсальным выражением, которое называется законом Клапейрона-Менделеева. Оно приведено ниже: Здесь P, V, T — три термодинамических величины: давление, объем и температура. Параметры n и R — это количество вещества в системе и постоянная для всех газов, соответственно. Видео:Демидович №4451: вывод уравнения неразрывностиСкачать  Внутренняя энергия и изохорный процессСогласно определению, внутренняя энергия U произвольной системы равна сумме потенциальной и кинетической энергий ее элементов. Выше отмечалось, что в идеальной модели газовые молекулы и атомы друг с другом не взаимодействуют, это означает, что внутренняя энергия определяется исключительно кинетической составляющей. Из кинетической теории газов следует равенство, связывающее среднюю кинетическую энергию частицы с абсолютной температурой в системе: Где m — масса одной частицы, kB — Больцмана константа, v — скорость средняя квадратичная, z — число степеней свободы. Если обе части равенства умножить на количество N частиц в системе, то мы получим выражение для внутренней энергии U: При записи этого выражения мы воспользовались следующими равенствами: Теперь рассмотрим вопрос определения внутренней энергии газа с точки зрения термодинамики. Обратимся к изохорному процессу. В результате него все подводимое тепло идет на нагрев системы, поскольку объем остается постоянный, и работа газа равна нулю, то есть: В свою очередь, изменение величины U можно записать так: Где CV — теплоемкость системы при постоянном объеме. Эта величина показывает, сколько энергии в джоулях необходимо затратить, чтобы нагреть систему на 1 Кельвин. Сравнивая это выражение с формулой для U, которая получена из кинетической теории, приходим к равенству: Вместо теплоемкости CV часто пользуются молярной изохорной теплоемкостью, то есть той же величиной, только для 1 моля газа: Видео:О.Я. Савченко 5.6.28* | Вывод уравнения политропыСкачать  Формула Майера для теплоемкостейЧтобы получить названную формулу, следует рассмотреть с точки зрения термодинамики изобарный процесс. Под ним понимают переход системы между двумя равновесными состояниями, при котором давление не изменяется. Предположим, что в рассматриваемой системе содержится 1 моль газа, тогда первое начало термодинамики для изобарного процесса примет вид: Теперь введем понятие об изобарной теплоемкости CP. Под ней понимают количество теплоты, которое следует системе сообщить, чтобы она нагрелась на 1 Кельвин, а ее давление при этом не изменилось. Это определение позволяет переписать равенство выше в виде: Если вспомнить уравнение для 1 моля идеального газа и выражение для изменения внутренней энергии, то это равенство запишется так: Это выражение называется формулой Майера для идеального газа. Оно показывает, что изобарная теплоемкость всегда больше изохорной на величину газовой постоянной для 1 моля газа. Значение же газовой постоянной R также приобретает конкретный физический смысл — это работа, которую совершает один моль газа во время его изобарного расширения при нагреве на один Кельвин. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Задача на определение теплоемкостей воздухаНеобходимо вычислить молярные теплоемкости CP и CV для воздуха, полагая его идеальным газом. Решить эту задачу несложно, если вспомнить, что изохорная молярная теплоемкость равна: Тогда в соответствии с формулой Майера молярная величина CP будет равна: Поскольку воздух на 99% образован двухатомными молекулами O2 и N2, то z для него равно 5. Подставляя это значение, а также значение R=8,314 Дж/(К*моль) в формулы, получаем ответы на задачу: CV = 20,8 Дж/(К*моль), CP = 29,1 Дж/(К*моль). 🎥 ВидеоРешение задач на термохимические уравнения. 8 класс.Скачать  Урок 172. Применение 1 закона термодинамики для различных процессовСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать  29. Адиабатический процесс. Уравнение ПуассонаСкачать  Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать  Количество теплоты, удельная теплоемкость вещества. 8 класс.Скачать  Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать  Физика. Термодинамика: Адиабатный процесс. Центр онлайн-обучения «Фоксфорд»Скачать  Уравнение Ван-дер-Ваальса (вывод и применение). By Bogatov N.A.Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Теплоемкость. Теплоемкость газа. Молярная теплоемкостьСкачать  Урок 175. Уравнение теплового балансаСкачать  Олегу Тинькову запрещён вход на Мехмат МГУСкачать  |




 ,
, ,
, ,
,
 ,
, ,
, ,
, .
. .
. .
.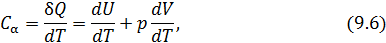
 и
и  :
: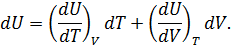
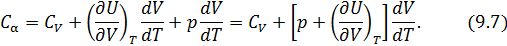
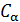 в любом термодинамическом процессе и для любой макроскопической системы, если известны калорическое и термическое уравнения состояния.
в любом термодинамическом процессе и для любой макроскопической системы, если известны калорическое и термическое уравнения состояния. и получим общее соотношение между
и получим общее соотношение между 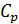 и
и 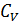 .
.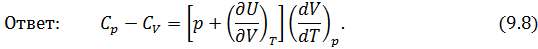

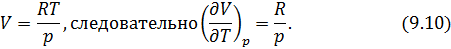
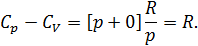

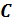 .
.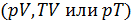 уравнение процесса наглядно представляется в виде графика — кривой процесса. Кривая, изображающая политропический процесс, называется политропой. Уравнение политропического процесса для любого вещества может быть получено на основе первого начала термодинамики с использованием его термического и калорического уравнений состояния. Продемонстрируем, как это делается на примере вывода уравнения процесса для идеального газа.
уравнение процесса наглядно представляется в виде графика — кривой процесса. Кривая, изображающая политропический процесс, называется политропой. Уравнение политропического процесса для любого вещества может быть получено на основе первого начала термодинамики с использованием его термического и калорического уравнений состояния. Продемонстрируем, как это делается на примере вывода уравнения процесса для идеального газа.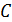 в процессе позволяет записать первое начало термодинамики в виде
в процессе позволяет записать первое начало термодинамики в виде
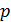

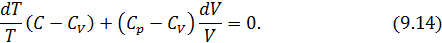
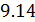 ) на
) на 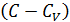 , находим
, находим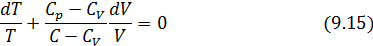

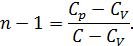
 )
) 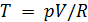 получаем уравнение политропы в переменных
получаем уравнение политропы в переменных 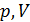


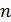 называется показателем политропы, который может принимать согласно (
называется показателем политропы, который может принимать согласно ( 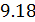 ) самые разные значения, положительные и отрицательные, целые и дробные. За формулой (
) самые разные значения, положительные и отрицательные, целые и дробные. За формулой ( 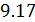 ) скрывается множество процессов. Известные вам изобарный, изохорный и изотермический процессы являются частными случаями политропического.
) скрывается множество процессов. Известные вам изобарный, изохорный и изотермический процессы являются частными случаями политропического.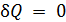 ). Реализовать такой процесс можно двумя способами. Первый способ предполагает наличие у системы теплоизолирующей оболочки, способной изменять свой объем. Второй – заключается в осуществлении столь быстрого процесса, при котором система не успевает обмениваться количеством теплоты с окружающей средой. Процесс распространения звука в газе можно считать адиабатным благодаря его большой скорости.
). Реализовать такой процесс можно двумя способами. Первый способ предполагает наличие у системы теплоизолирующей оболочки, способной изменять свой объем. Второй – заключается в осуществлении столь быстрого процесса, при котором система не успевает обмениваться количеством теплоты с окружающей средой. Процесс распространения звука в газе можно считать адиабатным благодаря его большой скорости.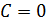 . Согласно
. Согласно 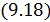

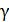 – показатель адиабаты.
– показатель адиабаты.
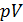 адиабата «падает» более круто, чем изотерма.
адиабата «падает» более круто, чем изотерма.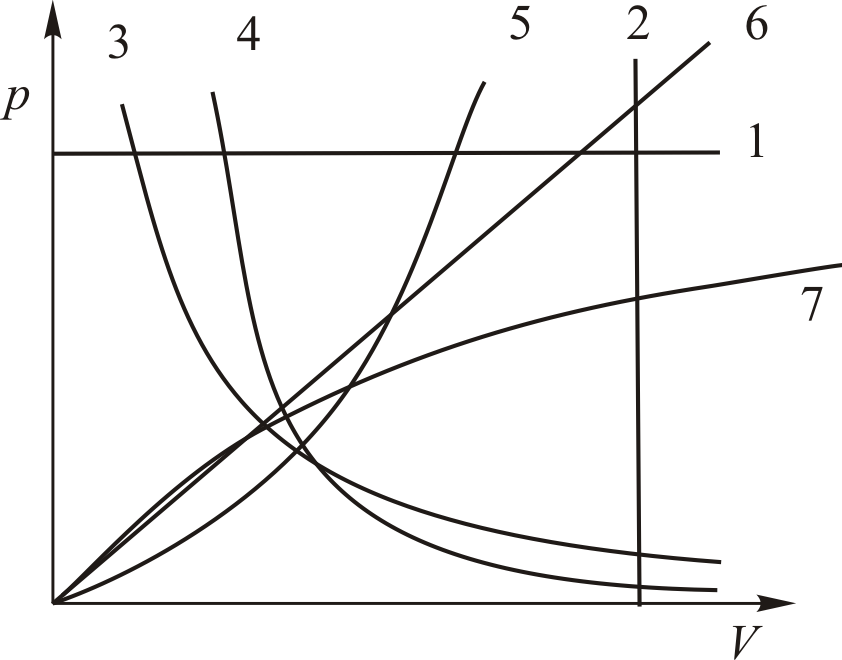
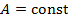 )
)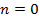
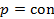 st
st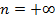
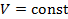
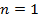
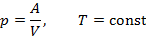
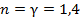
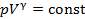
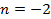
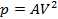
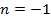
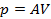
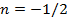
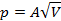
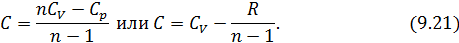
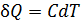 .
.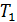 до
до 
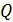 , можно определить макроскопическую работу
, можно определить макроскопическую работу 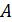 , совершенную системой в политропическом процессе, с помощью уравнения первого начала в интегральной форме и формулы
, совершенную системой в политропическом процессе, с помощью уравнения первого начала в интегральной форме и формулы 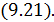
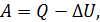
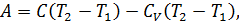
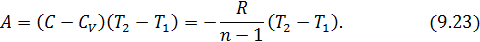
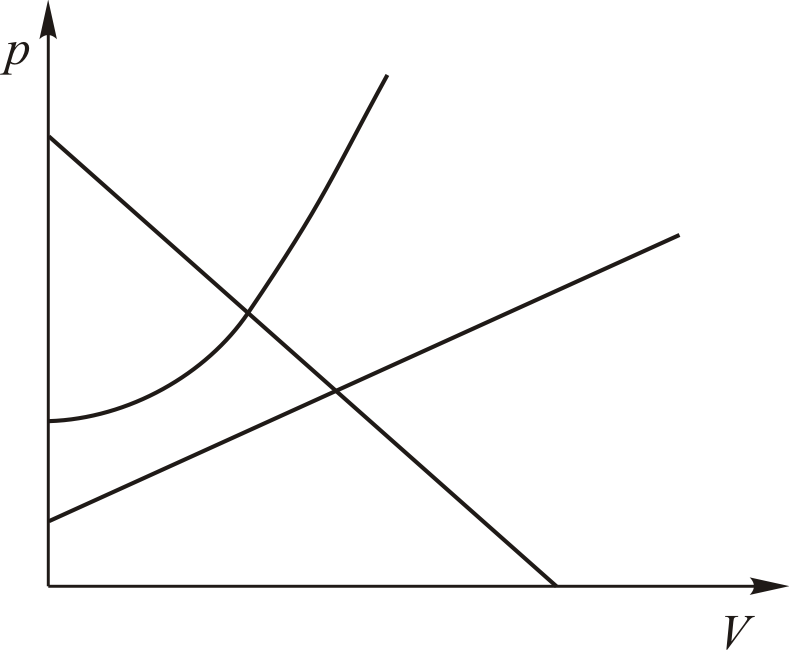
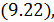 так как теплоёмкость системы будет зависеть от температуры
так как теплоёмкость системы будет зависеть от температуры 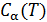 . Соответственно
. Соответственно
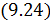

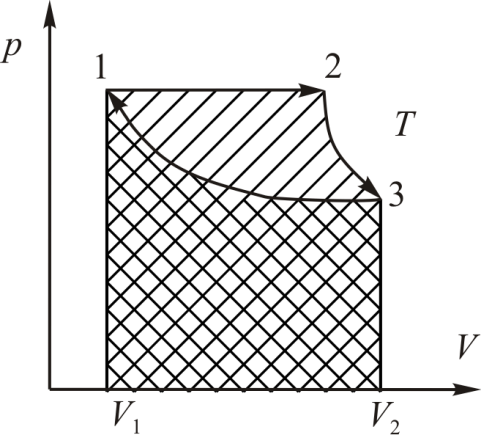 На диаграмме процессов цикл изображается замкнутой кривой (рис. 9.3) с указанием направления перехода (по часовой стрелке или против часовой стрелки). Работа, совершаемая машиной за цикл равна площади, ограниченной этой кривой.
На диаграмме процессов цикл изображается замкнутой кривой (рис. 9.3) с указанием направления перехода (по часовой стрелке или против часовой стрелки). Работа, совершаемая машиной за цикл равна площади, ограниченной этой кривой.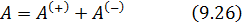
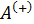 равна площади под кривой 1-2-3 на диаграмме
равна площади под кривой 1-2-3 на диаграмме 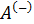 — отрицательная, поскольку объём на участке 3-1 уменьшается. Величина
— отрицательная, поскольку объём на участке 3-1 уменьшается. Величина 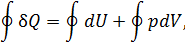
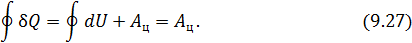
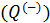 . Обобщённо можно записать так
. Обобщённо можно записать так
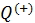 .
.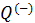 окружающей среде.
окружающей среде.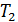 (холодный термостат), а также рабочее вещество, или рабочее тело, заключённое в некотором техническом устройстве (цилиндр с поршнем, турбина и т. п.), имеющем силовой привод. Если циклический процесс, описывающий состояние рабочего вещества в машине, идет по часовой стрелке, то машина работает в режиме двигателя (рис. 9.4), если против часовой стрелки, то в режиме холодильника, кондиционера или теплового насоса (рис. 9.5). Последние три названия часто объединяют одним термином – холодильная машина.
(холодный термостат), а также рабочее вещество, или рабочее тело, заключённое в некотором техническом устройстве (цилиндр с поршнем, турбина и т. п.), имеющем силовой привод. Если циклический процесс, описывающий состояние рабочего вещества в машине, идет по часовой стрелке, то машина работает в режиме двигателя (рис. 9.4), если против часовой стрелки, то в режиме холодильника, кондиционера или теплового насоса (рис. 9.5). Последние три названия часто объединяют одним термином – холодильная машина.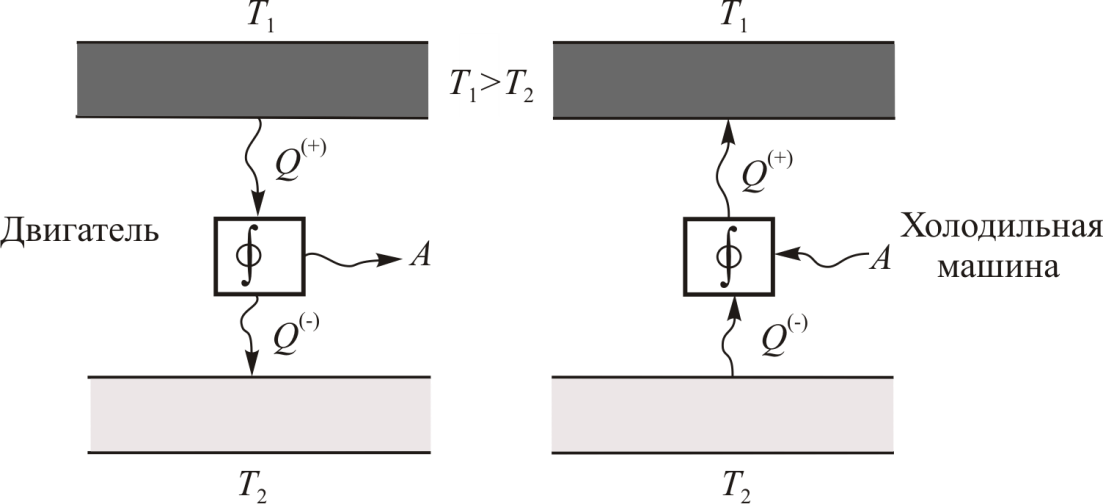
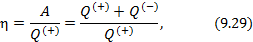

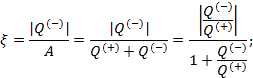
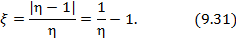
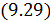 –
– 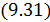 необходимо точно установить на каких участках цикла, совершаемого рабочим телом, количество теплоты, поступает в машину, а на каких участках цикла количество теплоты передается низкотемпературному резервуару.
необходимо точно установить на каких участках цикла, совершаемого рабочим телом, количество теплоты, поступает в машину, а на каких участках цикла количество теплоты передается низкотемпературному резервуару.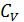 в общем случае.
в общем случае.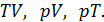

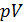 очень мала. Таким образом, характеристика цикла Карно по величине абсолютной работы не является хорошей, но с учётом затрат это самый эффективный цикл среди всех возможных циклов для получения работы.
очень мала. Таким образом, характеристика цикла Карно по величине абсолютной работы не является хорошей, но с учётом затрат это самый эффективный цикл среди всех возможных циклов для получения работы.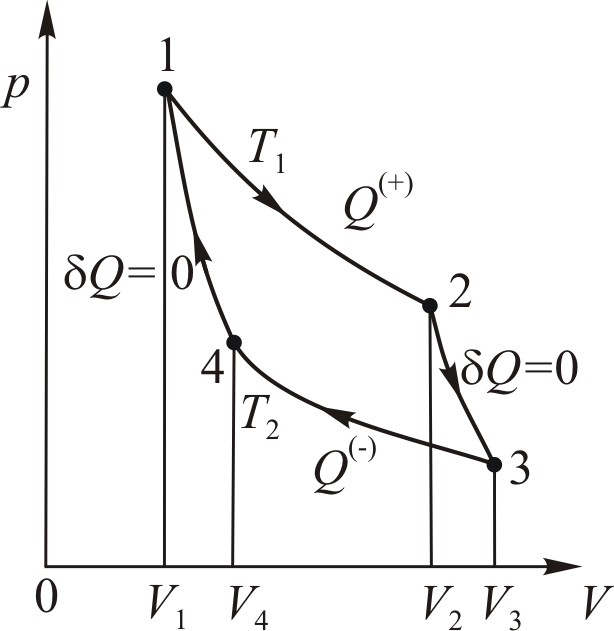
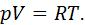
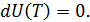


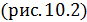 равно
равно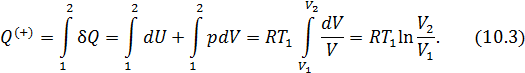
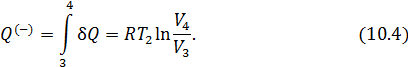
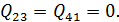
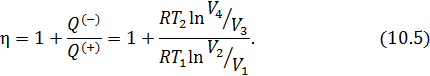


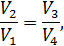


 всегда меньше 1, потому, что
всегда меньше 1, потому, что 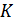 , поскольку абсолютный нуль температур не достижим согласно третьему началу термодинамики. Такой аргумент следует признать неверным. Дело в том, что даже если бы
, поскольку абсолютный нуль температур не достижим согласно третьему началу термодинамики. Такой аргумент следует признать неверным. Дело в том, что даже если бы 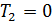

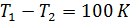 . Из этих двух уравнений определяем
. Из этих двух уравнений определяем 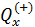 и
и 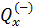 . Тогда справедливо равенство
. Тогда справедливо равенство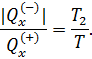
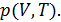
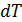 . Изобразим подобный цикл на рис. 10.3. Как видно, верхняя изотерма имеет температуру
. Изобразим подобный цикл на рис. 10.3. Как видно, верхняя изотерма имеет температуру 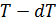 .
.
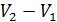 – объема при изотермическом процессе 1-2.
– объема при изотермическом процессе 1-2.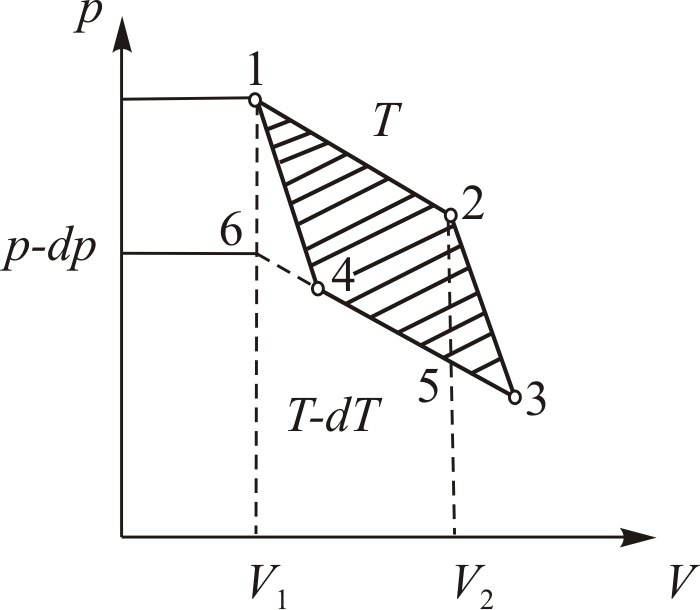
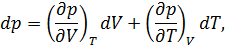
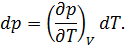
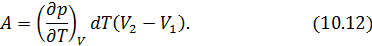
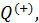 отданное нагревателем телу на изотерме 1-2. Пренебрегая изменениями давления на участке 1-2, запишем согласно первому началу
отданное нагревателем телу на изотерме 1-2. Пренебрегая изменениями давления на участке 1-2, запишем согласно первому началу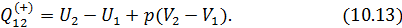

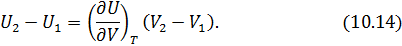
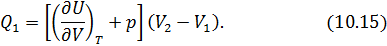
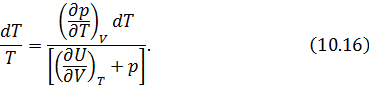
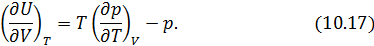
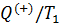 и приведённую теплоту холодильника
и приведённую теплоту холодильника 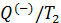 для цикла Карно. Воспользуемся математической записью второй теоремы Карно
для цикла Карно. Воспользуемся математической записью второй теоремы Карно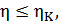
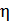 – КПД произвольного цикла с фиксированными температурами
– КПД произвольного цикла с фиксированными температурами 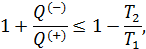




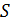 . Эта термодинамическая функция называется энтропией
. Эта термодинамическая функция называется энтропией
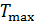 и его минимальную температуру
и его минимальную температуру 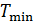 .
.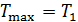 ,
,