| Теплоёмкость идеального газа. Уравнение Майера |   |
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус:
Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости. Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К. Для газов удобно пользоваться молярной теплоемкостью Cμ— количество теплоты, необходимое для нагревания 1 моля газа на 1 градус:
Из п. 1.2 известно, что молярная масса – масса одного моля:
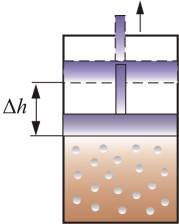
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV. СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2). Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния. Величины СР и СV оказываются связанными простыми соотношениями. Найдём их. Пусть мы нагреваем один моль идеального газа при постоянном объёме(dA = 0). Тогда первое начало термодинамики запишем в виде:
Теплоемкость при постоянном объёме будет равна:
Из (4.2.4) следует, что
Для произвольной идеальной массы газа:
При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом:
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе. Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж. Полезно знать формулу Майера для удельных теплоёмкостей: Содержание Видео:Термодинамика | уравнение МайераСкачать  Уравнение МайераУравнение Майера связывает теплоемкости идеального газа в двух изопроцессах, тогда перейдем к самому его определению. Видео:Адиабатный процесс. 10 класс.Скачать  Теплоемкость. Уравнение МайераПереданное телу количество теплоты для его нагревания на 1 К получило название теплоемкости тела данной системы. Обозначение принимается буквой » С » : Значение теплоемкости единицы молярной массы тела: c μ = C v ( 2 ) . Выражение называется молярной теплоемкостью. Теплоемкость не считается функцией состояния, так как является характеристикой бесконечно близких состояний системы или выражается в качестве функции бесконечно малого процесса, совершаемого в системе. В количественном выражении это означает, что из ( 1 ) , применяя первое начало термодинамики, дифференциальная форма получится: C = δ Q d T = d U + p d V d T ( 3 ) . Видео:Урок 172. Применение 1 закона термодинамики для различных процессовСкачать  Уравнение Майера для идеального газаОпределение термодинамической системы производится при помощи трех параметров p , V , T . Существующее между ними отношение получило название уравнения состояния. Для идеального газа используется уравнение Менделеева-Клапейрона. Данная связь запишется в виде: p = p ( T , V ) или T = T ( p , V ) , V = V ( p , T ) . При выборе независимых переменных в качестве V и T внутренняя энергия системы выражается в виде функции U = U ( T , V ) . Получим, что значение полного дифференциала от внутренней энергии примет вид: d U = ∂ U ∂ T V d T + ∂ U ∂ V T d V ( 4 ) . Произведем подстановку из ( 4 ) в ( 3 ) , тогда c = ∂ U ∂ T V d T + ∂ U ∂ V T d V + p d V d T = ∂ U ∂ T V + p + ∂ U ∂ V T d V d T ( 5 ) . Исходя из формулы ( 5 ) , теплоемкость находится в зависимости от процесса. Если он изохорный, то Значение теплоемкости изохорного процесса запишется как: C V = ∂ U ∂ T V ( 6 ) . При изобарном теплоемкость выражается через формулу: C p = ∂ U ∂ T V + p + ∂ U ∂ V T ∂ V ∂ T p = C V + p + ∂ U ∂ V T ∂ V ∂ T p ( 7 ) . Перейдем к рассмотрению исследуемой системе идеального газа. Запись малого приращения энергии идеального газа: d U = i 2 v R d T ( 8 ) . d U d V T = 0 ( 9 ) . Состояние идеального газа описывается при помощи уравнения Менделеева-Клапейрона: ∂ V ∂ T p = v R p ( 11 ) . Произведем подстановку в ( 7 ) из ( 10 ) и ( 11 ) : C p = C V + p + 0 v R p = C V + v R ( 12 ) . Выражение ( 12 ) называют выведенным соотношением Майера. Или для молярных теплоемкостей: C μ p = C μ V + R ( 13 ) . Найти удельную теплоемкость смеси 16 г кислорода и 10 г гелия в процессе с постоянным давлением. Если Q считается количеством тепла, получаемым смесью газов в процессе, то Q = c p m ∆ T ( 1 . 1 ) , где m является массой смеси, c p – удельной теплоемкостью смеси при неизменном давлении. Q O 2 — это количество тепла, получаемое кислородом: Q O 2 = c p O 2 m O 2 ∆ T ( 1 . 2 ) , m O 2 выражается массой кислорода, c p O 2 – теплоемкостью кислорода с постоянным давлением. Для гелия аналогично: Q H e = c p H e m H e ∆ T ( 1 . 3 ) . Кроме этого рассмотрим: Q = c p m ∆ T = Q O 2 + Q H e = c p O 2 m O 2 ∆ T + c p H e m H e ∆ T ( 1 . 4 ) . Нахождение массы смеси производится по закону сохранения массы: m = m O 2 + m H e ( 1 . 5 ) . Произведем выражение теплоемкости c p из ( 1 . 4 ) , учитывая ( 1 . 5 ) . Тогда имеем: c p = c p O 2 m O 2 + c p H e m H e m O 2 + m H e ( 1 . 6 ) . Существует связь между молярной теплоемкостью и удельной: c μ = c · μ → c = c μ μ ( 1 . 7 ) . Если c μ V = i 2 R , то по уравнению Роберта Майера c μ p = c μ V + R : c μ p = i + 2 2 R ( 1 . 8 ) ; i H e = 3 , i O 2 = 5 . В данном случае удельные теплоемкости запишутся как: c p H e = 5 2 R μ H e , c p O 2 = 7 R 2 μ O 2 ( 1 . 9 ) . Результатом будет записанная формула удельной теплоемкости смеси: c p = 7 R 2 μ O 2 m O 2 + 5 2 R μ H e m H e m O 2 + m H e ( 1 . 10 ) . c p = 3 , 5 · 8 , 31 · 16 32 + 2 , 5 · 8 , 31 · 10 4 26 = 14 , 5 + 51 , 94 26 = 2 , 56 Д ж г К . Ответ: удельная теплоемкость смеси равняется 2 , 56 Д ж г К . При проведении опытов Джоулем было получено, что с μ p — c μ V = 1 , 986 к а л К · м о л ь . Значение газовой постоянной, измеренной в механических единицах R = 8 , 314 · 10 7 э р г К · м о л ь . Определите, как соотносятся 1 к а л , э р г , Д ж . Основой решения данного задания принято считать уравнение Майера, формула записывается: с μ p = c μ V + R → c μ p — c μ V = R ( 2 . 1 ) . Отсюда получим, что: c μ p — c μ V = 1 , 986 к а л К · м о л ь = 8 , 314 · 10 7 э р г К · м о л ь → 1 к а л = 4 , 18 · 10 7 э р г = 4 , 18 Д ж . Ответ: 1 к а л = 4 , 18 · 10 7 э р г = 4 , 18 Д ж . Видео:Геометрический смысл производной | КасательнаяСкачать  Первое начало термодинамики. Теплоемкость идеального газа. Уравнение МайераПервое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем. Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца [1] . Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника. Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус:
Размерность теплоемкости: [C] = Дж/К. Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости. Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К. Для газов удобно пользоваться молярной теплоемкостью Cμ— количество теплоты, необходимое для нагревания 1 моля газа на 1 градус:
Из п. 1.2 известно, что молярная масса – масса одного моля:
где А – атомная масса; mед — атомная единица массы; NА — число Авогадро; моль μ – количество вещества, в котором содержится число молекул, равное числу атомов в 12 г изотопа углерода 12 С. Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV. СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2). Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния. Величины СР и СV оказываются связанными простыми соотношениями. Найдём их. Пусть мы нагреваем один моль идеального газа при постоянном объёме(dA = 0). Тогда первое начало термодинамики запишем в виде:
т.е. бесконечно малое приращение количества теплоты Теплоемкость при постоянном объёме будет равна:
так как U может зависеть не только от температуры. Но в случае идеального газа справедлива формула (4.2.4). Из (4.2.4) следует, что
Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р и тому подобных), поэтому формула (4.2.5) справедлива для любого процесса. Для произвольной идеальной массы газа:
При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом:
Из основного уравнения молекулярно-кинетической теории
Это уравнение Майера для одного моля газа. Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе. Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж. Полезно знать формулу Майера для удельных теплоёмкостей:
19. Адиабатический процесс. Адиабати́ческий, или адиаба́тный проце́сс (от др.-греч. ἀδιάβατος — «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством. Адиабатический процесс является частным случаем политропного процесса, так как при нём теплоёмкость газа равна нулю и, следовательно, постоянна [2] . Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётсяравновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только обратимые адиабатические процессы [3] . Обратимый адиабатический процесс для идеального газа описывается уравнением Пуассона. Если термодинамический процесс в общем случае представляет собой три процесса — теплообмен, совершение системой (или над системой) работы и изменение её внутренней энергии [5] , то адиабатический процесс в силу отсутствия теплообмена ( где Изменения энтропии S системы в обратимом адиабатическом процессе вследствие передачи тепла через границы системы не происходит [8] : Здесь Работа газа[править | править вики-текст] Основная статья: Термодинамическая работа Совершение над газом работы на элементарном участке dh. Совершаемая работа показана красными лампочками Поясним понятие работы применительно к адиабатическому процессу. В частном случае, когда работа совершается через изменение объёма, можно определить её следующим способом: пусть газ заключён в цилиндрический сосуд, плотно закрытый легко скользящим поршнем, если газ будет расширяться, то он будет перемещать поршень и при перемещении на отрезок где F — сила, с которой газ действует на поршень. Перепишем уравнение: где s — площадь поршня. Тогда работа будет равна [9] [10] где Основное уравнение термодинамики примет вид [11] :
Это условие будет выполняться, если скорость хода поршня (протекания процесса в общем случае) будет удовлетворять определённым условиям. С одной стороны она должна быть достаточно малой, чтобы процесс можно было считать квазистатическим. Иначе при резком изменении хода поршня давление, которое его перемещает, будет отличаться от давления в целом по газу. То есть газ должен находиться в равновесии, без турбулентностей и неоднородностей давления и температуры. Для этого достаточно передвигать поршень со скоростью, существенно меньшей, чем скорость звука в данном газе. С другой стороны скорость должна быть достаточно большой, чтобы можно было пренебречь обменом тепла с окружающей средой и процесс оставался адиабатическим [12] [13] . Однако работа может совершаться и другими путями — например, идти на преодоление межмолекулярного притяжения газов. В этом случае параллельно с изменением внутренней энергии будет происходить процессы совершения нескольких работ разной физической природы, и основное уравнение термодинамики примет вид:
где 🌟 ВидеоПрименение первого закона термодинамики к изопроцессам. 10 класс.Скачать  Количество теплоты, удельная теплоемкость вещества. 8 класс.Скачать  Первый закон термодинамики. 10 класс.Скачать  ЧК_МИФ: 4.1.1.ДФ_1 Физический смысл уравнений МаксвеллаСкачать  Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать  Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать  Все формулы молекулярной физики, МКТ 10 класс, + преобразования и шпаргалкиСкачать  Урок 132. Основные понятия гидродинамики. Уравнение непрерывностиСкачать  Геометрический смысл производной. Уравнение касательнойСкачать  Олегу Тинькову запрещён вход на Мехмат МГУСкачать  Теплоемкость. Теплоемкость газа. Молярная теплоемкостьСкачать  Количество теплоты, удельная теплоемкость вещества. Практическая часть - решение задачи. 8 класс.Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Интуитивное понимание формулы теплопроводности (часть 11) | Термодинамика | ФизикаСкачать  Лекция по физике №8. Распределение Больцмана. Теплоёмкость, Уравнение адиабатического процесса.Скачать  |




 ,
, ,
, ,
,
 ,
, ,
, ,
, .
. .
. .
.


 .
. ,
, равно приращению внутренней энергии dU.
равно приращению внутренней энергии dU. ,
, ,
,
 ,
, ,
, ,
, .
. .
. . При изобарическом процессе Р = const. Следовательно, из (4.2.7) получим:
. При изобарическом процессе Р = const. Следовательно, из (4.2.7) получим: .
. .
. .
. Внутренняя энергия. Работа и теплота Теплоёмкости одноатомных и многоатомных газов
Внутренняя энергия. Работа и теплота Теплоёмкости одноатомных и многоатомных газов 

 Серьёзное исследование адиабатических процессов началось в XVIII веке [1] .
Серьёзное исследование адиабатических процессов началось в XVIII веке [1] .  ) системы со средой сводится только к последним двум процессам [6] . Поэтому, первое начало термодинамики в этом случае приобретает вид [7] [Комм 1]
) системы со средой сводится только к последним двум процессам [6] . Поэтому, первое начало термодинамики в этом случае приобретает вид [7] [Комм 1]
 — изменение внутренней энергии тела,
— изменение внутренней энергии тела,  — работа, совершаемая системой.
— работа, совершаемая системой.
 — температура системы,
— температура системы,  — теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла [8] .
— теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла [8] . 
 совершать работу [9] [10]
совершать работу [9] [10]


 — давление газа,
— давление газа,  — малое приращение объёма. Аналогично видно, что уравнение выполняется и для сосудов с произвольной поперечной формой сечения. Данное уравнение справедливо и при расширении на произвольных объёмах. Для этого достаточно разбить поверхность расширения на элементарные участки
— малое приращение объёма. Аналогично видно, что уравнение выполняется и для сосудов с произвольной поперечной формой сечения. Данное уравнение справедливо и при расширении на произвольных объёмах. Для этого достаточно разбить поверхность расширения на элементарные участки  на которых расширение одинаково [9] .
на которых расширение одинаково [9] .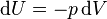

 ,
,  — дифференциальное выражение для работы,
— дифференциальное выражение для работы,  — внешние параметры, которые меняются при совершении работы,
— внешние параметры, которые меняются при совершении работы,