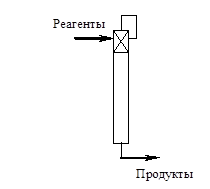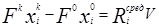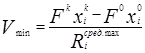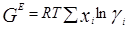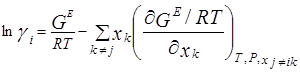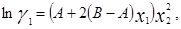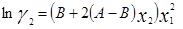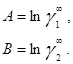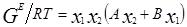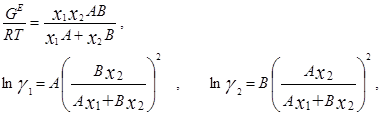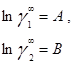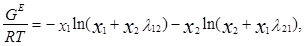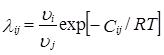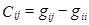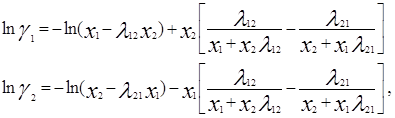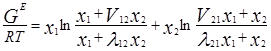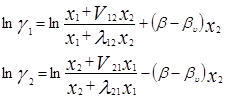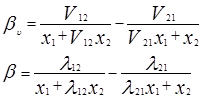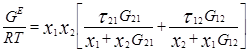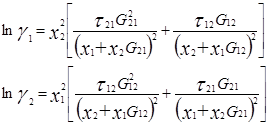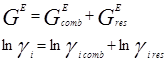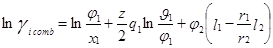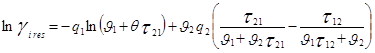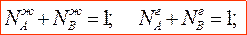
Законы Гиббса-Коновалова и предыдущее уравнение справедливы для двухкомпонентных смесей, состоящих из летучих компонентов.Равновесие между раствором и паром удобно рассма-тривать в виде диаграмм, выражающих зависимость температуры жидкой смеси от ее состава.
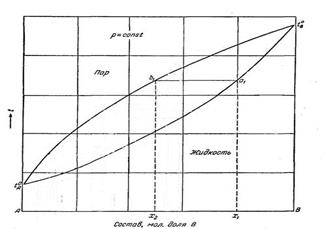
В условиях равновесия относительное содержание компонента в паровой фазе отличается от содержания этого компонента в жидком растворе.В паре содержание больше того компонента, добавление которого в раствор понижает температуру кипения или повышает давление насыщенных паров.Пар обогащается более летучим компонентом.При постоянном давлении температура кипения раствора возрастает при увеличении концентрации компонента, содержание которого в паре меньше, чем в растворе.При постоянной температуре давление пара над раствором при увеличении концентрации компонента, содержание которого в паре больше, чем в растворе.
Диаграммы состава «жидкость-пар» двухкомпонент-ной системы при постоянном давлении (а) и постоянной температуре (б).
I-паровая фаза; II -пар+жидкость; III — жидкая фаза.

Законы Гиббса-Коновалова справедливы вдали от критического состояния двухфазной системы.
Диаграммы состава «жидкость-пар» двухкомпонент-ной системы с азеотропными точками при постоянном давлении (а) и постоянной температуре (б).
I-паровая фаза; II -пар+жидкость; III — жидкая фаза.
Термодинамическое обоснование законов Гиббса-Коновалова

Уравнение показывает изменение состава жидкости и пара в соответствити с закономами Гиббса-Коновалова.К термодинамическому обоснованию законов Гиббса-Коновалова можно подойти, используя уравнение Дюгема-Маргулиса.
 |

Перегонка (дистилляция) и ректификация
Соотношение между жидкой и паровой фазами в гетерогенной области II диаграммы состава двухкомпонентной системы находят по правилу рычага.


В простейших системах a не зависит от состава системы и равен
 |
Твердые растворы
Твердыми растворами называют однородные системы, состоящие из двух и более твердых компонентов.Способность образовывать твердые растворы свойственны всем кристаллическим твердым телам.В большинстве случаях твердые растворы образуются в узком интервале концентрации, значительно реже в широком интервале концентрации. Примеры: золото для ювелирных изделий (Au-Cu), драгоценные природные камни, слюда, полевые шпаты, сплавы металлов, сталь, чугун, латунь и др. В зависимости от способа получения и особенности взаимодействия компонентов твердые растворы делятся на растворы:1)замещения; 2) внедрения и 3) вычитания. Твердые растворы замещения образуются в результате замещения молекул, атомов и ионов в кристаллических решетках растворителя на молекулы, атомы и ионы растворенного вещества. Твердые растворы замещения образуют элементы, атомные радиусы которых отличаются не более чем на 15 %. К ним можно отнести сплав Cu-Ni.Твердые растворы внедрения образуют атомы радиусы которых существенно отличаются друг от друга.Такие растворы образуются когда неметаллы (бор, водород, кислород, азот, углерод) в металлах. К ним относятся чугун, сталь и др.В твердых растворах вычитания происходит «выпадение» атомов из кристаллической решетки. Такие системы иногда называют твердыми растворами с дефектами решетки. В зависимости от взаимной растворимости компонен-тов твердые растворы делятся на неограниченные и ограниченные твердые растворы. В зависимости от растворимости компонентов раство-ра различают системы,
1) компоненты которых взаимно неограниченно раствори-мы в жидком и твердом состоянии,
2) компоненты которых растворимы лишь в жидком состоянии, а в твердом состоянии не образуют раство-ры (растворы с эвтектикой).
Видео:Квартирник у Маргулиса: Машина ВремениСкачать

Дипломная работа: Моделирование парожидкостного равновесия реакционной смеси в процессе получения метилциклопропилкетона
| Название: Моделирование парожидкостного равновесия реакционной смеси в процессе получения метилциклопропилкетона Раздел: Рефераты по химии Тип: дипломная работа Добавлен 11:27:14 10 января 2009 Похожие работы Просмотров: 330 Комментариев: 22 Оценило: 3 человек Средний балл: 5 Оценка: неизвестно Скачать | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
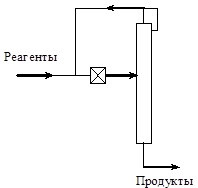
Все это делает весьма затруднительным их использование в непрерывных крупнотоннажных производствах. Поэтому на практике организация селективного вывода продуктов реакции из системы в основном осуществляется с использованием высокопроизводительных массообменных
процессов, таких как ректификация, экстракция, абсорбция и т.д.
Очевидно, что независимо от способа организации селективного обмена реакционной системы веществом с окружающей средой, условием стационарного режима ее работы является следующее балансовое соотношение
где 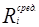
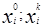
Правая часть этого выражения представляет собой производительность реакционной зоны по i-му реагенту. Если условия проведения химической реакции зафиксированы, т.е. заданы численные значения констант скоростей прямой и обратной реакций, то 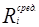
Таким образом, это выражение определяет нижнюю оценку объема реакционной зоны Vmin необходимого для достижения заданной производительности. Следовательно, можно утверждать, что необходимым условием достижения заданной производительности, является выражение
где V- рабочий объем реакционной зоны.
Очевидно, что в отличии от необходимых условий, достаточные условия реализации в системе заданной конверсии не могут быть сформулированы без привлечения дополнительной информации о том, какой из способов формирования требуемого состава в реакционной зоне используется и какими ограничениями обладает массообменный процесс, осуществляющий селективный вывод продуктов реакции из реакционной зоны или системы в целом. Следует отметить, что в любом случае для достижения полной конверсии по реагентам (отсутствие реагентов на выходе из системы) необходимо использовать идеализированный массообменный процесс, позволяющий осуществлять полное отделение продуктов реакции от реагентов, которые должны быть тем или иным способов возвращены в реакционную зону.
Для описания математической модели парожидкостного равновесия (ПЖР) в реальных системах пользуются обобщенным уравнением Рауля: 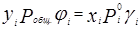
где γi – коэффициент активности i-го компонента в жидкой фазе, а φi – коэффициент летучести i-го компонента в паровой фазе. φi = 1, если ассоциация в паре и Р E определяют из коэффициентов активности. Ниже приведены основные уравнения:
Корреляция избыточных энергий Гиббса имеют чисто эмпирический характер или же частичное теоретическое обоснование. Обычно состав выражают в мольных долях хi , однако, если молекулы значительно различаются по размерам и химической природе, лучше пользоваться объемными долями [3].
Эти уравнения указывают на тесную связь коэффициентов активности с избыточной энергией Гиббса G E [7]. Были предложены многочисленные модели, включающие в себя настраиваемые параметры, которые зависят от температуры. В некоторых случаях этой зависимостью можно пренебречь, особенно если температурный интервал невелик. На практике число настраиваемых констант в расчете на бинарное взаимодействие обычно равно двум или трем; чем больше число констант, тем лучше будет представление экспериментальных данных, однако в то же время потребуется большое количество надежных экспериментальных данных для определения констант. Чтобы получить константы для бинарной смеси при определенной температуре числом более трех, необходимо иметь подробные и исключительно точные экспериментальные данные.
Для умеренно неидеальных бинарных смесей хорошие результаты дают все уравнения, содержащие два (или более) параметра бинарного взаимодействия; в таких случаях нет смысла разбирать преимущества той или иной модели. Следует только отметить, что старые модели (Маргулеса, Ван-Лаара) математически проще, чем более современные (Вильсона, NRTL, UNIQUAC).
Уравнение Маргулеса является наиболее старым из числа применяемых в настоящее время. Исследования Маргулеса были выполнены еще до того, как были сформулированы такие понятия, как фугитивность и коэффициенты активности, однако в сущности его предложения сводятся к представлению lnγ1 и lnγ2 в виде степенных рядов по составу:
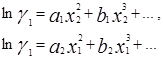
Как правило, применяют линейные перегруппировки этих рядов, предложенные Карлсоном и Кольборном [3]:
в которых существует постоянная зависимость между параметрами и коэффициентами активности при бесконечном разбавлении:
Избыточная энергия Гиббса, соответствующая этим уравнениям, составляет
Двухчленное (однопараметрическое) уравнение Маргулеса применимо только для простых смесей, в которых компоненты похожи по химической природе и размеру молекул [4].
Ван-Лаар рассмотрел изобарный процесс образования жидкого раствора из компонентов, включающий стадии испарения чистых веществ, их смешения в разреженном идеальном газовом состоянии и последующего сжатия и конденсации смеси до исходного давления. Он допускал нулевые значения избыточных объемов и энтропии процесса (соответственно, избыточная энергия Гиббса равна избыточной внутренней энергии) и подчинение флюидных фаз уравнению состояния Ван-дер-Ваальса, причем константы этого уравнения для смесей он представил с помощью простых комбинационных правил на основе констант для чистых компонентов [7]. Ван-Лаар просуммировал изменение внутренней энергии на отдельных стадиях процесса образования раствора, результат может быть представлен в виде следующих уравнений для G E и γi в бинарной системе:
В модели Ван-Лаара величины А, В аналитически связаны с константами уравнения Ван-дер-Ваальса, однако выяснилось, что последние не обеспечивают адекватное описание систем, в частности, из-за большой чувствительности модели к произвольно выбранным комбинационным правилам для констант уравнения состояния. Если же рассматривать величины А, В как самостоятельные эмпирические параметры, оцениваемы по экспериментальным данным о бинарной системе, тогда соотношения превращаются в простые корреляционные уравнения, удовлетворительно описывающие многие системы[7].
Точность представленных выше моделей обычно удовлетворительна для систем малой или умеренной неидеальности и недостаточна для систем с большими отклонениями от идеального поведения.
Прогресс в методах расчета фазовых равновесий, наблюдающийся с середины 60-х гг., в значительной мере связан с появлением нового типа уравнений для G E и γi , за которыми закрепилось общее название – уравнения (модели) локального состава. При их выводе существенную роль, как это следует из названия, играет представление о локальном, микроскопическом составе раствора [7].
В моделях локального состава относительное различие локальных и средних концентраций компонентов связывают с разностью энергий взаимодействия одноименных и разноименных молекулярных пар распределением типа больцмановского.
Введение локальных концентраций в приближенные теоретические уравнения открывает дополнительные возможности для учета энергетики межмолекулярных взаимодействий.
Энергетические параметры моделей Сij носят полуэмпирический характер и оцениваются по экспериментальным термодинамическим данным.
То обстоятельство, что уравнения локального состава описываются на молекулярные модели растворов, обеспечивает им ряд преимуществ перед более ранними уравнениями для коэффициентов активности. Наиболее отчетливо эти преимущества проявляются в случае предсказания свойств многокомпонентных систем по данным для бинарных, при расчетах для неизотермических условий и при описании сильно неидеальных систем. Первое из уравнений такого рода было предложено в 1964 г. Вильсоном [7].
При разработке уравнения Вильсон исходил из тог, что межмолекулярные взаимодействия зависят в первую очередь от «локальных концентраций» ,которые он выражал в объемных долях [3].
Уравнение Вильсона для бинарной смеси для избыточной свободной энергии смешения и для определения коэффициентов активности имеет следующий вид:
где
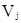
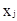
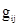
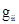
Уравнения для бинарной системы содержат два параметра, которые оценивают по экспериментальным данным для этой системы. Уравнения для многокомпонентного раствора содержат только параметры составляющих бинарных систем. Таким образом, равновесие в многокомпонентных системах предсказывается по данным о бинарных. В этом состоит главное преимущество уравнений Вильсона (и других уравнений локального состава) перед более ранними уравнениями для коэффициентов активности.
Другое достоинство модели Вильсона в приближенном учете влияния температуры на G E и γi . При Сij =const температурная зависимость передается через величины λij . Это облегчает описание парожидкостного равновесия в неизотермических условиях.
Серьезный недостаток модели Вильсона – ее неспособность описывать свойства расслаивающихся растворов (ни при каких значениях параметров модели не удовлетворяется термодинамическое условие неустойчивости системы относительно образования новой фазы).
Одна из модификаций уравнения Вильсона была предложена Цубокой и Катаямой. Для расчетов избыточной энергии Гиббса эти авторы используют следующее выражение:
где Vij (=Vi /Vj ) – соотношения молярных объемов, и если эти соотношения равны единице, то получаем уравнение Вильсона. Уравнения для определения коэффициентов активности бинарных смесей соответственно принимают следующий вид [3]:
В системах с гомогенными растворами уравнение Цубоки – Катаямы дают в среднем те же результаты, что и уравнения Вильсона, однако, в отличие от последних, они применимы и к расслаивающимся растворам. По качеству описания равновесий жидких фаз они нередко превосходят уравнения NRTL, несмотря на меньшее число оцениваемых параметров.
Уравнение NRTL для избыточной энергии Гиббса выводят, основываясь на теории, согласно которой жидкость в двухкомпонентной смеси имеет ячеистую структуру. Причем эти ячейки состоят из молекул типа 1 и 2, каждая из которых окружена такими же молекулами, которые в свою очередь имеют аналогичное окружение, и т.д. Гиббсовы энергии взаимодействия между молекулами обозначают символом gij , где подстрочным индексом j указывают центральную молекулу; таким же образом обозначают и мольные доли в окружающих зонах хij .
Gij =exp(-αij τij ) ; τij =Cij /RT ;
Общее число независимых параметров уравнения, описывающего бинарный раствор, равно трем: αij , Cij , Cji . При недостаточно полной или недостаточно точной экспериментальной информации о системе оценка параметра αij ненадежна. В этом случае его значение часто задают априори – в соответствии с химической природой системы и следующими рекомендациями авторов уравнения:
αij = 0,2 для смесей насыщенных углеводородов с полярными неассоциированными жидкостями, для систем с малой взаимной растворимостью компонентов;
αij = 0,3 для систем с небольшими отклонениями от идеальности, для смесей воды с полярными растворителями;
αij = 0,4 для смесей насыщенных углеводородов с перфторуглеводородами;
αij = 0,47 для смесей полярных веществ (например, спиртов, пиридина) с неполярными веществами, с водой, для смесей полярных веществ с четыреххлористым углеродом.
Математическая форма уравнений обеспечивает модели NRTL большую гибкость, способность описывать самые различные типы зависимости коэффициентов активности от состава. Сохраняя основные достоинства уравнений Вильсона, уравнения NRTL способны также описывать системы с расслаиванием, благодаря чему часто используются для расчета равновесий жидкость – жидкость и жидкость – жидкость – пар [7].
Преимущества и недостатки уравнения NRTL [3].
При помощи трехпараметрического уравнения NRTL можно, как правило, достаточно хорошо представит данные о равновесии в бинарных системах. Преимущество этого уравнения по сравнению с уравнениями Маргулеса и Ван-Лаара состоит в том. Что его можно применять к многокомпонентным смесям, основываясь только на бинарных параметрах, а по сравнению с уравнениями Вильсона – в том, что его можно использовать для представления равновесия жидкость-жидкость, хотя уравнение Цубоки-Катаямы-Вильсона также применимо в этих целях. В некоторых случаях какое-либо одно из уравнений дает лучшие результаты при описании равновесия пар-жидкость, но поскольку уравнение NRTL трехпараметрическое, оно обычно предпочтительнее, чем уравнение Вильсона или UNIQUAC.
При выводе уравнения UNIQUAC ,носившим получеткий характер, Абрамс и Праузниц исходили из модели двух жидкостей и концепции локального состава. Используемая ими модель предполагает, что избыточная энергия Гиббса обусловлена, во-первых, различием размеров и форм молекул (конфигурационная или комбинаторная составляющие) и, во-вторых, энергией взаимодействия молекул (вторая составляющая избыточной энергии Гиббса) [3].
gi – параметр площади компонента i; ri – параметр объема компонента i;z – координационное число;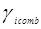
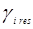
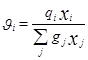
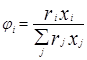
По качеству описания равновесий жидкость – пар и жидкость – жидкость модель UNIQUAC в среднем соответствует модели NRTL, но содержит, в расчете на пару компонентов, на один оцениваемый параметр меньше. Последнее важно при расчете параметров для бинарных систем с малой взаимной растворимостью компонентов, когда для обоснованного расчета трех параметров данных недостаточно, а также в любом другом случае очень ограниченной экспериментальной информации о системе. Ценное свойство модели – учет в явной форме комбинаторного вклада в G Е , что позволяет применить модель к растворам полимеров [7].
Уравнение Маргулиса, Ван Лара и связанные с ними алгебраические выражения характеризуются относительной простотой математического аппарата, легкостью оценки параметров по данным о коэффициентах активности и адекватным представлением двухкомпонентных смесей, значительно отклоняющихся от идеальных, включая частично растворимые жидкие системы. Эти уравнения не применимы к многокомпонентным системам, если отсутствуют параметры взаимодействия между тремя и более компонентами.
Уравнение Вильсона позволяет точно представить равновесие пар – жидкость в двух- и многокомпонентных смесях с использованием только параметров бинарного взаимодействия. В силу большей простоты этого уравнения его использование может быть предпочтительным для решения указанной задачи, чем применение уравнений NRTLи UNIQUAC. Уравнение Вильсона нельзя непосредственно применять для представления равновесия жидкость – жидкость; использование в этих целях его столь же простой модификации, уравнения Цубуки – Катаямы – Вильсона, дает удовлетворительные результаты, хотя последнее не было подвергнуто тщательной экспериментальной проверке, как другие уравнения.
При помощи уравнения NRTL можно достаточно верно представить равновесие пар – жидкость и жидкость – жидкость в двух- и многокомпонентных системах, а применительно к водным системам оно часто превосходит другие уравнения. Это уравнение проще по форме, чем уравнение UNIQUAC, однако его недостаток состоит в том, что для каждой пары составляющих необходимы три параметра. Величину третьего параметра часто можно получить исходя из химической природы компонентов.
Уравнение UNIQUAC – наиболее сложное в алгебраическом отношении, хотя в нем используется только по два параметра для каждой пары компонентов. В уравнении учитываются сведения о площадях поверхности и объемах молекул чистых компонентов, которые можно определить по данным о структуре, в силу чего этот метод представляется особенно эффективным применительно к смесям, молекулы которых значительно различаются по размеру. Уравнение UNIQUAC применимо для представления равновесия пар – жидкость и жидкость – жидкость в многокомпонентных смесях при использовании только параметров бинарного взаимодействия и данных о чистых компонентах [3].
Математическое описание совмещенных реакционно-ректификационных процессов, а также синтез принципиальной технологической схемы получения конечных продуктов предполагает обязательное наличие данных по фазовому равновесию жидкость – пар, в связи, с чем исследование и математическое описание условий парожидкостного равновесия является одной из важнейших задач. Экспериментальное определение равновесия жидкость – пар в многокомпонентных системах весьма трудоемко. Поэтому целесообразно провести исследования в составляющих наименьшей размерности (бинарных, тройных системах) и в случае адекватного описания этих данных фазовые равновесия в системах большей размерности моделируются с незначительной ошибкой, сопоставимой с ошибкой эксперимента.
Моделирование фазового равновесия в реакционной смеси, содержащей АПА, МЦПК и УК, проводилось на основе уравнений «локальных составов», учитывающих связь между избыточной энергией Гиббса и параметрами; характеризующими различие в размерах молекул и в величинах межмолекулярного взаимодействия неидеальных растворов.
Уравнения Вильсона, NRTL и UNIQUAC были использованы для моделирования парожидкостного равновесия в бинарной системе МЦПК-УК, а также АПА-МЦПК, АПА-УК и трехкомпонентной системе АПА-МЦПК-УК. Данная смесь содержит бинарный гомогенный азеотроп с минимумом температуры кипения на стороне МЦПК-УК. Результаты приведены в таблице:
| Расчетные данные | NRTL | UNIQUAC | Wilson | ||||
| DT | DY | DT | DY | DT | DY | ||
| МЦПК-АПА | mean | 3,49 | 0,0656 | 3,67 | 0,0649 | 3,56 | 0,0657 |
| max | 6,01 | 0,1005 | 6,68 | 0,1004 | 5,97 | 0,1005 | |
| B12 = | 3,15E+02 | Del = | -2,53E+02 | A12 = | 4,93E+02 | ||
| B21 = | 1,38E+02 | Del = | 1,16E+03 | A21 = | 4,65E+02 | ||
| Alpha = | 2,72E-01 | ||||||
| УК-АПА | mean | 4,46 | 0,0373 | 4,39 | 0,0391 | 4,82 | 0,0377 |
| max | 9,34 | 0,0741 | 9,58 | 0,0756 | 9,45 | 0,0755 | |
| B12 = | 9,04E+02 | Del = | 1,03E+02 | A12 = | 4,28E+02 | ||
| B21 = | -2,81E+02 | Del = | 5,74E+02 | A21 = | 6,81E+02 | ||
| Alpha = | 2,00E-01 | ||||||
| МЦПК-УК | mean | 0,21 | 0,0079 | 0,22 | 0,0091 | 0,37 | 0,0105 |
| max | 0,67 | 0,0177 | 0,62 | 0,0161 | 0,59 | 0,0193 | |
| B12 = | 7,56E+02 | Del = | 6,74E+02 | A12 = | -1,00E+03 | ||
| B21 = | -4,73E+02 | Del = | -3,85E+02 | A21 = | 1,52E+03 | ||
| Alpha = | 2,03E-01 | ||||||
На основе полученных данных можно сделать вывод, что для описания парожидкостного равновесия реакционной смеси получения МЦПК наилучшей моделью является NRTL.
Видео:Юля Паршута - Квартирник у Маргулиса (LIVE, 2023)Скачать

Парциальные молярные величины. Физический смыл ПМВ. Уравнение Гиббса-Дюгема и Дюгема-Маргулиса. Методы определения ПМВ.
Читайте также:
|