§4 Закон Максвелла о распределении по скоростям и энергиям
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного ( p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv .
Для вывода функции распределения молекул по скоростям f ( v ) равной отношению числа молекул dN, скорости которых лежат в интервале v ÷ v + dv к общему числу молекул N и величине интервала dv
Максвелл использовал два предложения:
а) все направления в пространстве равноправны и поэтому любое направление движения частицы, т.е. любое направление скорости одинаково вероятно. Это свойство иногда называют свойством изотропности функции распределения.
б) движение по трем взаимно перпендикулярным осям независимы т.е. х-компоненты скорости 



Считается также, что газ состоит из очень большого числа N тождественных молекул находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Силовые поля на газ не действуют.
Функции f ( v ) определяет относительное число молекул dN ( v )/ N скорости которых лежат в интервале от v до v + dv (например: газ имеет N = 10 6 молекул, при этом dN = 100
молекул имеют скорости от v =100 до v + dv =101 м/с ( dv = 1 м 

Используя методы теории вероятностей, Максвелл нашел функцию f ( v ) — закон распределения молекул идеального газа по скоростям:
f ( v ) зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т)
f ( v ) зависит от отношения кинетической энергии молекулы, отвечающей рассматриваемой скорости 










X >=
Тогда средняя арифметическая скорость молекул
и интегрируя по частям получили
Скорости, характеризующие состояние газа
§5 Экспериментальная проверка закона распределения Максвелла — опыт Штерна

Изображение щели получается размытым. Исследуя толщину осаждённого слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
§6 Барометрическая формула
Распределение Больцмана
До сих пор рассматривалось поведение идеального газа, не подверженного воздействию внешних силовых полей. Из опыта хорошо известно, что при действии внешних сил равномерное распространение частиц в пространстве может нарушиться. Так под действием силы тяжести молекулы стремятся опуститься на дно сосуда. Интенсивное тепловое движение препятствует осаждению, и молекулы распространяются так, что их концентрация постепенно уменьшается по мере увеличения высоты.
Выведем закон изменения давления с высотой предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте h равно p , то на высоте h + dh оно равно p + dp (при dh > 0, dp p уменьшается с увеличением h ).




Тогда
Из уравнения Менделеева-Клапейрона.
Пропотенцируем данное выражение (
Барометрическая формула, показывает, как меняется давление с высотой
При

n 
n 0 



§7 Опытное определение постоянной Авогадро
Ж. Перрен (французкий ученый) в 1909 г. исследовал поведение броуновских частиц в эмульсии гуммигута (сок деревьев) с размерами осматривались с помощью микроскопа, который имел глубину поля — 1мкм. Перемещая микроскоп в вертикальном направлении можно было исследовать распределение броуновских частиц по высоте.
Применив к ним распределение Больцмана можно записать
n = 
m — масса вытесненной жидкости:
Если n 1 и n 2 концентрация частиц на уровнях h 1 и h 2 , а k = R / NA , то
NA=
Значение 

- Закон Максвелла. Распределение Максвелла по скоростям
- Исторический очерк
- Идеальный газ. Основные постулаты МКТ
- Закон распределения Максвелла
- Графическое изображение плотности вероятности f(v)
- Важные виды скорости для функции f(v)
- Важность величины v3
- Зависимость функции f(v) от температуры
- Задача с молекулами азота в воздухе
- Задача с кислородом в баллоне
- Закон распределения молекул по скоростям
- Распределение Максвелла
- Как выглядит распределение Максвелла на графике
- 📺 Видео
Видео:Рассмотрение темы: "Распределение Максвелла"Скачать

Закон Максвелла. Распределение Максвелла по скоростям
Изучение свойств газового агрегатного состояния материи является одним из важных направлений современной физики. Рассматривая газы в микроскопическом масштабе, можно получить все макроскопические параметры системы. В данной статье будет раскрыт важный вопрос молекулярно-кинетической теории газов: что собой представляет распределение Максвелла молекул по скоростям.
Видео:Урок 153. Распределение молекул по скоростямСкачать

Исторический очерк
Идея о газе как системы, состоящей из микроскопических движущихся частиц, возникла еще в Античной Греции. Чтобы она получила свое развитие, науке понадобилось более 1700 лет.
Основоположником современной молекулярно-кинетической теории (МКТ) газа справедливо считать Даниила Бернулли. В 1738 году он опубликовал работу, которая называлась «Гидродинамика». В ней Бернулли изложил идеи МКТ, используемые до настоящего времени. Так, ученый полагал, что газы состоят из частиц, которые хаотически движутся во всех направлениях. Многочисленные соударения частиц со стенками сосудов воспринимаются, как наличие в газах давления. Скорости частиц тесно связаны с температурой системы. Сообщество ученых не приняло смелые идеи Бернулли, поскольку еще не был установлен закон сохранения энергии.
Впоследствии многие ученые занимались построением кинетической модели газов. Среди них следует отметить Рудольфа Клаузиуса, который в 1857 году создал простую газовую модель. В ней ученый уделил особое внимание наличию поступательных, вращательных и колебательных степеней свободы у молекул.
В 1859 году, изучая работы Клаузиуса, Джеймс Максвелл сформулировал так называемое распределение Максвелла по скоростям молекул. По сути, Максвелл подтвердил идеи МКТ, подкрепив их математическим аппаратом. Впоследствии Людвиг Больцман (1871 год) обобщил выводы распределения Максвелла. Он постулировал более общее статистическое распределение молекул по скоростям и энергиям. Оно в настоящее время известно, как распределение Максвелла — Больцмана.
Видео:Распределение Максвелла — Больцмана (часть 6) | Термодинамика | ФизикаСкачать

Идеальный газ. Основные постулаты МКТ
Чтобы понять, что собой представляет функция распределения Максвелла, необходимо четко разобраться с системами, для которых эта функция применима. Речь идет об идеальном газе. В физике под этой концепцией понимают текучую субстанцию, которая состоит из практически безразмерных частиц, не обладающих потенциальной энергией. Эти частицы движутся с большими скоростями, поэтому их поведение полностью определяется кинетической энергией. Более того, дистанции между частицами слишком велики по сравнению с их размерами, поэтому последними пренебрегают.
Идеальные газы описываются в рамках МКТ. Основными ее постулатами являются следующие:
- газовые системы состоят из огромного числа свободных частиц;
- частицы хаотически движутся с разными скоростями в разных направлениях по прямым траекториям;
- частицы сталкиваются со стенками сосудов упруго (вероятность столкновения частиц друг с другом невелика, ввиду их малых размеров);
- температура системы однозначно определяется средней кинетической энергией частиц, которая сохраняется во времени в случае установления в системе термодинамического равновесия.
Видео:22. Распределение МаксвеллаСкачать

Закон распределения Максвелла
Если бы человек обладал прибором, с помощью которого можно было измерить скорость отдельной молекулы газа, то, проведя соответствующий эксперимент, он был бы удивлен. Эксперимент бы показал, что каждая молекула любой газовой системы движется с совершенно произвольной скоростью. При этом в рамках одной системы, находящейся в тепловом равновесии с окружающей средой, были бы обнаружены как очень медленные, так и очень быстрые молекулы.
Закон распределения Максвелла по скоростям молекул газа представляет собой инструмент, позволяющий определить вероятность обнаружения частиц с заданной скоростью v в изучаемой системе. Соответствующая функция выглядит следующим образом:
В этом выражении m — масса частицы (молекулы), k — константа Больцмана, T — абсолютная температура. Таким образом, если известна химическая природа частиц (значение m), то функция f(v) однозначно определяется абсолютной температурой. Функция f(v) называется плотностью вероятности. Если взять от нее интеграл для некоторого предела скоростей (v; v+dv), то мы получим количество частиц Ni, которые имеют скорости в указанном промежутке. Соответственно, если взять интеграл от плотности вероятности f(v) для пределов скоростей от 0 до ∞, то мы получим полное число молекул N в системе.
Видео:Распределения Максвелла. Часть 1. Скорости газовых молекул. График распределения МаксвеллаСкачать

Графическое изображение плотности вероятности f(v)
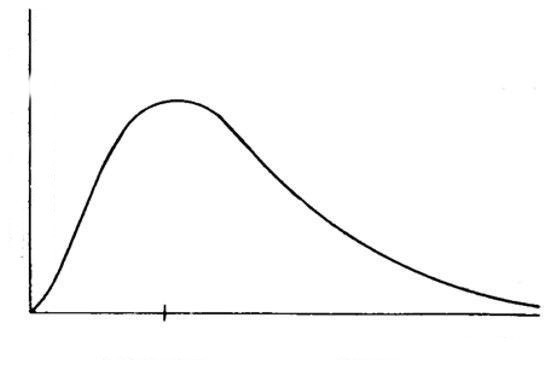
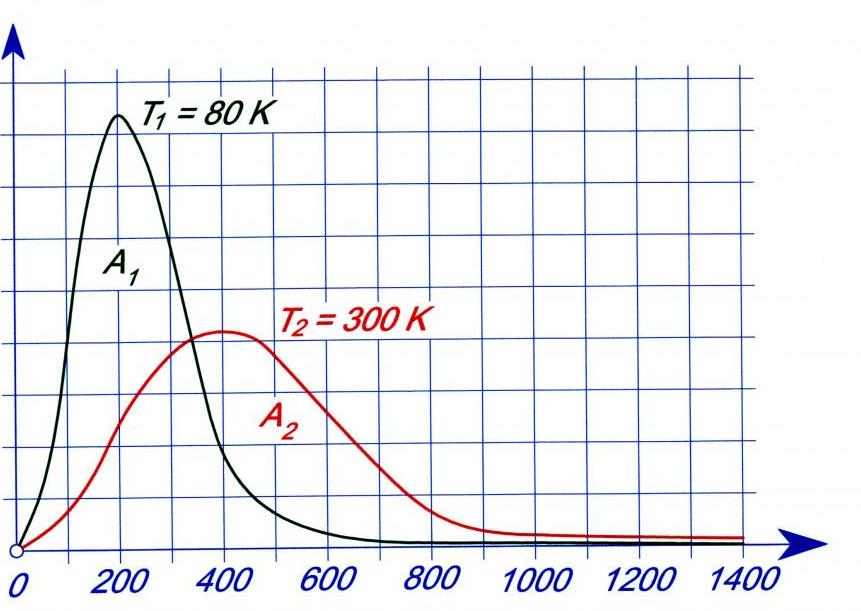
Функция плотности вероятности имеет несколько сложный математический вид, поэтому нелегко представить ее поведение при данной температуре. Эту задачу можно решить, если изобразить ее на двумерном графике. Схематический вид графика распределения Максвелла изображен ниже на рисунке.
Мы видим, что он начинается с нуля, поскольку скорость v молекул не может иметь отрицательных значений. Заканчивается график где-то в области больших скоростей, плавно спадая до нуля (f(∞)->0). Также бросается в глаза следующая особенность: плавная кривая является несимметричной, она более резко убывает для небольших значений скоростей.
Важной особенностью поведения функции плотности вероятности f(v) является наличие на ней одного выраженного максимума. Согласно физическому смыслу функции, этот максимум соответствует наиболее вероятному значению скоростей молекул в газовой системе.
Видео:Моделирование распределения Максвелла ч.2: Построение гистограммы распределения молекул по скоростямСкачать

Важные виды скорости для функции f(v)
Функция плотности вероятности f(v) и ее графическое изображение позволяют дать определение трем важным видам скорости.
Первым видом скорости, который является очевидным, и который был упомянут выше, является наиболее вероятная скорость v1. На графике ее значение соответствует максимуму функции f(v). Именно эту скорость и близкие к ней значения будут иметь большинство частиц системы. Вычислить ее не представляет особого труда, для этого достаточно взять первую производную по скорости от функции f(v) и приравнять ее нулю. В результате проведения указанных математических операций получаем конечный результат:
Здесь R — универсальная газовая постоянная, M — молярная масса молекул.
Вторым видом скорости является среднее ее значение для всех N частиц. Обозначим ее v2. Рассчитать ее можно, если проинтегрировать функцию v*f(v) по всем скоростям. Результатом отмеченного интегрирования будет следующая формула:
Поскольку отношение 8/pi>2, то средняя скорость всегда несколько больше, чем наиболее вероятная.
Каждый человек, который немного знаком с физикой, понимает, что средняя скорость v2 молекул должна иметь большое значение в газовой системе. Тем не менее это ошибочное суждение. Гораздо более важной является средняя квадратичная скорость. Обозначим ее v3.
Согласно определению, средняя квадратичная скорость является суммой квадратов индивидуальных скоростей всех частиц, деленная на число этих частиц, и взятая под квадратный корень. Рассчитать ее для распределения Максвелла можно, если определить интеграл по всем скоростям от функции v 2 *f(v). Формула для средней скорости квадратичной примет вид:
Равенство показывает, что эта скорость больше, чем значения v2 и v1 для любой газовой системы.
Таким образом, все рассмотренные виды скоростей на графике распределения Максвелла лежат либо на экстремуме, либо правее его.
Видео:Урок 155. Изучение распределения МаксвеллаСкачать

Важность величины v3
Выше было отмечено, что скорость средняя квадратичная является более важной для понимания физических процессов и свойств газовой системы, чем простая средняя скорость v2. Это действительно так, поскольку кинетическая энергия идеального газа зависит именно от величины v3, а не от v2.
Если рассматривать одноатомный идеальный газ, то для него справедливо следующее выражение:
Здесь каждая часть равенства представляет собой кинетическую энергию одной частицы массой m. Почему в выражении стоит именно величина v3, а не средняя скорость v2? Очень просто: при определении кинетической энергии каждой частицы ее индивидуальная скорость v возводится в квадрат, затем все скорости складываются и делятся на количество частиц N. То есть сама процедура определения кинетической энергии приводит к величине средней квадратичной скорости.
Видео:Билеты №32, 33 "Уравнения Максвелла"Скачать

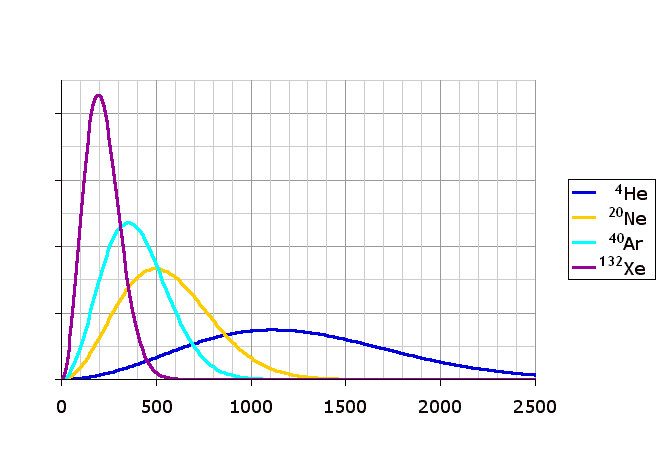
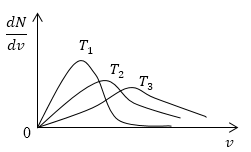
Зависимость функции f(v) от температуры
Выше мы установили, что плотность вероятности скоростей молекул однозначно зависит от температуры. Как будет изменяться функция, если увеличивать или уменьшать величину T? Ответить на этот вопрос поможет график ниже.
Видно, что нагрев закрытой системы приводит к размазыванию пика и его смещению в сторону более высоких скоростей. Увеличение температуры приводит к увеличению всех видов скоростей и к уменьшению плотности вероятности каждой из них. Значение пика уменьшается по причине сохранения количества частиц N в закрытой системе.
Далее, решим пару задач для закрепления полученного теоретического материала.
Видео:Опыт Штерна. Распределение МаксвеллаСкачать

Задача с молекулами азота в воздухе
Необходимо рассчитать скорости v1, v2 и v3 для азота воздуха при температуре 300 К (около 27 o C).
Молярная масса азота N2 равна 28 г/моль. Пользуясь приведенными формулами, получаем:
Видео:Разбор тренировочных упражнений на среднюю квадратичную скорость и распределение МаксвеллаСкачать

Задача с кислородом в баллоне
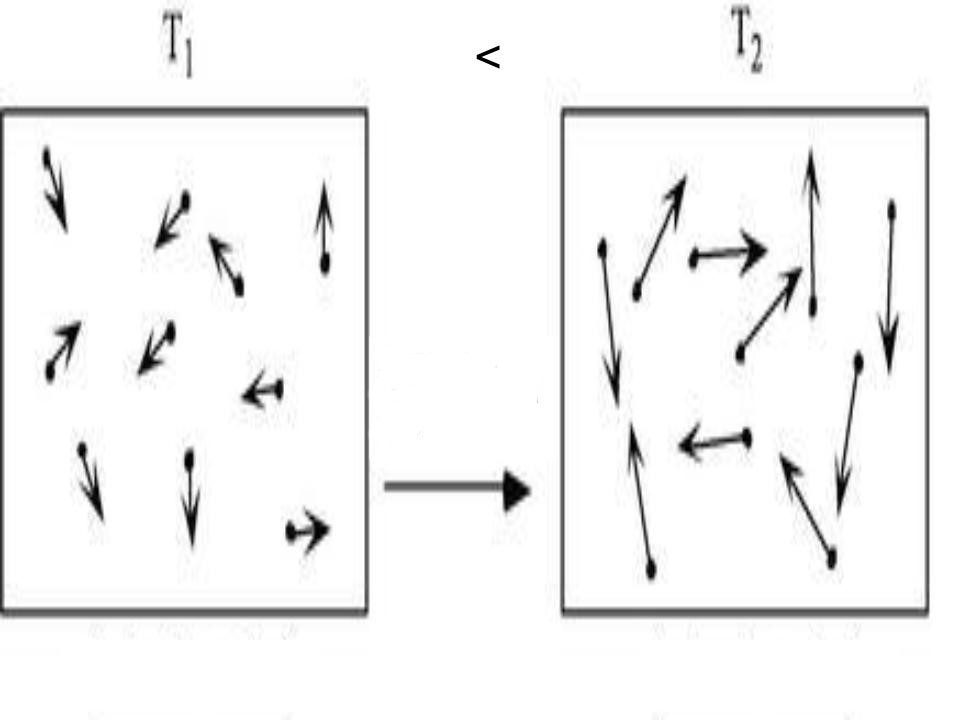
Кислород в баллоне находился при некоторой температуре T1. Затем баллон поместили в более холодное помещение. Как изменится график распределения Максвелла по скоростям для молекул кислорода, когда система придет в термодинамическое равновесие?
Вспоминая теорию, можно ответить так на вопрос задачи: значения всех видов скоростей молекул уменьшатся, пик функции f(v) сместится влево, станет более узким и более высоким.
Видео:24. Задачи на распределение МаксвеллаСкачать

Закон распределения молекул по скоростям
С помощью закона распределения молекул по скоростям мы можем описать, как именно в макроскопической системе происходит распределение частиц (при условии ее нахождения в термодинамическом равновесии). Такое распределение называется стационарным, и воздействия внешних сил на систему при этом не происходит.
Данный закон распространяется как на жидкости, так и на газы, если на них действуют законы классической механики. Если мы знаем, как именно распределяются молекулы по своим скоростям, значит, мы можем ответить, какой объем молекул имеет определенную скорость в условиях заданной температуры в равновесном состоянии.
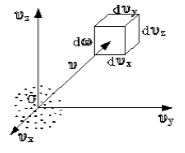
Чтобы лучше объяснить данный вопрос, начнем с введения такого понятия, как пространство скоростей. Оно изображено схематически на рисунке 1 .
Мы видим, что в декартовой системе координат здесь отмечены именно проекции скоростей, а не координаты. Тогда исходный вопрос можно переформулировать так: «Как именно будут распределяться молекулы в пространстве скоростей»?
Очевидно, что данное распределение не будет равномерным. Если в пространстве мы выделим параллелепипед, имеющий объем d ω = d υ x d υ y d υ z , то в нем окажется d N υ молекул. Обозначим буквой N число молекул газа, тогда f ( v ) будет некоторой функцией скорости.
Видео:Караваев В. А. - Молекулярная физика - Распределение МаксвеллаСкачать
Распределение Максвелла
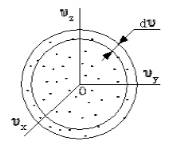
Поскольку, как мы уже отмечали, газ находится в равновесном состоянии, то направления движений частиц являются равноправными. Значит, допустимо считать, что в пространстве скоростей распределение молекул является симметричным и имеет сферическую форму.
Определим, из скольких молекул состоит шаровой слой d υ . Разделим найденное выше число на количество частиц ( N ) и получим вероятность d W υ того, что пределы модуля скорости молекулы равны υ — υ + d v .
Здесь F ( v ) является функцией распределения вероятности значения v . Впервые данная функция теоретически была получена Д. Максвеллом.
Таким образом, закон распределения молекул по модулям скоростей имеет следующий вид:
d N υ = N 4 π m 0 2 πkT 3 2 e x p — m 0 υ 2 2 k T υ 2 d υ .
Здесь υ = υ x 2 + υ y 2 + υ z 2 , масса молекулы равна m 0 , а k – постоянная Больцмана.
По проекциям скоростей распределение Максвелла может быть записано так:
d N = N f υ x f υ y f υ z d υ x d υ y d υ z .
Важно учесть, что:
f υ i = m 0 2 πkT 1 2 e x p — m 0 υ i 2 2 k T ( i = x , y , z ) .
Параметры υ x , υ y , υ z означают проекции скоростей молекул на оси координат.
Также возможен следующий вариант записи распределения Максвелла:
d N = N 4 π υ v e r 3 e x p — υ υ v e r 2 υ 2 d υ .
Здесь υ υ e r обозначает наиболее вероятную скорость движения молекулы.
Видео:Основы молекулярной физики | распределение молекул по скоростям | 1Скачать
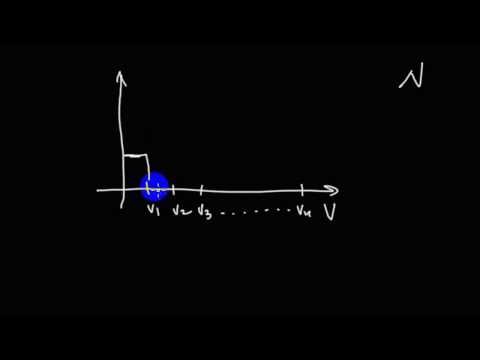
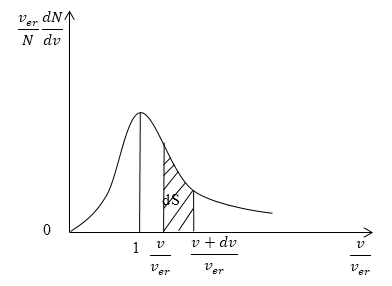
Как выглядит распределение Максвелла на графике
Кривая распределения молекул по скоростям на графике выглядит так:
При этом доля тех молекул, которые движутся со скоростями в интервале от υ до υ + d υ будет пропорциональна площади d S , которая на графике обозначена штриховкой.
Скорости всех молекул принадлежат интервалу от нуля до плюс бесконечности, значит, будет верным равенство:
∫ 0 ∞ f ( υ ) d υ = 1 .
Оно называется условием нормировки функции распределения.
Следовательно, распределение Максвелла по скоростям имеет зависимость от температуры газа и массы его молекул. Объем и давление можно не учитывать.
Условие: вычислите, какова будет наиболее вероятная скорость молекул газа при температуре Т в равновесном состоянии.
Нам потребуется распределение Максвелла (распределение по модулям скоростей).
d N υ = N 4 π m 0 2 π k T 3 2 e x p — m 0 υ 2 2 k T υ 2 d υ .
Максимум функции будет соответствовать самой вероятной скорости. Дифференциация выражения по скорости и сравнение ее с нулем даст нам следующий результат:
d N υ d υ = N 4 π m 0 2 πkT 3 2 2 υ υ e r e x p — m 0 υ υ e r 2 2 k T — υ υ e r 2 m 0 2 υ υ e r 2 k T e x p — m 0 υ υ e r 2 2 k T = 0 ;
2 υ υ e r — υ υ e r 2 m 0 2 υ υ e r 2 k T = 0 → 1 — υ υ e r 2 m 0 2 k T = 0 → υ υ e r 2 = 2 k T m 0 .
υ υ e r = 2 k T m 0 .
Ответ: наиболее вероятно, что скорость газа будет равна υ υ e r = 2 k T m 0 .
Условие: изобразите кривые распределения скоростей молекул газа при росте температуры Т .
Возьмем формулу наиболее вероятной скорости из предыдущей задачи.
υ υ e r = 2 k T m 0
Понятно, что чем больше будет температура, тем выше будет скорость молекул, т.е. произойдет смещение максимума в сторону больших скоростей. Поскольку площадь под кривой распределения является постоянной величиной, кривые на графике будут показаны следующим образом:
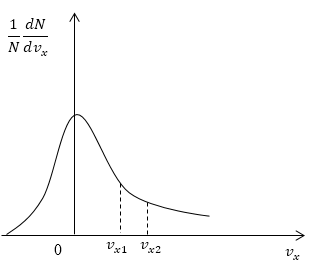
Условие: дан график функции, по которой молекулы будут распределяться с учетом проекций скорости υ x . Сопоставьте количества молекул, проекции скорости которых будут принадлежать интервалам от нуля до υ x 1 и от υ x 1 до υ x 2 .
Как мы уже указывали ранее, доля молекул газа, скорости которых лежат в первом интервале, будет пропорциональна площади фигуры, образуемой кривой распределения, вертикальной осью 0 1 N d N d υ x и вертикальным пунктиром, перпендикулярным оси проекций. Во втором интервале нужная доля будет пропорциональна площади фигуры, ограниченной кривой распределения и вертикальной прямой, параллельной оси о х и проходящей через точку υ x 1 . Очевидно, что площадь первой фигуры будет меньше площади второй. Значит, и молекул, проекции скоростей которых лежат в первом интервале, будет меньше, чем во втором.
Ответ: молекул, имеющих проекции скорости в интервалах: от 0 до υ x 1 меньше, чем молекул, имеющих проекции скорости в интервалах: от υ x 1 до υ x 2 .
📺 Видео
10 класс. Моделирование идеального газа. Распределение молекул по скоростям.Скачать

ЧК_МИФ РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА ПО ПРОЕКЦИЯМ СКОРОСТЕЙСкачать

Александр Чирцов про функции распределения МаксвеллаСкачать

О чем говорят уравнения Максвелла? Видео 1/2Скачать

Распределения Максвелла.Скачать

ЧК_МИФ: 4.1.1.ДФ_1 Физический смысл уравнений МаксвеллаСкачать

ЧК_МИФ РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА ПО ПРОЕКЦИЯМ СКОРОСТЕЙСкачать